Fischer-Projektion
Die Fischer-Projektion ist eine Methode, die Raumstruktur einer linearen, chiralen chemischen Verbindung eindeutig zweidimensional abzubilden. Sie wurde von Emil Fischer entwickelt und wird häufig für Moleküle mit mehreren, benachbarten Stereozentren wie Zuckern verwendet.
Regeln

Bei vielen chemischen Verbindungen ist die Stellung der Atome im Raum entscheidend für ihre Eigenschaften, was eine Unterscheidung verschiedener Stereoisomere notwendig macht. Vor allem bei Kohlenstoffverbindungen ist es oft schwierig, die räumliche Ausrichtung der bis zu vier Bindungspartner im Tetraederwinkel von 109,5° deutlich zu machen.
Die Fischer-Projektion löst dieses Problem ohne perspektivische Mittel durch Einhaltung folgender Regeln beim Zeichnen des Moleküls:
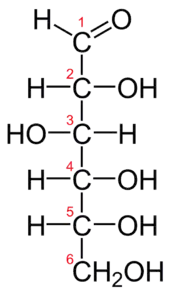
- Eine Kette von C-Atomen wird von oben nach unten gezeichnet, wobei das am stärksten oxidierte Atom oben steht. Nach den Regeln über die Nomenklatur der Kohlenwasserstoffe steht das Kohlenstoffatom mit der Nummer 1 oben. Dies muss nicht immer das am stärksten oxidierte Kohlenstoffatom sein, ist es aber in den meisten Fällen.[1] Es gibt aber auch vereinbarte Ausnahmen wie z. B. die Galacturonsäure, die formal eine oxidierte Form der D-Galactose ist. Das höchst oxidierte Kohlenstoffatom ist in diesem Fall das C-Atom mit der Nr. 6, und man hält an der Nummerierung der D-Galactose fest.
- Horizontale (waagerechte) Linien zeigen aus der Projektionsebene hinaus auf den Betrachter zu. Dies kann auch durch ausgefüllte, zum Zentrum hin dünner werdende Keile angedeutet werden.[2]
- Vertikale (senkrechte) Linien laufen hinter die Projektionsebene, vom Betrachter weg. Dies kann auch durch quergestrichelte, zum Zentrum hin ebenfalls dünner werdende Keile angedeutet werden.[2]
Außerdem ist der Kohlenstoff das implizite Atom, d. h., das „C“ kann insbesondere in den Chiralitätszentren weg gelassen werden, dann steht ein Kreuz für das Kohlenstoffatom.
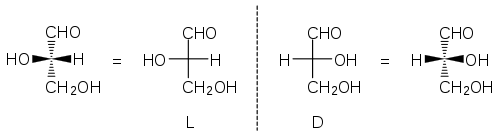
Als Beispiel sind die Fischerprojektionen der beiden Enantiomeren des Glycerinaldehyds angegeben, sowie die entsprechenden Keilstrichformeln. Mit den Stereodeskriptoren D (von lateinisch dexter ‚rechts‘) und L (lateinisch laevus ‚links‘) wird dann die Konfiguration des untersten Stereozentrums angegeben, je nachdem, ob derjenige horizontale Rest mit der höheren Priorität (hier: OH > H) nach rechts (D) oder nach links (L) zeigt. Beim Vorliegen mehrerer Stereozentren kann man nicht mehrere Ds und Ls anhäufen (s. unten)
Es ist wichtig zu erwähnen, dass die tatsächliche räumliche Struktur chiraler Moleküle zur Zeit Fischers nicht bekannt war. Man verwendete den Glycerinaldehyd als Referenzsubstanz („Fischer-Rosanoff-Konvention“[3]): Dem rechtsdrehenden Enantiomer wurde willkürlich die Projektion mit dem nach rechts zeigenden OH-Rest zugeteilt und diese daher als D-Konfiguration bezeichnet, ohne dass man wissen konnte, ob dies der Realität entsprach. Konnten andere Verbindungen (im Besonderen Zucker) zum rechtsdrehenden Glycerinaldehyd abgebaut werden, hatten sie unter dieser Annahme also auch D-Konfiguration.
1951 konnte Johannes Martin Bijvoet durch die Röntgenstrukturanalyse des Glycerinaldehyds die tatsächliche räumliche Struktur zeigen. Dabei stellte sich die willkürliche Annahme als zufällig richtig heraus: Die D- und (R)-Konfigurationen des Glycerinaldehyds sind identisch. Aus der D/L- oder (R/S)-Konfiguration kann nicht automatisch auf den Drehwinkel α oder die Drehrichtung [(+) oder (–)] der Polarisationsebene des linear polarisierten Lichts geschlossen werden. Beispiele:
- Bei der Weinsäure ist das D-Enantiomer links- und das L-Enantiomer rechtsdrehend. Der Drehwert α beträgt bei L-(+)-Weinsäure +12,7°, bei D-(−)-Weinsäure −12,7°[4] bei gleichen Messbedingungen.
- Ein einzelnes Enantiomer kann je nach pH-Wert eine unterschiedliche Drehrichtung aufweisen. So weist die Aminosäure L-Leucin bei Raumtemperatur in 6 molarer Salzsäure einen spezifischen Drehwinkel von +15,1° (= rechtsdrehend) und in neutralem Wasser einen von −10,8° (= linksdrehend) auf, in 3 molarer Natronlauge ist sie dagegen mit +7,6° wiederum rechtsdrehend.[5]
- L-Alanin [(S)-Alanin] hat einen Drehwinkel α von +13,0° (c=2 in 5 N Salzsäure)[6]
- L-Cystein [(R)-Cystein] hat einen Drehwinkel α von +7,9° (c=2 in 5 N Salzsäure)[6]
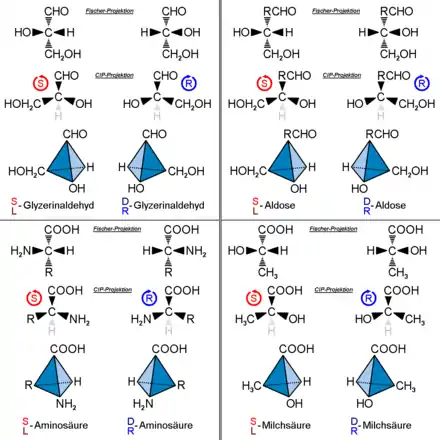
Liegen mehrere Stereozentren vor, können die Konfigurationen dieser nicht (wie beispielsweise bei der Cahn-Ingold-Prelog-Konvention) eine nach der anderen angegeben werden. Liegt mehr als ein Stereozentrum vor, gibt es mehr als zwei Stereoisomere, darunter Diastereomere und Enantiomere. Bei der Verwendung der Fischer-Nomenklatur ist es unumgänglich, Diastereomeren unterschiedliche Namen zu geben:
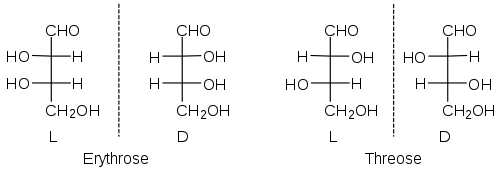
Erythrose und Threose sind beispielsweise zwei verschiedene Zucker, die sich nur durch die Konfigurationen an den beiden chiralen Zentren unterscheiden. Genauer, sie sind Diastereomere. Von beiden gibt es je ein Enantiomerenpaar. Die relative Konfiguration des oberen Stereozentrums wird also durch den Namen festgelegt: Bei der Erythrose zeigen die OH-Gruppen in die gleiche, bei der Threose in verschiedene Richtungen. Da aber z. B. C6-Aldosen (darunter die Glucose) 4 Stereozentren haben, gibt es 24 = 16 Stereoisomere. Das entspricht acht Enantiomerenpaaren, man muss sich also acht verschiedene Namen und acht verschiedene relative Konfigurationen für diese Gruppe von Zuckermolekülen merken.
Beispiele aus der Biochemie für D- und L-Verbindungen sind D-Glucose (Traubenzucker) und die Aminosäure L-Alanin.
Anwendung
Für ein Chiralitätszentrum
Es gibt auch eine Reihe von Regeln für die Interpretation einer Fischer-Projektion. Dadurch können Strukturen auf Isomerie untersucht werden, ohne sie sich dreidimensional vorstellen zu müssen, was oft sehr schwierig ist. Für eine Projektion mit einem zentralen Kohlenstoff und vier Substituenten gilt:
- Drehung um 180° (360°, …) ergibt dasselbe Molekül,
- Drehung um 90° (270°, …) ergibt das zugehörige Enantiomer.
- Eine (drei, fünf, …) Vertauschung(en) von je zwei Substituenten ergibt das Enantiomer,
- zwei (vier, sechs, …) Vertauschungen von je zwei Substituenten ergeben dasselbe Molekül.
Es sei erstens noch angemerkt, dass Kohlenstoffatome, die nicht vier verschiedene Substituenten besitzen, sondern mindestens zwei gleiche, eine Doppelbindung oder eine Dreifachbindung, keine Chiralitätszentren sind und deshalb für die obigen Regeln überflüssig sind. Zweitens sei darauf hingewiesen – so trivial es auch erscheint –, dass der gesamte Substituent bei der Feststellung von Unterschiedlichkeit verglichen werden muss, d. h. wenn an der einen Seite eine Propylkette und an der anderen eine Ethylkette gebunden sind, sind die Substituenten unterschiedlich.
Für mehrere Chiralitätszentren
Bei mehreren Chiralitätszentren gelten die Regeln genauso, und zwar für jedes einzelne Zentrum. Um die Isomerie eines Moleküls zu bestimmen, bietet sich die „Vertauschungsmethode“ an. Unterscheiden sich zwei Strukturen nur durch die Anordnung an den Chiralitätszentren, so gilt:
- Sie sind genau dann identisch, wenn jedes Zentrum identisch ist, also an jedem Zentrum zwei (oder auch null) Vertauschungen nötig sind, um die eine Struktur in die andere zu überführen,
- Sie sind genau dann Enantiomere, wenn das für jedes Zentrum gilt, also an jedem Zentrum eine Vertauschung nötig ist, um die eine Struktur in die andere zu überführen,
- Sie sind Diastereomere genau dann, wenn die beiden anderen Fälle nicht eintreten, d. h. zum Beispiel, wenn am einen Zentrum eine und am anderen zwei Vertauschungen nötig sind.
Als Beispiel soll das 1-Brom-2-methyl-butan-3-ol dienen:
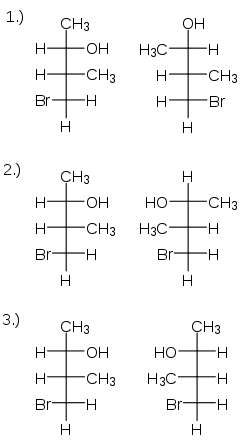
Die Nummerierung gehe von unten nach oben. Das unterste Kohlenstoffatom, nummeriert als eins, ist achiral und dient nur der Verwirrung. Die Kohlenstoffe zwei und drei sind chiral. Im ersten Fall ist Zentrum zwei offenbar identisch, bei Zentrum drei sind zwei Vertauschungen nötig, es ist auch identisch: Die Moleküle sind identisch. Im zweiten Fall braucht man an Zentrum zwei eine, an Nummer drei zwei Vertauschungen: Es sind Diastereomere. Im dritten Fall liegt eine Spiegelung vor (an beiden Zentren eine Vertauschung), es sind Enantiomere.
meso-Formen
In der Fischer-Projektion kann man leicht eine Symmetrieebene und zwei Isomere als meso-Formen erkennen.
Exemplarische Übersetzung offenkettiger Verbindungen in die Fischer-Projektion
Algorithmus zur Bestimmung der Fischerprojektion
Während die Überführung kurzkettiger organischer Verbindungen in die Fischer-Projektion meist leicht vorstellbar ist, kann die Projektion einer offenkettigen Hexose bereits Probleme hervorrufen. Um die Fischer-Projektion größerer, chiraler, organischer Aminosäuren oder Zucker zu bewerkstelligen bietet sich die schematische Betrachtung der Konfigurationsänderung an.
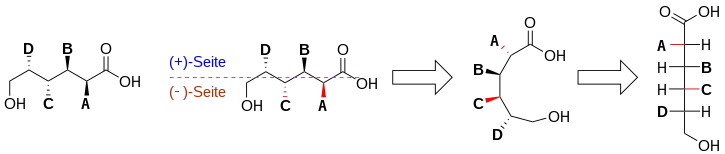
Schematisch folgt die Übersetzung einer chiralen Verbindung in die Fischer-Projektion folgendem Algorithmus:
- Der höchst oxidierte Kohlenstoff wird nach rechts gedreht.
- Die Kette wird in zwei rein methodische Seiten unterteilt. Oben (+)-Seite, unten (-)-Seite. ([+] und [-] sind hier rein didaktisch und unterscheiden sich grundlegend vom spezifischen Drehwinkel!)
- Die Kette wird entsprechend der Fischerprojektion gedreht, wobei alle Stereoinformationen der (+)-Seite erhalten bleiben und auf Grundlage der Drehungen mehrerer (C-C)-Bindungen alle Stereoinformationen der (-)-Seite invertiert werden.
- Die mit Schritt 3 erhaltene Struktur kann unmittelbar in die Fischer-Projektion überführt werden.
Diese Betrachtungsweise korreliert stark mit der Skelett-Struktur, die den tetraedrischen Bindungswinkel der sp3-hybridisierten Kohlenstoffe andeutet. Wird die Kette von Kohlenstoffatomen nun an einem Punkt (dem höchst oxidierten Kohlenstoff) fixiert, so ergibt sich das sich bei Drehung der (C-C)-Bindungen immer die Stereoinformationen an den Kohlenstoffen gerader, ganzzahliger Werte () invertiert.
Es sei an dieser Stelle angemerkt, dass es sich bei diesem Algorithmus um eine rein pragmatische Betrachtungsweise handelt.

Einzelnachweise
- Rules of Carbohydrate Nomenclature. In: The Journal of Organic Chemistry. Band 28, Nr. 2, 1963, S. 281–291, doi:10.1021/jo01037a001.
- Graphical representation of stereochemical configuration (IUPAC Recommendations 2006) In: Pure and Applied Chemistry. Band 78, Heft 10, S. 1897–1970, doi:10.1351/pac200678101897.
- Eintrag zu Fischer–Rosanoff convention (or Rosanoff convention). In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02392 – Version: 2.3.3.
- Eberhard Breitmaier, Günther Jung: Organische Chemie, Thieme Verlag, 4. Auflage, 2001.
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 5. Auflage, Springer, 2001, ISBN 3-540-41096-1, S. 14. eingeschränkte Vorschau in der Google-Buchsuche.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 30, 1982, ISBN 3-527-25892-2.