Acetonperoxid
Acetonperoxid oder APEX ist ein hochexplosiver Stoff mit der Schlagempfindlichkeit eines Initialsprengstoffs. Es kommt in den Formen di-, tri- und tetrameres cyclisches Acetonperoxid vor, die unter unterschiedlichen Bedingungen (z. B. in Abhängigkeit vom benutzten Katalysator) in verschiedenen Anteilen entstehen. Nach seiner hauptsächlich vorkommenden trimeren Form ist es auch unter dem Namen Triacetontriperoxid oder kurz TATP bekannt. Das nur in Lösung beständige Dimethyldioxiran kann als das monomere Acetonperoxid angesehen werden.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
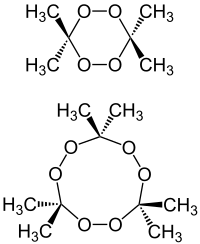 | ||||||||||
| Das Dimer (oben) und das Trimer (TATP, unten) | ||||||||||
| Allgemeines | ||||||||||
| Name | Acetonperoxid | |||||||||
| Andere Namen | ||||||||||
| Summenformel |
| |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 222,24 g·mol−1 (Trimer) | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,22 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Acetonperoxid ist, wie die meisten anderen organischen Peroxide und im Unterschied zu weniger gefährlichen Peroxiden wie etwa Dibenzoylperoxid, sehr empfindlich gegen Schlag, Reibung und Wärme. Es zerfällt leicht, was zu heftigen Detonationen führen kann. TATP ist ein häufig genutzter Sprengstoff bei Anschlägen islamistischer Terroristen.[5]
Geschichte
Acetonperoxid wurde im Jahr 1895 von Richard Wolffenstein an der Technischen Hochschule Charlottenburg bei der Untersuchung der Oxidation von Coniin mit Wasserstoffperoxid in Aceton als Lösungsmittel zufällig entdeckt.[6] Ein Herstellungsverfahren für Acetonperoxid wurde von ihm im Jahr 1895 unter der Nummer D.R.P. 84953 in Deutschland zum Patent angemeldet. Adolf von Baeyer und Victor Villiger publizierten im Jahr 1899 und 1900 einige Artikel über die Bildung dimeren und trimeren Acetonperoxids.[7][8] Im Jahr 1925 wurde es zwar unter der Nummer D.R.P. 423,176 in Deutschland und verschiedenen anderen Ländern von den Sprengstoffwerken Dr. R. Nahnsen & Co. AG, Hamburg als angeblich sicherer und stabiler Initialsprengstoff zum Patent angemeldet,[9] jedoch verhinderten die extreme Schlagempfindlichkeit, Flüchtigkeit (6,5 % in 24 h bei 14–18 °C) und mangelnde Stabilität jegliche praktische Nutzung.[10]
A. E. Thiemann schlug im Jahr 1942 die Nutzung von Acetonperoxid als Zusatz zur Verbesserung der Zündwilligkeit des Dieselkraftstoffs vor,[11] d. h. zur Erhöhung der Cetanzahl. Da es preisgünstigere und ungefährlichere Lösungen gibt, wird es für diesen Zweck nicht verwendet.
Darstellung
Acetonperoxid kann in erheblichen Mengen beim bloßen Vermischen von Aceton mit wasserstoffperoxidhaltigen Lösungen nach mehrtägiger Lagerung des Gemischs entstehen. So entdeckte es der Berliner Chemiker Richard Wolffenstein bereits 1895.[6]
Trimeres Acetonperoxid (Schmelzpunkt 91,5 °C) entsteht bei Einwirken von Wasserstoffperoxid auf Aceton in Gegenwart verdünnter Säuren als Katalysator:[6][8]

Bei Anwesenheit von Salzsäure, Schwefelsäure oder Phosphorsäure verlaufen die Reaktionen in Abhängigkeit vom pH-Wert unterschiedlich stark exotherm (Explosionsgefahr). Bei mangelnder Kühlung entsteht bei der Reaktion mit Salzsäure unter Kochen das Tränengas Chloraceton.
Das dimere Produkt lässt sich entweder durch die Umsetzung von Aceton mit Peroxomonoschwefelsäure (Carosche Säure),[7][12] durch die Oxidation von Diisopropylether mit Luftsauerstoff oder durch Ozonolyse herstellen. Bei unsachgemäßer Lagerung von Diisopropylether kann daher Acetonperoxid entstehen. Zur Vernichtung solcher Peroxide werden Kupfer(I)-Verbindungen zur Reduktion eingesetzt.
Tetrameres Acetonperoxid wurde 1998 in obiger Reaktion bei Verwendung von Lewis-Säuren als Katalysator gewonnen.[13]
Eigenschaften

Acetonperoxid ist flüchtig an Luft (würziger Geruch, Substanzverlust durch Sublimation 6,5 % in 24 Stunden)[1] und flüchtig mit Wasserdampf oder Ether. Trimeres Acetonperoxid zerfällt beim Erwärmen mit verdünnten Säuren (H2SO4 10 %) unter Rückfluss quantitativ in Aceton und Wasserstoffperoxid.[1]
Es wird von Essigsäureanhydrid nicht verändert und reagiert nicht mit Kaliumiodid-Essigsäure. Von 1-molarer Natronlauge wird es auch bei Erwärmen nicht angegriffen. Zinkstaub und Natronlauge reduzieren dimeres Acetonperoxid langsam in der Kälte.
Acetonperoxid ist reizend (bei nur geringer akuter Toxizität), entzündlich und hochexplosiv. Besonders empfindlich ist es auf Zündung durch Flamme, Wärme, Schlag und Reibung. Eine Lagerung unter Wasser verringert die Empfindlichkeit und verhindert die Sublimation. Die Detonationsgeschwindigkeit beträgt 5290–5400 m·s−1 (Dichte 1,18–1,20 g·cm−3) (Trimer).[1] Die Sauerstoffbilanz ist −151,3 %.[2] Die Bleiblockausbauchung beträgt 250 ml/10 g für das Trimer.[2] Die Schlagempfindlichkeit beträgt 0,3 J (Trimer), die Reibempfindlichkeit 0,1 N Stiftbelastung (Trimer).[2]
Die Sprengkraft von Acetonperoxid liegt, je nach Testmethode, bei 80–100 % der Sprengkraft von Trinitrotoluol (TNT). Bei der Explosion von Acetonperoxid entstehen die für die Sprengwirkung verantwortlichen Gasmoleküle, ohne dass es zu einer extremen Hitzeentwicklung kommt, wie dies bei vielen anderen Sprengstoffen üblich ist.[14][15]
In einem Fallhammerversuch mit einem 1-kg-Fallhammer (üblich sind bei normalen Sprengstoffen Untersuchungen mit einem 2-kg-Fallhammer) detoniert es bei einem Schlag aus nur 3 cm Höhe.
Acetonperoxid lässt sich mit herkömmlichen, auf Nitroverbindungen empfindlichen Sprengstoffdetektoren nicht detektieren.
Analytik
Zur sicheren forensischen Identifizierung von TATP an Tatorten oder substanzexponierten Personen kommen nach adäquater Probenahme[16][17] die Kopplung der Gaschromatographie mit der UV-Spektroskopie[18] oder der Massenspektrometrie[19][20] zur Anwendung. Auch die Kopplung der HPLC mit der Massenspektrometrie eignet sich zur Bestimmung von TATP.[21] Ein kürzlich entwickeltes spezifisches elektrochemisches Verfahren erlaubt ebenfalls die Unterscheidung des TATP von Sprengstoffen wie PETN, RDX, HMX und TNT.[22]
Besondere Gefahren
Acetonperoxid ist, wie andere ähnlich gebaute Peroxide, äußerst explosiv. Acetonperoxid-Kristalle sind generell nicht stabil, jederzeit können, etwa durch Temperatur- und Lichtunterschiede, Kristallbrüche entstehen, die zu einer Spontanexplosion führen. Trimeres Acetonperoxid sublimiert schon bei 14–18 °C, daher bilden sich bei Raumtemperatur in einem geschlossenen Gefäß im Bereich des Gefäßverschlusses schnell kleine Kristalle aus, die durch die Reibung beim Öffnen des Gefäßes zerbrechen und eine Explosion des Gefäßinhaltes auslösen.
Bei erhöhten Lagertemperaturen zersetzt sich Acetonperoxid innerhalb weniger Stunden. Wird eine Temperatur von 130 °C erreicht, führt dies zur Explosion; es detoniert feucht noch bei einem Wassergehalt von 25 %. Bei direkter Berührung eines einzelnen kleinen Kristalls mit einer Flamme erfolgt dagegen eine relativ harmlose Verpuffung.
Als chemisches Experiment wurde an Schulen und Universitäten gelegentlich das Erhitzen feuchten trimeren Acetonperoxids im Milligramm-Bereich frei auf einer stabilen Eisenplatte bis zum Detonieren des Peroxids vorgeführt. Alternativ kann auf Hexamethylentriperoxiddiamin (HMTD) ausgewichen werden, das bei geringerer Schlagempfindlichkeit und fehlender Tendenz zur Sublimation den gleichen didaktischen Vorführungswert hinsichtlich der Detonation hat. Aufgrund der Handhabungsunsicherheit von Acetonperoxid und HMTD sowie der teils problematischen Vernichtung von Restmengen sind beide Stoffe für Lehrversuche jedoch generell einer kritischen Betrachtung zu unterziehen.
Rechtsstatus
Acetonperoxid ist nach dem SprengG als explosionsgefährlich eingestuft und wurde der Stoffgruppe A zugeordnet.[23] Es unterliegt dem Sprengstoffrecht (insbesondere der Erlaubnispflicht aus § 27 des Sprengstoffgesetzes), sofern keine Ausnahmen nach der 1. Verordnung zum Sprengstoffgesetz für Forschung und Lehre greifen.
Literatur
- Richard Escales: Initialexplosivstoffe. Survival Press, Radolfzell 2002, ISBN 3-8311-3939-3.
- Beilsteins Handbuch der organischen Chemie. Hrsg. v. Beilstein-Inst. für Literatur der Organischen Chemie. 31 Bände. 4. Auflage. Springer, Berlin 1918–31.
- Alfred Rieche, Kurt Koch: Die Oxydation des Diisopropyläthers. (XIV. Mitteil.) über Äthylperoxyde. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 75, 1942, S. 1016, doi:10.1002/cber.19420750815.
- R. Criegee, W. Schnorrenberg, J. Becke: Zur Konstitution von Ketonperoxyden. In: Justus Liebigs Annalen der Chemie. 565, 1949, S. 7, doi:10.1002/jlac.19495650103.
- Rudolf Criegee, Karl Metz: Über ein drittes, kristallisiertes Acetonperoxyd. In: Chemische Berichte. 89, 1956, S. 1714, doi:10.1002/cber.19560890720.
- Tadeusz Urbanski: Chemie und Technologie der Explosivstoffe. Band 3, Deutscher Verlag für Grundstoffindustrie, Leipzig 1964, S. 194 ff.
- M. Rohrlich, W. Sauermilch: Sprengtechnische Eigenschaften von Trizykloazetonperoxyd. In: Zeitschrift für das gesamte Schieß- und Sprengstoffwesen. 38, 1943, S. 97–99.
- J. Gartz: Vom griechischen Feuer zum Dynamit – eine Kulturgeschichte der Explosivstoffe. E. S. Mittler & Sohn, Hamburg 2007, ISBN 978-3-8132-0867-2.
Weblinks
Einzelnachweise
- Eintrag zu Acetonperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, 2008, ISBN 978-3-527-32009-7.
- H. Félix-Rivera, M. L. Ramírez-Cedeño, R. A. Sánchez-Cuprill, S. P. Hernández-Rivera: Triacetone triperoxide thermogravimetric study of vapor pressure and enthalpy of sublimation in 303–338 K temperature range. In: Thermochim. Acta. 514, 2011, S. 37–43, doi:10.1016/j.tca.2010.11.034.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Anis Amri: Der Lkw war nur Plan B., In: Zeit-Online. 13. Dezember, abgerufen am 21. Dezember 2018.
- Richard Wolffenstein: Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd. In: Berichte der deutschen chemischen Gesellschaft. 28, 1895, S. 2265, doi:10.1002/cber.189502802208. (Digitalisat)
- Adolf Baeyer, Victor Villiger: Einwirkung des Caro'schen Reagens auf Ketone. In: Berichte der deutschen chemischen Gesellschaft. 32, 1899, S. 3625, doi:10.1002/cber.189903203151. (Digitalisat)
- Adolf Baeyer, Victor Villiger: Ueber die Nomenclatur der Superoxyde und die Superoxyde der Aldehyde. In: Berichte der deutschen chemischen Gesellschaft. 33, 1900, S. 2479, doi:10.1002/cber.190003302185. (Digitalisat)
- Patent DE423176: Verfahren zur Herstellung von Initialzündmitteln. Angemeldet am 8. März 1925, veröffentlicht am 21. Dezember 1925, Anmelder: Dr. R. Nahnsen & Co. AG, Gottfried Pyl.
- M. Rohrlich, W. Sauermilch: Sprengtechnische Eigenschaften von Trizykloazetonperoxyd. In: Zeitschrift für das gesamte Schieß- und Sprengstoffwesen. 38, 1943, S. 97–99.
- A. E. Thiemann: Über Kraftstoffzusätze in Dieselölen. In: ATZ Automobiltechnische Zeitschrift. Band 45(16), 1942, S. 454–457.
- Robert W. Murray, Ramasubbu Jeyaraman: Dioxiranes: synthesis and reactions of methyldioxiranes. In: The Journal of Organic Chemistry. 50, 1985, S. 2847–2853, doi:10.1021/jo00216a007.
- Heng Jiang, Gang Chu, Hong Gong, Qingdong Qiao: Tin Chloride Catalysed Oxidation of Acetone with Hydrogen Peroxide to Tetrameric Acetone Peroxide. In J. Chem. Res. (S), 1999, S. 288–289, doi:10.1039/a809955c.
- Faina Dubnikova, Ronnie Kosloff, Joseph Almog, Yehuda Zeiri, Roland Boese, Harel Itzhaky, Aaron Alt, Ehud Keinan: Decomposition of Triacetone Triperoxide Is an Entropic Explosion. In: J. Am. Chem. Soc. 127 (4), 2005, S. 1146–1159. doi:10.1021/ja0464903.
- Peter Podjavorsek: Detektionsverfahren für Plastiksprengstoff. In: Deutschlandfunk. Abgerufen am 28. Juli 2016.
- F. S. Romolo, L. Cassioli, S. Grossi, G. Cinelli, M. V. Russo: Surface-sampling and analysis of TATP by swabbing and gas chromatography/mass spectrometry. In: Forensic Sci Int. 224(1-3), 10. Jan 2013, S. 96–100. PMID 23219697
- J. C. Oxley, J. L. Smith, L. J. Kirschenbaum, S. Marimiganti, I. Efremenko, R. Zach, Y. Zeiri: Accumulation of explosives in hair--Part 3: Binding site study. In: J Forensic Sci. 57(3), Mai 2012, S. 623–635. PMID 22235760
- J. Andrasko, L. Lagesson-Andrasko, J. Dahlén, B. H. Jonsson: Analysis of Explosives by GC-UV. In: J Forensic Sci. 62(4), Jul 2017, S. 1022–1027. PMID 28070907
- A. Stambouli, A. El Bouri, T. Bouayoun, M. A. Bellimam: Headspace-GC/MS detection of TATP traces in post-explosion debris. In: Forensic Sci Int. 146 Suppl, 2. Dez 2004, S. S191–S194. PMID 15639574
- D. Muller, A. Levy, R. Shelef, S. Abramovich-Bar, D. Sonenfeld, T. Tamiri: Improved method for the detection of TATP after explosion. In: J Forensic Sci. 49(5), Sep 2004, S. 935–938. PMID 15461093
- L. Widmer, S. Watson, K. Schlatter, A. Crowson: Development of an LC/MS method for the trace analysis of triacetone triperoxide (TATP). In: Analyst. 127(12), Dez 2002, S. 1627–1632. PMID 12537371
- S. K. Mamo, J. Gonzalez-Rodriguez: Development of a molecularly imprinted polymer-based sensor for the electrochemical determination of triacetone triperoxide (TATP). In: Sensors. (Basel). 14(12), 5. Dez 2014, S. 23269–23282. PMID 25490589.
- Feststellungsbescheid Nr. 413 vom 26. Februar 2002 der Bundesanstalt für Materialforschung und -prüfung (PDF online; 53 kB).