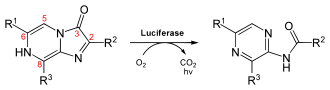
Luciferine
Luciferine (abgeleitet von lateinisch lucifer ‚Licht bringend‘)[1] sind unterschiedliche Naturstoffe, die in verschiedenen biolumineszenten Organismen zur Erzeugung von Licht genutzt werden. Durch katalytische Aktivität des entsprechenden Luciferase-Enzyms reagieren sie mit Sauerstoff (Oxidation). Bei der Veränderung, meistens der Abspaltung von Teilgruppen an dem Luciferin, wird Energie in Form von Licht abgegeben. Sowohl Luciferine als auch Luciferasen sind art- oder taxonspezifisch, also für jede Lebewesengruppe kennzeichnend.

Geschichte
Schon im 17. Jahrhundert beobachtete Robert Boyle, dass jedes biolumineszente System Sauerstoff benötigt.
Zu Beginn des 18. Jahrhunderts beobachtete René Réaumur, dass Pulver getrockneter und gemahlener biolumineszierender Organismen bei Zugabe von Wasser leuchten. Die ersten Berichte von experimentellen Arbeiten mit Luciferin-Luciferase-Systemen gehen auf den Franzosen Raphael Dubois zurück. Er entdeckte 1885 bei Arbeiten an Leuchtkäfern, dass ein Stoff in einer lichtgebenden Reaktion verbraucht wird. Dabei extrahierte er aus verschiedenen Organismen, die biologisches Licht erzeugen, Stoffe, die Ursache für das Leuchten sind und durch Hitze nicht zerstört werden, und er bezeichnete sie als Luciferin. Eine weitere für das Leuchten erforderliche Komponente, die hitzelabil ist, bezeichnete er als Luciferase. Heutzutage weiß man, dass eine taxon-spezifische Luciferase das Enzym ist, das das dazugehörende ebenfalls taxon-spezifische Luciferin umsetzt. Beim Mischen von Luciferin mit Luciferase in Gegenwart von Sauerstoff konnte Dubois die natürliche Biolumineszenz imitieren.[2]
Die nächsten Untersuchungen wurden von Edmund Newton Harvey Anfang des 20. Jahrhunderts durchgeführt.[3] Er fand heraus, dass es in jedem Luciferin-Luciferase-System eine Spezifität gibt. So können Luciferine der einen Spezies nicht durch die Luciferase einer anderen Spezies umgesetzt werden. Große Fortschritte in der Strukturaufklärung wurden ab den 1950er Jahren durch den Nobelpreisträger Osamu Shimomura erzielt.
Eigenschaften
Biolumineszente Systeme sind nicht evolutionär konserviert, die Luciferasen teilen keine Sequenzhomologie. Luciferasen treten aber in 17 unterschiedlichen Stämmen und mindestens 700 meist marinen Gattungen auf.[4] Offenbar wurden sie oft „erfunden“, phylogenetische Studien wiesen darauf hin, dass Luciferin-Luciferase-Systeme mehr als 30 unabhängige Ursprünge besitzen.[5] Die Spannweite der emittierten Farbe befindet sich zwischen blauem und rotem Licht (400 bis 700 nm), wobei Blautöne am häufigsten vorkommen, während rote Farben selten beobachtet werden.[6] Dies erklärt sich damit, dass die meisten biolumineszenten Organismen im Meer vorkommen und blaues Licht das Wasser am weitesten durchdringt.
Definition
Laut klassischer Definition ist das an der Luciferase gebundene Luciferin der Lichtemitter. Die Luciferase setzt unter Verbrauch von Sauerstoff das Luciferin hierbei um, manchmal werden dafür auch Cofaktoren wie ATP oder Ionen benötigt. Das oxidierte Luciferin befindet sich zunächst in einem Übergangszustand I und gelangt dann – häufig nach Decarboxylierung und weiteren Zwischenschritten – in einen elektronisch angeregten Zustand P*. Dieser fällt nach recht kurzer Zeit (wenige Nanosekunden) zurück in seinen Grundzustand P und emittiert währenddessen ein Lichtquant. Normalerweise sind die umgesetzten Luciferine auch Fluorophore, da sie durch Bestrahlen von Licht in einen angeregten Zustand gelangen können.
Prinzipien
Um in den angeregten Zustand P* zu gelangen, ist biochemisch gesehen viel Energie nötig. Die Emission von Photonen mit einer Wellenlänge von 500 nm (grün, Energie etwa 2 eV/Photon) benötigt etwa 250 kJ/mol – zum Vergleich: die Hydrolyse von ATP zu ADP und Phosphat setzt etwa 30 kJ/mol frei. Außerdem kann die Energie nur in einem Schritt freigesetzt werden. Die Energie wird vom molekularen Sauerstoff geliefert, wenn seine relativ schwache Doppelbindung gebrochen und eine stärkere Bindung (z. B. in CO2, 300 kJ/mol stabiler) gebildet wird.[7]
Das häufigste Prinzip ist die Bildung eines Vierrings, eines Dioxetan bzw. Dioxetanon (α-Peroxylacton). Nach erfolgter Decarboxylierung bildet sich der elektronisch angeregte Zustand.
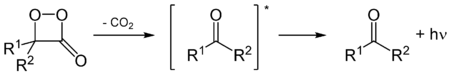
Manchmal entspricht die Fluoreszenz nicht der erwarteten, zum Beispiel bei Studien in vitro (im Reagenzglas). Dafür gibt es verschiedene Ursachen. So emittieren an Enzyme gebundene Luciferine bei Oxidation anders als freie Luciferine nach Anregung durch Licht. Manchmal wird die Energie an einen zweiten Fluorophor übertragen, so wie es beispielsweise bei Aequorin zu GFP in Aequorea victoria geschieht.
Quantenausbeute
Ob die Umsetzung eines Luciferins durch die korrespondierende Luciferase effizient ist, wird durch die Quantenausbeute bestimmt. Die Quantenausbeute ist die Anzahl der emittierten Lichtquanten je umgesetztem Molekül Luciferin.[8] Eine Quantenausbeute von 1 würde bedeuten, dass bei jedem umgesetzten Molekül Luciferin ein Lichtquant frei wird. Die bislang höchste Quantenausbeute Q wurde für das Leuchtkäferluciferin aus Photinus pyralis mit Q = 0,41 nachgewiesen.
Luciferin-Typen
Luciferin-Luciferase-Systeme kommen in zahlreichen Arten vor. Es gibt vier Hauptklassen an Luciferin-Luciferase-Systeme, bei denen das Luciferin nach Umsetzung durch eine Luciferase in einen elektronisch angeregten Zustand überführt und damit der eigentliche Lichtemitter wird.
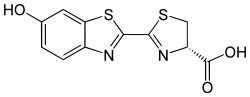
Das Firefly-Luciferin, ein Benzothiazolen


Biolumineszente Insekten sind in den vier Ordnungen Collembola, Hemiptera, Coleoptera sowie Diptera vertreten. Jedoch wurden nur die Biolumineszenzsysteme aus Organismen der beiden letztgenannten Ordnungen untersucht. Bei Coleoptera (Käfer) können Vertreter aus drei Familien Licht erzeugen: Phengodidae (Federleuchtkäfer), Elateridae (Schnellkäfer) sowie Lampyridae (Leuchtkäfer).[9]
Der amerikanische Leuchtkäfer Photinus pyralis (englisch firefly) gehört zur Familie der Lampyridae. Er wurde bereits von Dubois zu seinen Studien über Luciferine-Luciferasen (vgl. oben) herangezogen. Wissenschaftliche erste Untersuchungen der Biolumineszenzreaktion bei P. pyralis wurden 1917 durch Harvey eingeleitet. Inzwischen ist dieses Luciferin-Luciferase-System das am besten untersuchte und wird im Folgenden vorgestellt.
Biolumineszenzreaktion
Für die Reaktion setzt eine Luciferase das Substrat D-Luciferin (LH2), ein Benzothiazol, unter Verbrauch von Sauerstoff (O2) um. Die Arbeiten von William D. McElroy Ende der 1940er Jahre haben gezeigt, dass für die Reaktion ATP und Magnesiumionen als Cofaktoren benötigt werden:[9]
Das ATP wird dabei zu AMP und Pyrophosphat (PPi) umgesetzt und ein Lichtquant (hν) abgegeben.
Im Vergleich zu Luciferinen anderer Systeme (siehe unten) ist das Luciferin aus Leuchtkäfern eine relativ stabile Verbindung. Der Schmelzpunkt liegt bei 205–210 °C. Sein molarer Extinktionskoeffizient bei 328 nm beträgt ε = 18.200 M−1·cm−1. Dieses Luciferin fluoresziert und zeigt ein Emissionsmaximum bei λmax = 537 nm.
Die Luciferase (EC 1.13.12.7) der Leuchtkäfer hat eine Molekularmasse von ca. 60–62 kDa, bei P. pyralis genau 61 kDa, und ist aus 550 Aminosäuren aufgebaut. Sie katalysiert die oxidative Decarboxylierung von Luciferin zu Oxyluciferin (oxy-L, vgl. auch untenstehende Abbildung, Kasten). Die Reaktion läuft in den Peroxisomen der Lichtorganzellen ab.[11] Die Struktur der Luciferase aus P. pyralis wurde erstmals 1956 mit einer Auflösung von 200 pm dargestellt. Für diese Analyse wurden große Mengen an Leuchtkäfern durch hilfsbereite Kinder gesammelt, die für jedes abgelieferte Exemplar einen Cent Belohnung erhalten hatten.
Ohne gebundenes Substrat liegt die Luciferase in einer offenen Konformation vor; ein großer N-terminaler und ein kleiner C-terminaler Bereich bilden eine tiefe Furche. Bei Substratbindung führt eine Konformationsänderung zum Schließen der Furche.[12] Mitte der 1980er Jahre konnte Luciferase erfolgreich in das Genom des Bakteriums E. coli eingebaut und dort exprimiert werden. Luciferasen aus Leuchtkäfern der Familie Lampyridae sind sehr ähnlich aufgebaut. Die Unterschiede bestimmen aber die Farbe des emittierten Lichts.[13][14] Je nach Art liegt das Emissionsmaximum λmax des freigesetzten Lichts zwischen 530 nm (grün) und 635 nm (rot).
Die Reaktion läuft in vitro am besten bei einem pH-Wert von 7,8 und bei Temperatur von 23–25 °C ab. In vivo ist die Farbe des emittierten Lichts gelbgrün bis gelb (552–582 nm). Im Labor zeigt die Reaktion einen größeren Farbbereich. Im sauren Milieu erscheint das Licht rötlich (615 nm), im neutralen Milieu grün-gelb.
Reaktionsmechanismus
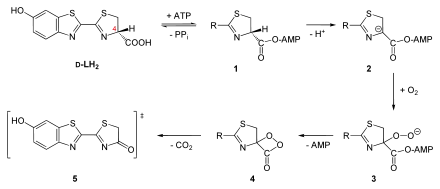
Der genaue Mechanismus der Reaktion ist bekannt. Durch ATP wird das D-Luciferin zunächst an der Carboxygruppe adenyliert, wobei Pyrophosphat als Abgangsgruppe freigesetzt wird (1, vgl. Abbildung). Durch diese Aktivierung kann das Proton am C4-Atom abstrahiert werden, es bildet sich ein Carbanion (2). Anschließend kann das Luciferin am C4-Atom oxygeniert werden, es bildet sich ein lineares Hydroperoxid (3). Dieses bildet unter Abspaltung von AMP ein Dioxetanonring (4). Nach Decarboxylierung bildet sich daraus Oxyluciferin, was entweder als Monoanion (Ketoform, 5) oder Dianion (Enolform) vorliegen kann. In beiden Fällen ist das Oxyluciferin in einem energetisch angeregten Zustand. Es fällt unter Abgabe eines Photons (rotes Licht oder gelb-grünes Licht) in seinen Grundzustand zurück. Das Oxyluciferin selbst wurde noch nicht in Reinform isoliert, da es extrem instabil ist.
Der Reaktionsmechanismus mit Bildung eines Dioxetanons wurde am Ende der 1970er Jahre zweifelsfrei durch die Arbeiten von Shimomura belegt.[15] Hierbei wurde isotopenmarkiertes 18O bei der Reaktion verwendet (H218O bzw. 18O2). Die Ergebnisse dieser Arbeit lösten die bis dahin postulierte Hypothese ab, dass Oxyluciferin durch lineare Bindungsspaltungen entstehe.[16][17] Falls diese wirklich erfolgte, würde der freiwerdende Kohlenstoffdioxid ein Sauerstoffatom enthalten, das aus Wasser stammt. Tatsächlich kommt es aber aus dem Sauerstoff.
Die Lichtausbeute dieser Reaktion ist hoch, da die Quantenausbeute Q bei einem pH von 8,5 bei 0,41 liegt.[18]
Synthese
Wie die Insekten – oder mikrobielle Symbionten – das Luciferin herstellen, ist nicht eindeutig geklärt. Man weiß, dass D-Luciferin nicht direkt vom Käfer aufgenommen wird (außer bei weiblichen Käfern der Gattung Photuris, die männliche Leuchtkäfer der Gattung Photinus fressen).[19]
In der Literatur werden zwei grundlegende Synthesewege diskutiert:
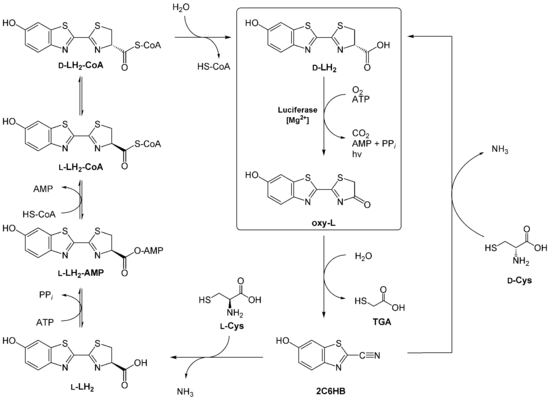
- Eine Möglichkeit besteht darin, das nach der Lichtreaktion entstandene Oxyluciferin zurück zu Luciferin zu recyclen. Schlüsselkomponente ist dabei, dass zunächst Oxyluciferin zu 2-Cyano-6-hydroxybenzothiazol (2C6HB) umgewandelt wird, was durch das Luciferin-regenerierende Enzym (LRE),[20] z. B. in Photinus pyralis, katalysiert wird. 2C6HB kondensiert dann mit einem D-Cystein zu D-Luciferin. Diese Kondensationsreaktion wird auch bei der chemischen Luciferinsynthese genutzt (vgl. Abbildung rechter Weg). Eine alternative Route über 2C6HB geht indes davon aus, dass dieses mit L-Cystein zunächst L-Luciferin bildet. Anschließend wird es dann über Zwischenschritte zu D-Luciferin racemisiert (vergleiche auch Abbildung linker Weg).[21]
- Beide Möglichkeiten dieser Biosynthesewege über 2C6HB weisen noch einige Probleme auf:
- So wird das Luciferin-regenerierende Enzym in den lichtproduzierenden Organen biolumineszenter Käfer nicht überproduziert. Da Oxyluciferin in wässrigen Lösungen instabil ist, müsste man gerade dort erwarten, LRE in größeren Mengen vorzufinden. Außerdem kann das reaktive 2C6HB nicht nur mit Cystein, sondern auch mit anderen Metaboliten reagieren. Es ist ferner nicht klar, woher beispielsweise das D-Cystein stammt und wie zwischen L-Cystein und D-Cystein diskriminiert werden könnte. Aus L-Cystein reagiert 2C6HB nämlich auch zu L-Luciferin. Dieses kann zwar die Luciferase als Substrat aufnehmen, hemmt aber die Lichtreaktion.[22] Außerdem konnte man noch nicht das Enzym verifizieren, das die Racemisierung katalysiert.
- Es ist darüber hinaus unklar, wie die Käfer (oder Symbionten) Benzothiazolene herstellen können.

- Bei dem in Japan einheimischen Leuchtkäfer Luciola lateralis wurde durch Markierungsexperimente gezeigt, dass der adulte Käfer Luciferin aus Hydrochinon bzw. 1,4-Benzochinon synthetisiert.[23] An 1,4-Benzochinon lagert sich zweimal L-Cystein an, so dass daraus die D- oder L-Form von Luciferin bildet. Die Racemerisierung der L- in die D-Form wird noch untersucht. Da 1,4-Benzochinon in hohen Konzentrationen toxisch wirkt, wird dieses erst kurz vor der Synthese freigesetzt. Hierfür schlagen die Wissenschaftler vor, dass das Glucosid Arbutin als Depotverbindung Hydrochinon zur Verfügung stellt, was dann zu 1,4-Benzochinon oxidiert wird.
Evolutionäre Ursprünge
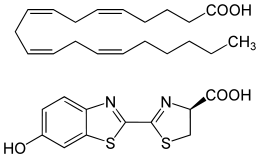
Möglicherweise hat sich die Luciferin-Luciferase-Reaktion bei Leuchtkäfern aus einer ganz anderen biologischen Funktion heraus entwickelt. Es wird vermutet, dass das Luciferinmolekül erst in einem späteren evolutionären Ergebnis aufgetreten ist und zu einer Lichtreaktion geführt hatte.[13] Dafür spricht, dass die Luciferase auch effizient Coenzym A an das Luciferinmolekül kondensieren kann und somit die Funktion einer klassischen Fettsäure-CoA-Ligase erfüllt.[24] Die Luciferase kann in diesem Zusammenhang auch Fettsäuren wie beispielsweise Arachidonsäure verwenden, die ähnliche strukturelle Eigenschaften mit dem Luciferin teilt.
Aufgrund dieser zusätzlichen katalytischen Eigenschaft könnte die ursprüngliche Luciferase eine Fettsäure-CoA-Ligase gewesen sein. Durch das Auftreten des Luciferins und der damit verbundenen Lichtreaktion ergab sich ein Selektionsvorteil: Die Adenylierungsreaktion hatte sich im Laufe der Zeit durchgesetzt. Diese These wurde am nicht lumineszierenden Mehlwurm Tenebrio molitor demonstriert. Dieser besitzt kein Luciferin, aber Fettsäure-CoA-Ligasen. Interessanterweise kann durch Zugabe von Luciferin auch dort eine Lichtreaktion beobachtet werden. Aber ohne Kenntnisse darüber, wie die Biosynthese des Leuchtkäferluciferins abläuft, ist eine genauere evolutionäre Analyse schwierig.
Sequenzvergleiche lassen darauf schließen, dass der gemeinsame Vorfahre aller Leuchtkäfer (Lampyridae) vor etwa 100 Millionen Jahren in der Mitte der Kreidezeit ebenfalls biolumineszent war und grünes Licht emittieren konnte.[25] Vor ca. 70 Millionen Jahren erfolgte eine Genduplikation des Luciferasegens, wodurch eine Luciferase des Types 1 und 2 entstanden. Im Laufe der Zeit folgte eine Aufgabenteilung: Während die Luc1-Typ-Luciferase für das Leuchten am Hinterleib der Glühwürmchen (in den Leuchtzellen, den sog. „Laternen“)[26] im Larven-, Puppen- und adultem Stadium zuständig ist, ermöglicht die Luc2-Typ-Luciferase eine Biolumineszenz in den Eiern und dem Körper der Puppe. Der damalige Zweck der Biolumineszenz des letzten gemeinsamen Vorfahrens war wahrscheinlich eine Form des Aposematismus, nach Genduplikation konnten manche Arten diesen für eine komplexe Sexualkommunikation erweitern (wie z. B. bei P. pyralis und Luciola parvula).[25] Dadurch verschob sich das Leuchten ins Gelbe.
Lumineszenz anderer Insekten

Auch bei lumineszierenden Insekten der beiden anderen Familien Phenogodidae und Elateroidae kommt das Leuchtkäfer-Luciferin vor.[9] So ist das Biolumineszenzsystem aus Federleuchtkäfern (z. B. Phrixothrix, englisch railroad worm) oder Schnellkäfern (z. B. die Feuerfliege Pyrophorus noctilucus) mit denen aus Leuchtkäfern nahezu identisch. Bei den Federleuchtkäfern zeigen aber nur die Larven Biolumineszenz, die adulten Tiere nicht.
Dagegen weisen lumineszierende Zweiflügler (Diptera) (Arachnocampa oder Orfelia) keine Gemeinsamkeiten mit dem Luciferin aus Leuchtkäfern auf. So gehört zwar die 59 kDa große Luciferase von Arachnocampa luminosa zur selben Proteinfamilie wie die der Leuchtkäfer an (31%ige Sequenzidentität), kann aber nicht das Leuchtkäfer-Luciferin umsetzen.[27] Diese Luciferase-Luciferin-System setzt in einer ATP-, Mg2+ und Sauerstoff-abhängigen Reaktion ein Chinolin-artiges Luciferin um. Das von den Larven der nordamerikanischen Pilzmücke (Orfelia fultoni) emittierte Licht ist im Übrigen das blaueste (λmax = 460 nm), das von Insekten generiert wird.[9] Diese leben beispielsweise in den Waitomo Caves.
Dehydroluciferin
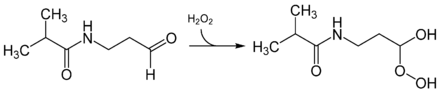
In vitro wurde gezeigt, dass enzymgebundenes, adenyliertes D-Luciferin (D-LH2·AMP) auch in einer Dunkelreaktion umgesetzt werden kann. Hierbei reagiert dieses durch Sauerstoff zu Wasserstoffperoxid und Dehydroluciferin (L·AMP). Letzteres kann aus der Luciferase mittels Pyrophosphat freigesetzt werden, dabei entsteht ATP.
L·AMP ist ein potenter Inhibitor der Luciferase. Ob die Bildung von Dehydroluciferin auch unter physiologischen Bedingungen stattfindet, ist unbekannt. Zumindest könnte das dabei entstehende Wasserstoffperoxid (H2O2) in den Peroxisomen schnell entgiftet werden.[28]
Tetrapyrrol, das Luciferin von Dinoflagellaten und Euphausiidae
- Biolumineszenz von Dinoflagellaten, durch das Brechen der Wellen hervorgerufen
 Strand in der Nähe von Manasquan (New Jersey, USA)
Strand in der Nähe von Manasquan (New Jersey, USA) Ähnliche Aufnahme (Manasquan)
Ähnliche Aufnahme (Manasquan) Aufnahme in der Nähe von Carlsbad (Kalifornien, USA)
Aufnahme in der Nähe von Carlsbad (Kalifornien, USA) Aufnahme am Strand von Seal Beach (Kalifornien, USA)
Aufnahme am Strand von Seal Beach (Kalifornien, USA)
Das Luciferin in dieser Gruppe entspricht dem chemischen Grundbau eines linearen, offenen Tetrapyrrols und findet sich unter anderem bei Dinoflagellaten (Noctiluca, Gonyaulax, Pyrocystis). Meeresleuchten, welches früher fälschlicherweise als Phosphoreszenz bezeichnet wurde, geht größtenteils auf diese einzelligen Algen zurück.[29] Die Untersuchungen des Luciferin-Luciferase Systems begannen Ende der 1950er Jahre an der Dinoflagellate Lingulodinium polyedra (synonym: Gonyaulax polyedra) durch die Arbeiten von J. Woodland Hastings und Mitarbeitern. Die Gattung Pyrocystis gilt mittlerweile als Modellorganismus bei der Erforschung der Biolumineszenz bei Dinoflagellaten.[30]
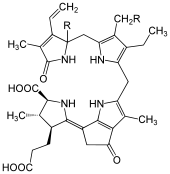
Für die Lichtemission sind neben dem Luciferin und einer korrespondieren, ca. 135 kDa großen Luciferase (LCF) häufig auch ein sogenanntes Luciferin-Bindeprotein (englisch luciferin-binding protein, LBP) notwendig.[31][32] LBD ist ein Homodimer, eine Untereinheit ist 72 kDa groß. Das Luciferin dieser Familie ist extrem instabil bei niedrigen pH-Werten (< pH 4), hohen Salz- und bereits niedrigen Sauerstoffkonzentrationen. Es konnte gezeigt werden, dass das LBD bei pH 8,0 an das Dinoflagellaten-Luciferin bindet, nicht aber bei pH 6,3.[33] Dadurch soll das Substrat bis zur Reaktion geschützt werden, die bei L. polyedra am besten bei pH 6,3 abläuft, zumal die Luciferase im leicht alkalischen Milieu (pH 8,0) inaktiv ist.[34] Für die Umsetzung des Luciferins mit Sauerstoff wurde vorgeschlagen, dass diese über mehrere Zwischenstufen über Radikale abläuft.[29] Die Reaktion selbst findet dabei in speziellen Organellen statt, die sogenannten Scintillone.[35][30] Diese sind im Durchschnitt 0,4 µM groß und enthalten hauptsächlich Luciferasen, Luciferine und (je nach Spezies) LBPs.[14][30] Die Scintillone werden während der Nacht an die Peripherie der Zelle transferiert. Das Licht, das bei dieser Reaktion entsteht, erscheint blau-grünlich (Anregungsmaximum bei λmax = 390 nm, Emissionsmaximum von bei ca. λmax = 480 nm[30]). Als Lichtemitter dient ein enzymgebundenes Intermediat des zu umsetzenden Luciferins.[14] Voll aktiviert kann P. lunula während der Nachtperiode etwa 4 Milliarden Photonen emittieren.[30]
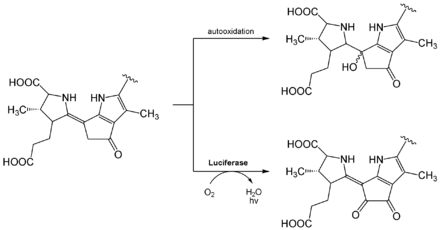

Es ist heute noch nicht geklärt, ob sich das Luciferin wegen seiner Verwandtschaft zu Chlorophyll a aus diesem ableitet (photooxidatives Abbauprodukt)[30] oder erst aus mehreren Aminosäuren (Glycinen und Glutaminsäuren) schrittweise aufgebaut werden muss.[37] Gegen ersteres spricht der Umstand, dass beispielsweise in L. polyedra nur während der Nacht das Luciferin verfügbar ist, so dass ein oxidativer Abbau mittels Sonnenlicht nicht möglich wäre.[30] Außerdem ist es paradox, dass das bei der Lichtreaktion entstehende oxy-Luciferin kein Fluorophor ist.[36]
Komponente F bei Krill
Ein Luciferin mit nahezu identischer Struktur wurde auch bei lumineszierenden Euphausiidae (Krill) gefunden, z. B. bei Meganyctiphanes norvegica oder Euphausia pacifica. Dort wird es als Komponente F bezeichnet, welches über die Nahrung aufgenommen wird.[38] Der Reaktionsmechanismus entspricht dem der Dinoflagellaten.
Flavin, ein bakterielles Luciferin
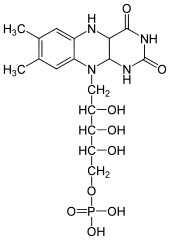
Lumineszierende Bakterien nutzen reduziertes Flavinmononukleotid (FMNH2, was auch als Riboflavin-5-phosphat bezeichnet wird) für eine lichtgebende Reaktion. Sie kommen entweder – seltener – terrestrisch vor (Vibrio, Xenorhabdus, Photorhabdus)[39][6] oder frei lebend im Meer (Beneckea, Vibrio) bzw. symbiotisch oder parasitär in oder auf anderen Tieren.[6] Sie sind für die Biolumineszenz vieler leuchtender Tiefseefische verantwortlich, dort werden sie als Symbionten in speziellen Leuchtorganen (Photobacterium) gehalten. Schließlich findet man biolumineszente Bakterien auch im Nährstoffkreislauf wieder: In den mittleren Tiefen des Ozeans haften sie an Kot, der Fische durch die Biolumineszenz jener Bakterien anlockt.[6] Nach Aufnahme finden sie im Fischdarm bessere Überlebensbedingungen. Die bisher identifizierten biolumineszierenden Bakterien sind alle Gram-negativ, stabförmig, beweglich und fakultativ anaerob.[6] Ein bekanntes Bakterium mit Biolumineszenzeigenschaft ist beispielsweise Aliivibrio fischeri. Biolumineszente Bakterien wurden in den Familien Vibrionaceae, Shewanellaceae and Enterobacteriaceae identifiziert, und dort unter den Gattungen Vibrio, Photobacterium, Aliivibrio, Photorhabdus and Shewanella.[6]
Die Untersuchung der bakteriellen Biolumineszenz führte in den 1950er Jahren zu besonderen Fortschritten. Die Forscher Milton J. Cormier und Bernard L. Strehler fanden heraus, für die Biolumineszenzreaktion vier Faktoren notwendig sind: Neben dem FMNH2 wird eine Luciferase, molekularer Sauerstoff und ein langkettiger Aldehyd eines gesättigten Kohlenwasserstoffes benötigt. Der Aldehyd, Hexadecanal, wurde vor seiner chemischen Identifizierung als „kidney cortex factor“ bezeichnet, da der Aldehyd aus der Nebennierenrinde von Schweinen isoliert wurde. Für die Lichtreaktion können auch andere Aldehyde verwendet werden, beispielsweise Decanal oder Dodecanal. Folgende Tabelle gibt die Zusammensetzung aus 40 g isolierter Bakterien wieder. Es wird angenommen, dass hauptsächlich Tetradecanal umgesetzt wird.
| Aldehyd | P. phosphoreum | A. fischeri |
|---|---|---|
| 10C-Atome (Decanal) | < 1 nmol | < 1 nmol |
| 11C-Atome | < 1 nmol | < 1 nmol |
| 12C-Atome (Dodecanal) | 30 nmol | 32 nmol |
| 13C-Atome | 6 nmol | 2 nmol |
| 14C-Atome (Tetradecanal) | 380 nmol | 29 nmol |
| 15C-Atome | 6 nmol | 6 nmol |
| 16C-Atome (Hexadecanal) | 180 nmol | 18 nmol |
| 17C-Atome | < 1 nmol | 2 nmol |
| 18C-Atome | < 1 nmol | < 1 nmol |
FMNH2 und der Aldehyd werden sauerstoffabhängig zu FMN und einer Carbonsäure umgesetzt, gemäß (vgl. auch Abbildung):
Diese Reaktion katalysiert eine bakterielle Luciferase, eine Flavin-abhängige Monooxygenase. Da diese gleichzeitig den Aldehyd zur Carbonsäure oxidiert, handelt es sich um eine Oxidase mit gemischter Funktion. In allen lumineszierenden Bakterien ist die Luciferase ein Heterodimer mit 76±4 kDa Größe. Sie setzt sich aus einer α- und β-Protein-Untereinheit (40–42 kDa bzw. 37–39 kDa) zusammen, die getrennt kaum Aktivität zeigen.[40] Das katalytische Zentrum befindet sich wahrscheinlich in der α-Untereinheit. Die β-Untereinheit ist vermutlich für die Stabilität, Struktur und Quantenausbeute nötig.[6] Die Luciferase ist bei pH-Werten zwischen 6,0–8,5 (Photobacterium phosphorerum, A. fischeri) bzw. 6,0–9,5 (Benecka harveyi) aktiv, jedoch nicht bei Temperaturen über 30–35 °C.[39] Eine Kristallstruktur der Luciferase aus Vibrio harveyi wurde mit einer Auflösung von 150 pm gelöst.[41]

FMNH2 in freier Lösung ist instabil und oxidiert leicht. Enzymgebunden jedoch erhöht sich dessen Stabilität und wird durch Sauerstoff an Position C4a nukleophil angegriffen. Dabei entsteht ein 4a-Hydroperoxid, welches ungewöhnlich stabil vorliegt.[39] Dieses reagiert mit dem Aldehyd zu einem Peroxyhemiacetal, was schließlich zur Fettsäure und einem 4a-Hydroxyflavin zerfällt. Letzteres ist in einem angeregten Zustand und fällt unter Lichtabgabe in den Grundzustand zurück. Damit ist das 4a-Hydroxyflavin der eigentliche Lichtemitter. Im Grundzustand wird dieses zu FMN hydrolysiert.

Bei der durch die Luciferase katalysierten Reaktion wird blau-grünes Licht emittiert, das in vitro ein Emissionsmaximum bei ca. λmax = 490 nm hat. In vivo wurden indes Wellenlängenmaxima von 472 nm bis 545 nm beobachtet. Der Grund dafür ist die Übertragung der Anregungsenergie auf fluoreszierende Proteine via FRET.[39] Es wurde zwei Klassen an fluoreszierenden Proteinen identifiziert: blaufluoreszierende Lumazinproteine (LumPs) mit Lumazin als Chromophor (P. phosphoreum, A. fischeri). Alternativ bilden die gelbfluoreszierenden Proteine (YFPs) die zweite Klasse, die als Chromophor FMN oder Riboflavin aufweisen (A. fischeri Stamm Y-1). Mit den LumPs verschiebt sich das Emissionsmaximum von 490 nm nach 476 nm, bei YFPs von 484 nm nach 534 nm. Für eine Energieübertragung gemäß FRET muss der Luciferin-Luciferase-Komplex an den jeweiligen fluoreszierenden Proteinen gebunden sein. Die Quantenausbeute liegt bei 0,10–0,16.[39]
Das FMNH2 für die Biolumineszenzreaktion wird durch eine Riboflavinkinase unter ATP-Verbrauch aus Riboflavin (Vitamin B2) gewonnen. Nach der Reaktion wird FMNH2 aber aus FMN regeneriert, was eine Flavinreduktase[42] unter NAD(P)H-Verbrauch katalysiert. Da die Menge vorkommender Aldehyde in der Bakterienzelle (vgl. Tabelle oben) nur für eine sehr kurze Biolumineszenz reicht, werden die Aldehyde ständig regeneriert.[39] Hierbei wird das langkettige Aldehyd aus der bei der Reaktion entstandenen Fettsäure zurückgewonnen, was im sogenannten Fettsäure-Reduktase-Komplex[43] unter Verbrauch von ATP und NAD(P)H katalysiert wird.
Die Biolumineszenzreaktion verbraucht viel Energie, da für die Regenerierung der Komponenten bereits zwei Moleküle NAD(P)H und ein Molekül ATP benötigt werden. Infolgedessen muss diese Lichtreaktion entsprechend kontrolliert werden.[40] Zudem haben Flavinreduktasen eine höhere Wechselzahl als die Luciferase. Bei einer unkontrollierten Aktivität wird zu viel FMNH2 produziert. Durch dessen schnelle Oxidation (vgl. oben) würde somit viel NAD(P)H verschwendet werden. Dies betont die Notwendigkeit einer Regulation.
Lux-Gene
Alle Proteine, die etwas mit der Biolumineszenzreaktion zu tun haben, werden durch sogenannte lux-Gene kodiert (lat. lux Licht). Die Untereinheiten der Luciferase werden von den luxA bzw. luxB-Genen kodiert, wobei das luxB-Gen wahrscheinlich durch Genduplikation aus dem luxA-Gen entstanden ist (30%ige Sequenzidentität).[6] LuxA und LuxB wurden bereits erfolgreich als Marker kloniert. LuxC,D und E kodieren für den Fettsäurereduktasekomplex, hierbei luxC für eine NADPH-abhängige Acylproteinreduktase (etwa 54 kDa), luxD für eine Acyltransferase (etwa 33 kDa) und luxE für eine Acylproteinsynthetase (etwa 42 kDa).[6]
Die lux-Gene befinden sich auf einem Operon, das durch einen einzigen Promotor reguliert wird.[6] Hierbei ist die Anordnung der Gene (luxCDABE) unter den biolumineszenten Bakterien konserviert. Darüber hinaus haben manche biolumineszente Bakterien noch ein weiteres Gen auf dem lux-Operon, luxG, das für eine Flavinreduktase kodiert. Weitere Gene wurden innerhalb des lux-Operons oder in einem benachbarten Operon (luxR) identifiziert, wie z. B. luxF, ribEBHA oder luxI.[6]
Für In-vitro-Experimente nutzt man die lux-Gene aus A. fischerii.[44]
Coelenterazin, die gemeinsame chemische Komponente vieler biolumineszenter Meeresorganismen
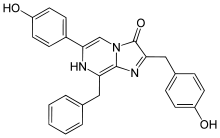
Durch die Arbeiten von Milton J. Cormier an der Seefedernart Renilla reniformis und von Frank H. Johnson an der Qualle A. victoria wurde das Luciferin Coelenterazin entdeckt. Dieses ist unter biolumineszenten Meeresorganismen sehr weit verbreitet, beispielsweise bei Vertretern der Nesseltiere (Cnidaria) Rippenquallen (Ctenophora), Weichtiere (Molusca), Gliederfüßer (Arthropoda) und Chordatiere (Chordata).[45][46][47] Coelenteratzine wurde aber nicht in terrestrischen Lebewesen oder Ringelwürmern (Annelida) entdeckt. Manchmal kommen sie auch in geringen Mengen in nicht-biolumineszenten Organismen vor, wie beispielsweise im Feuerschwamm Microcina prolifera. Dieser enthält auch keine Luciferase.
Coelenterazin weist eine Aminopyrazingrundstruktur auf und liegt als lichtgebende Komponente als bona fide Luciferin vor. Häufig ist es auch als Chromophor gebunden in Photoproteinen wie z. B. Aequorin, Obelin oder Symplectin. Auch Derivate von Coelenterazin werden von zahlreichen marinen Lebewesen genutzt.
Unmodifiziert ist Coelenterazin kaum in neutral-wässrigen Lösungen stabil, dort oxidiert es leicht durch Luftsauerstoff. In Methanol liegt es stabiler vor. Dort fluoresziert es gelblich (ε = 9800 M−1·cm−1, λmax = 435 nm). Allgemein reagieren Coelenterazine mit Sauerstoff zu Coelenteramiden. Hierbei tritt eine Decarboxylierung ein, es bildet sich das Anion eines Coelenteramides. Dieses ist auch der Lichtemitter, so dass allgemein blaues Licht emittiert wird. Diese Reaktion kann biokatalysiert werden (Biolumineszenz), findet aber auch spontan statt (Chemolumineszenz). Die biolumineszente Reaktion wird im folgenden Absatz erläutert.
Mechanismus
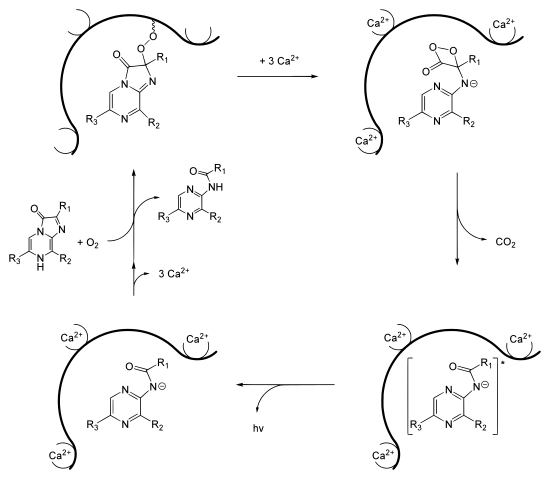
1962 wurde das Photoprotein Aequorin aus Aequorea victoria isoliert und dabei 1974 Coelenterazin als das Luciferin identifiziert.[48][49] Wie nun die biochemischen Mechanismen für das Luciferin-Luciferase-System mit Imidazolpryazinen ablaufen, wurde 2000 anhand von A. victoria gezeigt.[50] Hierbei spielt das Aequorin eine wesentliche Rolle. Aequorin ist ein kleines Photoprotein und befindet sich am Rand des Schirmes in der Qualle. Bei Aequorin ist das Luciferin (Coelenterazin) bereits durch eine Peroxidbrücke mit dem Proteinteil verbunden. Infolgedessen führt das Photoprotein bereits das oxidierende Agens O2 mit sich. In enzymgebundener Form kann Coelenterazin so auch längere Zeit aufbewahrt werden. Aequorin besitzt drei Bindestellen für Calciumionen. Wenn Calciumionen daran binden, ändert sich die Konformation des Proteins derart, dass eine intramolekulare Reaktion mit dem Coelenterazin ausgelöst wird. Dieses reagiert zunächst zu einem instabilen Dioxetanonring, so dass nach Abspaltung von CO2 schließlich das Anion von Coelenteramid entsteht. Nach Relaxation in den Grundzustand wird ein Lichtquant mit einer Wellenlänge von λmax = 465 nm emittiert. Wegen dieses blauen Leuchtens wird das Protein auch als das blaufluoreszierende Protein (blue fluorescent protein) (BFP)[51] bezeichnet. Das Photoprotein wird in Anwesenheit von Coelenterazin und molekularem Sauerstoff schließlich regeneriert.
Aequorea victoria fluoresziert aber nicht blau, sondern grün. Das liegt daran, dass das blau fluoreszierende Protein die Energie der Biolumineszenzreaktion strahlungslos auf das sogenannte grün fluoreszierende Protein (GFP) überträgt.
Watasenia-Luciferin
Der biolumineszente Tiefseetintenfisch Watasenia scintillans wurde erstmals 1905 beschrieben (damals noch als Abraliopsis scintillans).[52] Er besitzt zahlreiche Photophore am gesamten Körper, die bläulich wie ein Sternenhimmel leuchten. Für die Biolumineszenzreaktion ist ein modifiziertes Coelenterazin nötig. Dieses ist ein Disulfat von Coelenterazin und wurde 1976 aus der Leber des Tintenfisches isoliert.[53] Es wird als Watasenia-Luciferin bezeichnet. In neutral wässrigen Lösungen ist es instabil und neigt zur Autooxidation (Chemolumineszenz), was insbesondere durch Anwesenheit durch Wasserstoffperoxid und Eisen(II)-ionen induziert wird. In wässrigen Lösungen ist das Luciferin stark fluoreszierend (λmax = 400 nm).[54]
Das Watasenia-Luciferin wird durch eine noch nicht isolierte, membrangebundene Luciferase umgesetzt, in dessen Folge blaues Licht emittiert wird (λmax = 470 nm). Die Reaktion hat ein pH-Optimum bei 8,8 sowie ein Temperaturoptimum von 5 °C und benötigt neben molekularem Sauerstoff ATP und Mg2+.[55] Die Quantenausbeute liegt bei 0,36. Für den Reaktionsmechanismus wurde vorgeschlagen, dass das Luciferin mittels ATP adenyliert wird, damit dieses an die Luciferase binden kann. Der weitere Reaktionsverlauf beinhaltet die Bildung eines Dioxetanonringes und schließlich die des Coelenteramidanions, so wie oben allgemein dargestellt.[54] Es entsteht dabei Licht zwischen 400 und 580 nm (λmax = 470 nm).[56]
Vargula-Luciferin
Die Muschelkrebse der Art Vargula hilgendorfii (auch bis 1962[57] als Cypridina hilgendorfii bezeichnet) scheiden eine lumineszierende Flüssigkeit ins Meerwasser aus, falls diese sich bedroht fühlen. Biochemische Untersuchungen über das bei in diesen Muschelkrebsen enthaltene Luciferase-Luciferin-System wurden Anfang des 20. Jahrhunderts von Harvey eingeleitet. Inzwischen ist es genau untersucht.
Das Luciferin, Vargulin, wurde 1957 isoliert und 1966 als Imidazolpryazinkomponente identifiziert. Es ist in Wasser, Methanol und alkoholischen Lösungsmitteln löslich. Vargulin hat in neutralen Lösungen eine gelbe Farbe und zeigt in Methanol ein Absorptionsmaximum bei λmax = 432 nm mit einem molaren Extinktionskoeffizienten von ε = 9000 M−1·cm−1. In wässrigen Lösungen ist es zudem leicht fluoreszierend (Anregungsmaximum bei λmax = 540 nm). Vargulin ist sehr instabil und wird besonders durch Luftsauerstoff, aber auch Blei(IV)-oxid, oxidiert. Dabei kann auch Licht ausgesendet werden, so dass hier – besonders in organischen Lösungsmitteln wie Diglym – eine Chemolumineszenzreaktion vorliegt.
In den Muschelkrebsen wird Vargulin durch eine Luciferase zum Coelenteramid, dem Oxyluciferin, umgesetzt, wobei blaues Licht freigesetzt wird (λmax = 463 nm). Die Luciferase ist 60–70 kDa großes Monomer mit 555 Aminosäuren. Es weist viele Cysteine auf und ist ein saures Protein (isoelektrischer Punkt von 4,35).
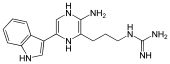
Bei der Biolumineszenzreaktion wird Vargulin an die Luciferase gebunden und am C2-Atom oxygeniert. Dabei entsteht ein Peroxidanion, welches zum Dioxetanonring zyklisiert. Dieses decarboxyliert spontan und bildet das Anion des Coelenteramids, was in einem angeregten Zustand vorliegt. Nach Aussendung eines Lichtquants fällt dieses wieder in den Grundzustand zurück, Oxyluciferin wird freigesetzt. Der Lichtemitter der Reaktion ist das an der Luciferase gebundene Oxyluciferin. Die Quantenausbeute ist temperatur- und pH-Wert-abhängig und liegt bei Q = 0,30.[58] Als Nebenreaktion entsteht zu 10 bis 15 % auch Etioluciferin, dabei wird aber kein Licht ausgestrahlt.
Bereits 1966 wurde vermutet, dass jenes Luciferin aus L-Arginin, L-Isoleucin und L-Tryptophan aufgebaut wird. Hierfür gibt es mittlerweile immer mehr Hinweise.[59][60]
Dehydrocoelenterazin aus Symplectoteuthis oualaniensis
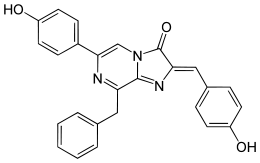
Symplectoteuthis oualaniensis (japanischer Name Tobi-ika) ist ein im Pazifik und Indischen Ozean weit verbreiteter Tintenfisch. Die erste Studie über seine Biolumineszenz wurde 1981 veröffentlicht.[61] Der Tintenfisch setzt Dehydrocoelenterazin durch ein spezielles Photoprotein um, was als „Symplectin“ bezeichnet wird. Dort liegt es wie bei anderen Photoproteinen (Aequorin, Obelin) als Chromophor über ein Cystein kovalent gebunden vor. Das bei der Umsetzung emittierte Licht ist bläulich, es wurden verschiedene Emissionsmaxima λmax angegeben (456 nm, 470 nm, 480 nm). Gebundenes Dehydrocoelenterazin wird an der C2-Position oxygeniert, nach der Biolumineszenzreaktion entsteht Coelenteramid und Apo-„Symplectin“. Letzteres wird durch ein Molekül Dehydrocoelenterazin wieder zu „Symplectin“ regeneriert.
Der nahe verwandte Tintenfisch Symplectoteuthis luminosa (japanischer Name Suji-ika) zeigt auch eine Biolumineszenz. Die involvierten chemischen Komponenten und der Mechanismus der Biolumineszenzreaktion ähneln bzw. gleichen denen von S. oualaniensis. Aus der Leber des Tintenfisches können größere Mengen an Dehydrocoelenterazin isoliert werden.
Biolumineszente Pilze

-6-(3%252C4-Dihydroxystyryl)-3%252C4-dihydroxy-2H-pyran-2-on.png.webp)
Seit der Antike sind biolumineszente Pilze bekannt, deren Fruchtkörper ein konstantes Leuchten erzeugen. Biolumineszenz wurde 1959 beim Myzel der Pilze Collybia velutipes und Armillaria mellea durch Zusammenführen kalter und gekochter Extrakte unter Zugabe von NADPH erzeugt.[62]
2015 wurde beim Pilz Pholiota squarrosa Hispidin als Luciferinvorläufer identifiziert. Dieses wird durch eine lösliche NADP(H)-abhängige Hydroxylase zum Luciferin 3-Hydroxyhispidin ((E)-6-(3,4-Dihydroxystyryl)-3,4-dihydroxy-2H-pyran-2-on) umgesetzt, dabei werden O2 und NADP(H) verbraucht. Das so gebildete Luciferin wird durch Luciferase mit Sauerstoff oxidiert, dabei wird sichtbares Licht emittiert. Die Isolation des zugrunde liegenden Luciferins ist wegen seiner Instabilität schwierig. Das gebildete Oxy-Luciferin ist ein Derivat der Kaffeesäure, das nach hydrolytischer Abspaltung von Pyruvat in Kaffeesäure überführt wird und als Ausgangsstoff zur Synthese von Hispidin dient.[63]
Mindestens 100 Pilzarten der Ordnung Agaricales nutzen zur Lichterzeugung dieselbe biochemische Reaktion.[63] Die ökologische Bedeutung ist noch nicht bekannt, vermutlich soll das Licht Insekten anlocken, die die Pilzsporen dann verbreiten.
Indem per Geneditierung Gene eines biolumineszenten Pilzes in Pflanzengenome eingefügt wurden, konnten Pflanzen dazu gebracht werden, eigenständig und permanent heller zu leuchten als jemals zuvor in Versuchen mit Bakteriengenen und Nanopartikeln.[64][65]
Nicht klassische Luciferin-Luciferase-Systeme
Das Latia-Luciferin
Das bei der Süßwasserschnecke Neuseelands (Latia neritoides) vorkommende Luciferin[66] ist ein terpenoider Aldehyd und wird als Latia-Luciferin bezeichnet.[67][68] Das Luciferin ist stark hydrophob, fettlöslich und eine farblose Flüssigkeit. Sein Absorptionsmaximum liegt bei λmax = 207 nm, der molare Extinktionskoeffizient bei 13,700 M−1.[69] Da es instabil ist, kann es spontan zu Ameisensäure und einem Aldehyd hydrolysieren. Für die Biolumineszenzreaktion ist letzterer jedoch nicht aktiv. Falls die Enol-Formylgruppe durch eine Enol-Ethergruppe ersetzt wird, ist das Luciferin ebenso nicht mehr aktiv.
Das Latia-Luciferin wird katalytisch zu einem Keton (oxy-Luciferin) umgesetzt, was durch eine 173 kDa große, farblose und nichtfluoreszierende Luciferase (EC 1.14.99.21) katalysiert wird.[70] Es ist ein Homohexamer, die einzelnen Untereinheiten sind ca. 30 kDa groß.[69]
Für die Reaktion wird neben dem Luciferin, der Luciferase und Sauerstoff auch ein Cofaktor benötigt, das 39 kDa große purple protein (purpurfarbenes Protein).[67][68] Dieses ist rot fluoreszierend und scheint eine Art Aktivator für die Biolumineszenzreaktion zu sein.[69] Es ist für diese aber nicht unbedingt nötig,[70] da es beispielsweise durch Ascorbat und NADH ersetzt werden kann. Auch ohne purpurfarbenes Protein kann die Biolumineszenzreaktion ablaufen. Bei der Reaktion entstehen aus einem Molekül Luciferin, Sauerstoff und Wasser jeweils ein oxidiertes Molekül Luciferin und zwei Moleküle Ameisensäure:
Dabei wird Licht freigesetzt, dessen Emissionsmaximum bei λmax = 536 nm liegt.[71] Daher leuchtet der Schleim dieser Schnecke, der z. B. nach mechanischen Reizen abgesondert wird, hellgrün. Die Reaktionseffizienz dieser Biolumineszenzreaktion ist sehr gering, da die Quantenausbeute Q bei ca. 0,003 (25 °C) bzw. 0,0068 (8 °C) liegt.[70][69] Um die Quantenausbeute zu erhöhen, kann man der Reaktion NADH (0,25 mM) und Ascorbat (1 mM) zusetzen, so dass diese auf 0,009 (25 °C) steigt. Hierbei entstehen jedoch andere Reaktionsprodukte, was durch folgende Gleichung dargestellt wird:
Ob bei den Reaktionen als Intermediat ein Dioxetanring gebildet wird, wird noch diskutiert. Das entstehende oxy-Luciferin ist aber im Gegensatz zu oxy-Luciferin des Leuchtkäfers kein Fluorophor. Es wird vermutet, dass die bei dieser Reaktion freiwerdende Energie auf den eigentlichen Emitter übertragen wird, einem proteingebundenen Flavin bzw. einer Flavin-ähnlichen Gruppe.[70][72]
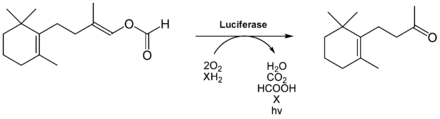
Luciferin aus Diplocardia longa
Das Luciferin des Wurmes Diplocardia longa ist ein einfacher Aldehyd, das N-Isovaleryl-3-aminopropanal. Dieses ist löslich in polaren Lösungsmittel (Methanol, Ethanol, Aceton, Methylacetat), jedoch nicht in unpolaren Lösungsmitteln wie Hexan oder Tetrachlormethan.[73] Das Besondere bei der Biolumineszenzreaktion ist die Tatsache, dass Wasserstoffperoxid an Stelle von molekularen Sauerstoff benötigt wird. Die korrespondierende Luciferase, eine etwa 300 kD großes, stark asymmetrisches Enzym, setzt dann die aktivierte Form, ein Peroxid-Addukt, um. Die Luciferase benötigt wahrscheinlich Kupfer, es wird blau-grünes Licht emittiert (λmax = 507 nm). Man weiß jedoch nicht, welchen Zweck die Biolumineszenz bei Würmern generell haben kann.[74][75] Auch hier muss der eigentliche Emitter der Biolumineszenzreaktion noch identifiziert werden.
Die Quantenausbeute dieser Reaktion ist mit Q = 0,002 sehr gering.[73]
Luciferin aus Fridericia heliota
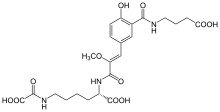
In Sibirien wurde beim Wenigborster Fridericia heliota, ein kleiner (15 mm lang, 0,5 mm breit, 2 mg schwer) weiß-gelblich aussehender Erdwurm, eine blaue Biolumineszenz entdeckt (λmax = 478 nm).[77] Diese tritt nach Berührung oder mechanischer Reizung im Bereich seiner epidermalen Zellen auf. Das Luciferin-Luciferase-System ist einzigartig, es reagiert nicht mit allen anderen bekannten Systemen. Für die Reaktion sind neben Sauerstoff auch ATP und Mg2+ notwendig.
Während der Biolumineszenzreaktion wird der Lysinrest oxidativ decarboxyliert.[76] Wahrscheinlich ähnelt die Reaktion der von Firefly-Luciferin. Als Eingangsreaktion bindet ATP am Lysinrest, in weiterer Folge wird dann ein Dioxetanonring erzeugt.
Anwendungen
Diagnostik
Mit Hilfe des Luciferin-Luciferase-System aus Leuchtkäfern kann die Anwesenheit von ATP in Proben schnell überprüft werden.[78] Dies nutzt man beispielsweise in der Lebensmittelindustrie aus, um bakterielle Kontaminationen zu detektieren.[79] ATP kommt nur bei lebenden Organismen vor, welches bei Lebensmittel durch die Biolumineszenzreaktion nachgewiesen werden kann.
Da die Lichtreaktion Aequorins von Calciumionen abhängig ist, kann durch dieses System die Konzentration an Calciumionen gemessen werden. Die erste Anwendung datiert sich auf 1967, als man mit Hilfe von Aequorins intrazelluläre Änderungen der Calciumkonzentrationen in Muskelzellen detektiert hat. Nach Klonierung von Aequorin in Bakterien konnte man die Calciumkonzentration bakteriellen Zytosols messen.[80] Außerdem ist es möglich, Aequorin in eukaryontische Zellen klonieren.[81] So konnte man beispielsweise bei transgenen Pflanzen die Änderung der cytosolischen Calciumkonzentration nach Berühren der Pflanze oder nach einem Kälteschock messen.[82]
Gentechnik/Biotechnologie
Luciferasen werden in der Molekularbiologie oft als Marker eingesetzt: Organismen, die das Gen erhalten und in ihr Genom eingebaut haben, leuchten bei Zufuhr von Luciferin. So lässt sich nachweisen, ob Gene, die man in Organismen einbringen möchte, auch wirklich exprimiert werden. Dafür wird das zu exprimierende Gen mit einem Gen gekoppelt, das für eine Luciferase kodiert. Durch solch ein Reportergen kann man auch Promotorregionen im Genom identifizieren. Kommerziell genutzt werden meist die Luciferase-Gene von Photinus pyralis und Renilla reniformis. Dabei kommen beide Enzyme häufig im selben Ansatz zur Verwendung (dual luciferase assay).[83][84][85]
Außerdem ist es möglich, durch die Lichtreaktion Protein-Protein-Interaktionen, Signale bei Signaltransduktionsprozessen und die Aktivität von zellulären Rezeptoren zu messen.[28]
Für lebende tierische Modellorganismen (Bioimaging) wurde die Verwendung von Luciferasereportern auch etabliert. Im Bereich der Krebsforschung kann mit Hilfe von Markern das Wachstum von Tumoren oder die Bildung von Metastasen verfolgt werden.[86] Außerdem kann an lebenden Tieren die Proteinexpression durch Luciferase-Luciferin-Systeme visualisiert werden.[87]
Siehe auch
Literatur
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, ISBN 981-256-801-8.
- T. Wilson, J. W. Hastings: Bioluminescence. In: Annu. Rev. Cell Dev., 14, 1998, S. 197–230. PMID 9891783.
- L. F. Greer, A. A. Szalay: Imaging of light emission from the expression of luciferases in living cells and organisms: a review. In: Luminescence, 17, 2002, S. 43–74. PMID 11816060; doi:10.1002/bio.676.
- K. Teranishi: Luminescence of imidazo[1,2-a]pyrazin-3(7H)-one compounds. In: Bioorg Chem., 35(1), 2007, S. 82–111. PMID 17007903.
- Thérèse Wilson, J. Woodland Hastings: Bioluminescence: Living Lights, Lights for Living. Harvard University Press, 2013, ISBN 978-0-674-06716-5.
- Aleksandra S. Tsarkova, Zinaida M. Kaskova, Ilia V. Yampolsky: A Tale Of Two Luciferins: Fungal and Earthworm New Bioluminescent Systems. In: Accounts of Chemical Research. Band 49, Nr. 11, 15. November 2016, S. 2372–2380, doi:10.1021/acs.accounts.6b00322.
Weblinks
- Luciferin-Luciferase Systeme. (englisch)
- Dieter Weiß: Lumineszenz – Chemilumineszenz – Biolumineszenz. Uni Jena
- Übersichtsseite. Society for Photobiology (englisch)
- Bruce R. Branchini: Chemistry of Firefly Bioluminescence.
- J. Woodland Hastings, Wayne Schultz,d Liyun Liu: Dinoflagellate Bioluminescence.
- Leo Yen-Cheng Lin, Edward A. Meighen: Bacterial Bioluminescence.
- Vadim R. Viviani: Terrestrial Bioluminescence.
Einzelnachweise
- Karl Ernst Georges: Ausführliches lateinisch-deutsches Handwörterbuch. 8., verbesserte und vermehrte Auflage. Hahnsche Buchhandlung, Hannover 1918 (zeno.org [abgerufen am 24. September 2019]).
- Waldemar Adam: Biologisches Licht. In: Chemie in unserer Zeit. Band 7, Nr. 6, 1973, S. 182–192, doi:10.1002/ciuz.19730070605.
- E. N. Harvey: Bioluminescence. Academic, New York 1952.
- J. W. Hastings: Bioluminescence. In: N. Sperelakis (Hrsg.): Cell Physiology, 3. Auflage, Academic Press, New York 2001, S. 1115–1131.
- P. J. Herring: Systematic distribution of bioluminescence in living organisms. In: J Biolumin Chemilumin., Band 1, Nr. 3, 1987, S. 147–163, PMID 3503524.
- Eveline Brodl, Andreas Winkler, Peter Macheroux: Molecular Mechanisms of Bacterial Bioluminescence. In: Computational and Structural Biotechnology Journal. Band 16, 15. November 2018, ISSN 2001-0370, S. 551–564, doi:10.1016/j.csbj.2018.11.003, PMID 30546856, PMC 6279958 (freier Volltext).
- K. Schmidt-Rohr: Oxygen is the high-energy molecule powering complex multicellular life: Fundamental corrections to traditional bioenergetics. In: ACS Omega, Band 5, Nr. 5, Januar 2020, S. 2221–2233, doi:10.1021/acsomega.9b03352.
- Emil H. White, Eliezer Rapaport, Howard H. Seliger, Thomas A. Hopkins: The chemi- and bioluminescence of firefly luciferin: an efficient chemical production of electronically excited states. In: Bioorg. Chem., Band 1, Nr. 1–2, September 1971, S. 92–122, doi:10.1016/0045-2068(71)90009-5.
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 1ff, ISBN 981-256-801-8.
- Externe Identifikatoren von bzw. Datenbank-Links zu D-Luciferin: CAS-Nummer: 2591-17-5, EG-Nummer: 219-981-3, ECHA-InfoCard: 100.018.166, PubChem: 5484207, ChemSpider: 4588411, Wikidata: Q3265801.
- G. A. Keller, S. Gould, M. Deluca, S. Subramani: Firefly luciferase is targeted to peroxisomes in mammalian cells. In: Proc Natl Acad Sci USA, Band 84, Nr. 10, Mai 1987, S. 3264–3268, doi:10.1073/pnas.84.10.3264.
- H. Fraga: Firefly luminescence: a historical perspective and recent developments. In: Photochem Photobiol Sci, Band 7, Nr. 2, 2008, S. 146–158, doi:10.1039/b719181b.
- John C. Day, Laurence C. Tisi, Mark J. Bailey: Evolution of beetle bioluminescence: the origin of beetle luciferin. In: Luminescence, Band 19, Nr. 1, 2004, S. 8–20, doi:10.1002/bio.749 (PDF).
- J. W. Hastings: Chemistries and colors of bioluminescent reactions: a review. In: Gene, Band 173, Nr. 1 special, 1996, S. 5–11, PMID 8707056, doi:10.1016/0378-1119(95)00676-1.
- Osamu Shimomura, Toshio Goto, Frank H. Johnson: Source of oxygen in the CO2 produced in the bioluminescent oxidation of firefly luciferin. In: Proc Natl Acad Sci USA, Band 74, Nr. 7, Juli 1977, S. 2799–2802, doi:10.1073/pnas.74.7.2799.
- M. DeLuca, M. E. Dempsey: Mechanism of oxidation in firefly luminescence. In: Biochem Biophys Res Commun, Band 40, Nr. 1, 1970, S. 117–122, PMID 5456946, doi:10.1016/0006-291X(70)91054-5.
- F. I. Tsuji, M. DeLuca, P. D. Boyer, S. Endo, M. Akutagawa: Mechanism of the enzyme-catalyzed oxidation of Cypridina and firefly luciferins studied by means of 17O2 and H218O. In: Biochem Biophys Res Commun., Band 74, Nr. 2, Januar 1977, S. 606–613, doi:10.1016/0006-291X(77)90346-1.
- Yoriko Ando, Kazuki Niwa, Nobuyuki Yamada, Toshiteru Enomoto, Tsutomu Irie, Hidehiro Kubota, Yoshihiro Ohmiya, Hidefumi Akiyama: Firefly bioluminescence quantum yield and colour change by pH-sensitive green emission. In: Nature Photonics, Band 2, 2008, S. 44–47, doi:10.1038/nphoton.2007.251.
- Thomas Eisner, Michael A. Goetz, David E. Hill, Scott R. Smedley, Jerrold Meinwald: Firefly »femmes fatales« acquire defensive steroids (lucibufagins) from their firefly prey. In: Proc Natl Acad Sci USA, Band 94, Nr. 18, September 1997, S. 9723–9728, (PDF).
- K. Gomi, N. Kajiyama: Oxyluciferin, a luminescence product of firefly luciferase, is enzymatically regenerated into luciferin. In: J Biol Chem., Band 276, Nr. 39, 2001, S. 36508–36513, doi:10.1074/jbc.M105528200 (PDF).
- Kazuki Niwa, Mitsuhiro Nakamura, Yoshihiro Ohmiya: Stereoisomeric bio-inversion key to biosynthesis of firefly D-luciferin. In: FEBS Letters, Band 580, Nr. 22, 2006, S. 5283–5287, doi:10.1016/j.febslet.2006.08.073 (PDF).
- N. Lembert: Firefly luciferase can use L-luciferin to produce light. In: Biochem J., Band 317, Teil 1, Juli 1996, S. 273–277, doi:10.1042/bj3170273 (PDF).
- Yuichi Oba, Naoki Yoshida, Shusei Kanie, Makoto Ojika, Satoshi Inouye: Biosynthesis of firefly luciferin in adult lantern: Decarboxylation of L-cysteine is a key step for benzothiazole ring formation in firefly luciferin synthesis. In: PLoS ONE, Band 8, Nr. 12, Dezember 2013, doi:10.1371/journal.pone.0084023 (PDF); dazu gibt es eine Korrektur.
- Yuichi Oba, Makoto Ojika, Satoshi Inouye: Firefly luciferase is a bifunctional enzyme: ATP-dependent monooxygenase and a long chain fatty acyl-CoA synthetase. In: FEBS Lett., Band 540, Nr. 1–3, April 2003, S. 251–254, doi:10.1016/S0014-5793(03)00272-2 (PDF).
- Y. Oba, K. Konishi, D. Yano, H. Shibata, D. Kato: Resurrecting the ancient glow of the fireflies. In: Science Advances. Band 6, Nr. 49, 2. Dezember 2020, ISSN 2375-2548, doi:10.1126/sciadv.abc5705, PMID 33268373, PMC 7710365 (freier Volltext).
- Stefan Wagner: Glühwürmchen: Laterne, Laterne, zeig mir deine Laterne. Abgerufen am 27. Januar 2021.
- Oliver C. Watkins, Miriam L. Sharpe, Nigel B. Perry, Kurt L. Krause: New Zealand glowworm (Arachnocampa luminosa) bioluminescence is produced by a firefly-like luciferase but an entirely new luciferin. In: Scientific Reports. Band 8, Nr. 1, 19. Februar 2018, S. 3278, doi:10.1038/s41598-018-21298-w, PMID 29459729.
- S. M. Marques, J. C. da Silva Esteves: Firefly bioluminescence: a mechanistic approach of luciferase catalyzed reactions. In: IUBMB Life, Band 61, Nr. 1, 2009, S. 6–17, doi:10.1002/iub.134.
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 249ff, ISBN 981-256-801-8.
- Carlos Fajardo, Marcos De Donato, Hectorina Rodulfo, Gonzalo Martinez-Rodriguez, Benjamin Costas: New Perspectives Related to the Bioluminescent System in Dinoflagellates: Pyrocystis lunula, a Case Study. In: International Journal of Molecular Sciences. Band 21, Nr. 5, 5. März 2020, ISSN 1422-0067, doi:10.3390/ijms21051784, PMID 32150894, PMC 7084563 (freier Volltext).
- D. Morse, A. M. Pappenheimer Jr., J. W. Hastings: Role of a luciferin-binding protein in the circadian bioluminescent reaction of Gonyaulax polyedra. In: J Biol Chem., Band 264, Nr. 20, 1989, S. 11822–11826, (PDF).
- D. Morse, M. Mittag: Dinoflagellate luciferin-binding protein. In: Methods Enzymol., Band 305, 2000, S. 258–276, doi:10.1016/s0076-6879(00)05493-8.
- Margaret Fogel, J. Woodland Hastings: A substrate-binding protein in the Gonyaulax bioluminescence reaction. In: Arch Biochem Biophys., Band 142, Nr. 1, Januar 1971, S. 310–321, doi:10.1016/0003-9861(71)90289-X.
- L. Wayne Schultz, Liyun Liu, Margaret Cegielski, J. Woodland Hastings: Crystal structure of a pH-regulated luciferase catalyzing the bioluminescent oxidation of an open tetrapyrrole. In: Proc Natl Acad Sci USA, Band 102, Nr. 5, 2005, S. 1378–1383, doi:10.1073/pnas.0409335102 (PDF).
- Margaret Fogel, J. W. Hastings: Bioluminescence: mechanism and mode of control of scintillon activity. In: Proc Natl Acad Sci USA, Band 69, Nr. 3, März 1972, S. 690–369, doi:10.1073/pnas.69.3.690 (PDF).
- T. Wilson, J. W. Hastings: Bioluminescence. In: Annu. Rev. Cell Dev., Band 14, 1998, S. 197–230, PMID 9891783.
- Chun Wu, Hidetoshi Akimoto, Yoshihiro Ohmiya: Tracer studies on dinoflagellate luciferin with [15N]-glycine and [15N]-l-glutamic acid in the dinoflagellate Pyrocystis lunula. In: Tetrahedron Letters, Band 44, Nr. 6, 2003, S. 1263–1266, doi:10.1016/S0040-4039(02)02815-0.
- Lee F. Greer, Aladar A. Szalay: Imaging of light emission from the expression of luciferases in living cells and organisms: a review. In: Luminescence, Band 17, Januar-Februar 2002, S. 43–74, doi:10.1002/bio.676 (PDF).
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 30ff, ISBN 981-256-801-8.
- S. C. Tu: Activity coupling and complex formation between bacterial luciferase and flavin reductases. In: Photochem Photobiol Sci., Band 7, Nr. 2, 2008, 2008, S. 183–188, doi:10.1039/b713462b.
- A. J. Fisher, T. B. Thompson, J. B. Thoden, T. O. Baldwin, I. Rayment: The 1.5-A resolution crystal structure of bacterial luciferase in low salt conditions. In: J Biol Chem., Band 271, Nr. 36, September 1996, S. 21956–21968, doi:10.1074/jbc.271.36.21956 (PDF).
- W. Duane, J. W. Hastings: Flavin mononucleotide reductase of luminous bacteria. In: Mol Cell Biochem., Band 6, Nr. 1, Januar 1975, S. 53–64, doi:10.1007/BF01731866.
- A. Rodriguez, D. Riendeau, E. Meighen: Purification of the acyl coenzyme A reductase component from a complex responsible for the reduction of fatty acids in bioluminescent bacteria. Properties and acyltransferase activity. In: J Biol Chem., Band 258, Nr. 8, April 1983, S. 5233–5237, PMID 6833298 (PDF).
- John Lee, Franz Müller, Antonie J. W. G. Visser: The Sensitized Bioluminescence Mechanism of Bacterial Luciferase. In: Photochemistry and Photobiology. 28. November 2018, ISSN 1751-1097, doi:10.1111/php.13063, PMID 30485901.
- Osamu Shimomura, Shoji Inoue, Frank H. Johnson, Yata Haneda: Widespread occurrence of coelenterazine in marine bioluminescence. In: Comp. Biochem. Physiol., Band 65, Nr. 2, 1980, S. 435–437, doi:10.1016/0305-0491(80)90044-9.
- A. K. Campbell, P. J. Herring: Imidazolopyrazine bioluminescence in copepods and other marine organisms. In: Mar. Biol., Band 104, Nr. 2, 1990, S. 219–225, doi:10.1007/BF01313261.
- Osamu Shimomura: Presence of coelenterazine in non-bioluminescent marine organisms. In: Comp Biochem Physiol. Teil B, Band 86, Nr. 2, 1987, S. 361–363, doi:10.1016/0305-0491(87)90306-3.
- O. Shimomura, F. H. Johnson, Y. Saiga: Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. In: J Cell Comp Physiol., Band 59, Juni 1963, S. 223–239, doi:10.1002/jcp.1030590302 (PDF).
- Osamu Shimomura, Frank H. Johnson, Hiroshi Morise: Mechanism of the luminescent intramolecular reaction of aequorin. In: Biochemistry, Band 13, Nr. 16, Juli 1974, S. 3278–3286, doi:10.1021/bi00713a016.
- J. F. Head, S. Inouye, K. Teranishi, O. Shimomura: The crystal structure of the photoprotein aequorin at 2.3 Å resolution. In: Nature, Band 405, Nr. 6784, Mai 2000, S. 291–293, doi:10.1038/35012659 (PDF).
- Osamu Shimomura, Frank H. Johnson: Calcium binding, quantum yield, and emitting molecule in aequorin bioluminescence. In: Nature, Band 227, Nr. 5265, September 1970, S. 1356–1357, PMID 4393938.
- S. Watasé: The luminous organ of firefly squid. In: Dobutsugaku Zasshi, Band 17, 1905, S. 119–123 (jap.).
- Shoji Inoue, Hisae Kakoi, Toshio Goto: Squid bioluminescence III. Isolation and structure of Watasenia luciferin. In: Tetrahedron Lett., Band 17, Nr. 34, August 1976, S. 2971–2972, doi:10.1016/S0040-4039(01)85503-9.
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 200ff, ISBN 981-256-801-8.
- Katsunori Teranishi, Osamu Shimomura: Bioluminescence of the arm light organs of the luminous squid Watasenia scintillans. In: Biochim Biophys Acta., Band 1780, Nr. 5, Mai 2008, S. 784–792, doi:10.1016/j.bbagen.2008.01.016 (PDF).
- Frederick I. Tsuji: Role of molecular oxygen in the bioluminescence of the firefly squid, Watasenia scintillans. In: Biochem Biophys Res Commun., Band 338, Nr. 1, September 2005, S. 250–253, doi:10.1016/j.bbrc.2005.08.215.
- J. G. Morin: Based on a review of the data, use of the term 'cypridinid' solves the Cypridina/Vargula dilemma for naming the constituents of the luminescent system of ostracods in the family Cypridinidae. In: Luminescence, Band 26, Nr. 1, 2011, S. 1–4, doi:10.1002/bio.1178.
- F. H. Johnson, O. Shimomura: Enzymatic and nonenzymatic bioluminescence. In: Photophysiology, Nr. 7, 1972, S. 275–334, PMID 4376836.
- Shin-ichi Kato, Yuichi Oba, Makoto Ojika, Satoshi Inouye: Identification of the biosynthetic units of Cypridina luciferin in Cypridina (Vargula) hilgendorfii by LC/ESI-TOF-MS. In: Tetrahedron, Band 60, Nr. 50, 2004, S. 11427–11434, doi:10.1016/j.tet.2004.09.080 (PDF).
- Shin-ichi Kato, Yuichi Oba, Makoto Ojika, Satoshi Inouye: Stereoselective incorporation of isoleucine into Cypridina luciferin in Cypridina hilgendorfii (Vargula hilgendorfii). In: Bioscience, Biotechnology, and Biochemistry, Band 70, Nr. 6, März 2006, S. 1528–1532, doi:10.1271/bbb.60066 (PDF).
- Frederick I. Tsuji, Gary B. Leisman: K/Na-triggered bioluminescence in the oceanic squid Symplectoteuthis oualaniensis. In: Proc Natl Acad Sci USA, Band 78, Nr. 11, November 1981, S. 6719–6723, doi:10.1073/pnas.78.11.6719 (PDF).
- Konstantin V. Purtov, Valentin N. Petushkov, Mikhail S. Baranov, Konstantin S. Mineev, Natalja S. Rodionova, Zinaida M. Kaskova, Aleksandra S. Tsarkova, Alexei I. Petunin, Vladimir S. Bondar, Emma K. Rodicheva, Svetlana E. Medvedeva, Yuichi Oba, Yumiko Oba, Alexander S. Arseniev, Sergey Lukyanov, Josef I. Gitelson, Ilia V. Yampolsky: The chemical basis of fungal bioluminescence. In: Angew Chem Int Ed Engl., Band 54, Nr. 28, 2015, S. 8124–8128, doi:10.1002/anie.201501779 (PDF).
- Alexey A. Kotlobay, Karen S. Sarkisyan, Yuliana A. Mokrushina, Marina Marcet-Houben, Ekaterina O. Serebrovskaya, Nadezhda M. Markina, Louisa Gonzalez Somermeyer, Andrey Y. Gorokhovatsky, Andrey Vvedensky, Konstantin V. Purtov, Valentin N. Petushkov, Natalja S. Rodionova, Tatiana V. Chepurnyh, Liliia I. Fakhranurova, Elena B. Guglya, Rustam Ziganshin, Aleksandra S. Tsarkova, Zinaida M. Kaskova, Victoria Shender, Maxim Abakumov, Tatiana O. Abakumova, Inna S. Povolotskaya, Fedor M. Eroshkin, Andrey G. Zaraisky, Alexander S. Mishin, Sergey V. Dolgov, Tatiana Y. Mitiouchkina, Eugene P. Kopantzev, Hans E. Waldenmaier, Anderson G. Oliveira, Yuichi Oba, Ekaterina Barsova, Ekaterina A. Bogdanova, Toni Gabaldón, Cassius V. Stevani, Sergey Lukyanov, Ivan V. Smirnov, Josef I. Gitelson, Fyodor A. Kondrashov, Ilia V. Yampolsky: Genetically encodable bioluminescent system from fungi. In: Proceedings of the National Academy of Sciences. Band 115, Nr. 50, 11. Dezember 2018, S. 12728–12732, doi:10.1073/pnas.1803615115, PMID 30478037.
- Scientists create glowing plants using mushroom genes (en). In: the Guardian, 27. April 2020. Abgerufen am 18. Mai 2020.
- Tatiana Mitiouchkina, Alexander S. Mishin, Louisa Gonzalez Somermeyer, Nadezhda M. Markina, Tatiana V. Chepurnyh, Elena B. Guglya, Tatiana A. Karataeva, Kseniia A. Palkina, Ekaterina S. Shakhova, Liliia I. Fakhranurova, Sofia V. Chekova, Aleksandra S. Tsarkova, Yaroslav V. Golubev, Vadim V. Negrebetsky, Sergey A. Dolgushin, Pavel V. Shalaev, Dmitry Shlykov, Olesya A. Melnik, Victoria O. Shipunova, Sergey M. Deyev, Andrey I. Bubyrev, Alexander S. Pushin, Vladimir V. Choob, Sergey V. Dolgov, Fyodor A. Kondrashov, Ilia V. Yampolsky, Karen S. Sarkisyan: Plants with genetically encoded autoluminescence. In: Nature Biotechnology. 38, Nr. 8, 27. April 2020, S. 944–946. doi:10.1038/s41587-020-0500-9. PMID 32341562.
- Externe Identifikatoren von bzw. Datenbank-Links zu Latia-Luciferin: CAS-Nummer: 21730-91-6, PubChem: 5280505, ChemSpider: 4444143, Wikidata: Q27102292.
- O. Shimomura, F. H. Johnson: The structure of Latia luciferin. In: Biochemistry, Band 7, Nr. 5, 1968, S. 1734–1738, PMID 5650377.
- Osamu Shimomura, Frank H. Johnson, Yasuhiro Kohama: Reactions involved in bioluminescence systems of limpet (Latia neritoides) and luminous bacteria. In: Proc Natl Acad Sci, Band 69, Nr. 8, August, S. 2086–2089, doi:10.1073/pnas.69.8.2086 (PDF).
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 182ff, ISBN 981-256-801-8.
- Ohmiya Yoshihiro, Kojima Satoshi, Nakamura Mitsuhiro, Niwa Haruki: Bioluminescence in the limpet-like snail, Latia neritoides. In: Bull. Chem. Soc. Jpn., Band 78, Nr. 7, 2005, S. 1197–1205, doi:10.1246/bcsj.78.1197.
- Mitsuhiro Nakamura, Mizuki Masaki, Shojiro Maki, Ryo Matsui, Minako Hieda, Masashi Mamino, Takashi Hirano, Yoshihiro Ohmiya, Haruki Niwa: Synthesis of Latia luciferin benzoate analogues and their bioluminescent activity. In: Tetrahedron Letters, Band 45, Nr. 10, März 2004, S. 2203–2205, doi:10.1016/j.tetlet.2004.01.027 (PDF).
- Vadim R. Viviani: The Biological and Biochemical Diversity of Terrestrial Bioluminescence. abgerufen am 2. Mai 2015.
- Osamu Shimomura: Bioluminescence: Chemical Principles and Methods. Word Scientific Publishing Company, 2006, S. 238ff, ISBN 981-256-801-8.
- N. G. Rudie, H. Ohtsuka, J. E. Wampler: Purification and properties of luciferin from the bioluminescent earthworm, Diplocardia longa. In: Photochem Photobiol., Band 23, Nr. 1, Januar 1976, S. 71–75, doi:10.1111/j.1751-1097.1976.tb06774.x.
- N. G. Rudie, M. G. Mulkerrin, J. E. Wampler: Earthworm bioluminescence: characterization of high specific activity Diplocardia longa luciferase and the reaction it catalyzes. In: Biochemistry, Band 20, Nr. 2, Januar 1981, S. 344–350, doi:10.1021/bi00505a018.
- Maxim A. Dubinnyi, Zinaida M. Kaskova, Natalja S. Rodionova, Mikhail S. Baranov, Andrey Yu. Gorokhovatsky, Alexey Kotlobay, Kyril M. Solntsev, Aleksandra S. Tsarkova, Valentin N. Petushkov, Ilia V. Yampolsky: Novel mechanism of bioluminescence: oxidative decarboxylation of a moiety adjacent to the light emitter of Fridericia luciferin. In: Angew Chem Int Ed Engl. 54(24), 2015, S. 7065–7067. PMID 25913753; doi:10.1002/anie.201501668
- Valentin N. Petushkov, Maxim A. Dubinnyi, Aleksandra S. Tsarkova, Natalja S. Rodionova, Mikhail S. Baranov, Vadim S. Kublitski, Osamu Shimomura, Ilia V. Yampolsky: A novel type of luciferin from the Siberian luminous earthworm Fridericia heliota: structure elucidation by spectral studies and total synthesis. In: Angew Chem Int Ed Engl., Band 53, Nr. 22, April 2014, S. 5566–5568, doi:10.1002/anie.201400529 (Manuskript).
- H. A. Neufeld, R. D. Towner, J. Pace: A rapid method for determining ATP by the firefly luciferin-luciferase system. In: Experientia, Band 31, Nr. 3, März 1975, S. 391–392, doi:10.1007/BF01922604.
- Jane-Marie Hawronskyj, John Holah: ATP: a universal hygiene monitor. In: Trends Food Sci. Tech., Band 8, März 1997, S. 79–84, doi:10.1016/S0924-2244(97)01009-1.
- M. R. Knight, A. K. Campbell, S. M. Smith, A. J. Trewavas: Recombinant aequorin as a probe for cytosolic free Ca2+ in Escherichia coli. In: FEBS Lett., Band 282, Nr. 2, Mai 1991, S. 405–408, doi:10.1016/0014-5793(91)80524-7 (PDF).
- J. M. Kendall, R. L. Dormer, A. K. Campbell: Targeting aequorin to the endoplasmic reticulum of living cells. In: Biochem. Biophys. Res. Commun., Band 189, Nr. 2, Dezember 1992, S. 1008–1016, doi:10.1016/0006-291x(92)92304-g.
- Marc R. Knight, Anthony K. Campbell, Steven M. Smith, Anthony J. Trewavas: Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium. In: Nature, Band 352, Nr. 6335, August 1991, S. 524–526, PMID 1865907.
- Mathias Hampf, Manfred Gossen: A protocol for combined Photinus and Renilla luciferase quantification compatible with protein assays. In: Anal Biochem., Band 356, Nr. 1, September 2006, S. 94–99, doi:10.1016/j.ab.2006.04.046 (PDF).
- Renilla Assays. pjk-gmbh.de
- Dual Luciferase Reporter Assay System. promega.de.
- Ed Lim, Kshitij D. Modi, Jaebeom Kim: In vivo bioluminescent imaging of mammary tumors using IVIS spectrum. In: J Vis Exp., Band 26, April 2009, S. 1210, doi:10.3791/1210 mit Video (engl.).
- Caitlin E. O'Connell-Rodwell, Mark A. Mackanos, Dmitrii M. Simanovski, Yu-An Cao, Michael H. Bachmann, H. Alan Schwettman, Christopher H. Contag: In vivo analysis of heat-shock-protein-70 induction following pulsed laser irradiation in a transgenic reporter mouse. In: J Biomed Opt., Band 13, Nr. 3, Mai 2008, S. 030501, doi:10.1117/1.2904665 (PDF).