Förster-Resonanzenergietransfer
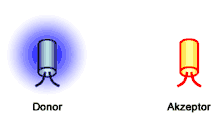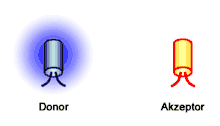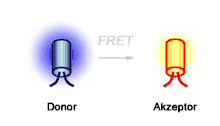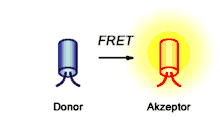
Der Förster-Resonanzenergietransfer (kurz FRET), manchmal auch (fälschlich)[1] Fluoreszenz-Resonanzenergietransfer genannt, ist ein nach Theodor Förster benannter physikalischer Prozess der Energieübertragung. Im Rahmen des Förster-Resonanzenergietransfers wird die Energie eines angeregten Farbstoffs, auch Donor genannt, auf einen zweiten Farbstoff, auch Akzeptor genannt, übertragen. Die Energie wird dabei strahlungsfrei und somit nicht über eine Abgabe (Emission) und Aufnahme (Absorption) von Lichtteilchen (Photonen) ausgetauscht.[2] Auf dem Förster-Resonanzenergietransfer basiert beispielsweise der Lichtsammelkomplex Photosynthese betreibender Organismen. In der Biochemie und der Zellbiologie findet der Förster-Resonanzenergietransfer insbesondere unter Verwendung von Fluoreszenzfarbstoffen als „optisches Nanometermaß“ Anwendung, da die Intensität unter anderem vom Abstand von Donor und Akzeptor abhängt und im Bereich von bis zu 10 nm beobachtet werden kann.[3]
Geschichte

Die Geschichte der Entdeckung und Erforschung des Förster-Resonanzenergietransfers lässt sich weit über Theodor Försters Aufsatz „Zwischenmolekulare Energiewanderung und Fluoreszenz“, der 1948 in den Annalen der Physik veröffentlicht wurde, zurückverfolgen. Wichtige Grundlagenerkenntnisse für die spätere wissenschaftliche Beschreibung dieses Phänomens lieferten bereits ab dem frühen 19. Jahrhundert Hans Christian Ørsted, Michael Faraday, James Clerk Maxwell und Heinrich Hertz.[4]
Erste experimentelle Hinweise auf einen Energietransfer zwischen zwei Molekülen gelang 1922 G. Cario und James Franck. Sie beobachteten in einem Quecksilber-Thallium-Dampfgemisch eine charakteristische, von ihnen als „sensibilisierte Fluoreszenz“ bezeichnete Lichtabgabe von Thallium nach einer Anregung mit Licht einer Wellenlänge, die spezifisch für die Anregung von Quecksilber ist.[5] Erste Versuche der Erklärung dieses Energietransfers von Jean-Baptiste Perrin und Francis Perrin beruhen auf einem sogenannten Nahfeld-Dipol-Dipol-Mechanismus.[6][7] Hartmut Kallman und Fritz London fanden eine quantenmechanische Erklärung für diesen strahlungsfreien Energietransfer.[8] Diese Erkenntnisse flossen in Francis Perrins Versuch einer quantitativen Beschreibung dieses Energietransfers ein. Sie beruhte jedoch auf der Fehlannahme, dass der Energietransfer mit der dritten und nicht mit der sechsten Potenz des Abstands beider Moleküle abnimmt.[7]
Theodor Förster beteiligte sich 1946 kurz nach dem Zweiten Weltkrieg an der Diskussion zur quantitativen Beschreibung des strahlungsfreien Energietransfers.[9] Doch erst sein Aufsatz „Zwischenmolekulare Energiewanderung und Fluoreszenz“ aus dem Jahr 1948 fand ein breites Echo in der Wissenschaft.[2]
Physik
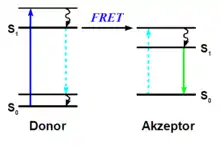
Der Förster-Resonanzenergietransfer kann zwischen zwei Farbstoffen, die als Moleküle, Komplexe oder Nanopartikel vorliegen, beobachtet werden. Dabei wird die Energie eines angeregten Donorfarbstoffs nicht in Form eines Photons abgegeben, sondern strahlungslos über Dipol-Dipol-Wechselwirkungen auf einen Akzeptorfarbstoff übertragen. Während das Coulombsche Gesetz für Monopole gilt, ist hier die elektrische Dipol-Dipol-Wechselwirkung für den Energietransfer verantwortlich, weshalb der Transfer auch von der sechsten Potenz des Abstands abhängt. Beschreibungen des Förster-Resonanzenergietransfers mit Hilfe der klassischen Physik oder der Quantenmechanik führen zu vergleichbaren Ergebnissen. Demnach induziert der angeregte Donor D* eine Oszillation im Akzeptor A. Charakteristisch für den Förster-Resonanzenergietransfer ist auch, dass die quantenmechanische Eigenschaft des Spins von Donor- und Akzeptorfarbstoff erhalten bleibt. Daher tritt der Förster-Resonanzenergietransfer in der Regel als sogenannter Singulett-Singulett-Transfer auf:
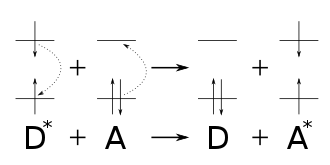
Dem gegenüber treten Energietransfers, die lediglich unter Erhaltung des Gesamtspins von Donor- und Akzeptorfarbstoff erfolgen, als ein auf einem Austausch von Elektronen basierenden Dexter-Energietransfer im Bereich von unter 2 nm Abstand auf.
Die auf den Akzeptorfarbstoff übertragene Energie kann von diesem beispielsweise in Form von Strahlung wieder abgegeben werden. Dem Donorfarbstoff hingegen steht die transferierte Energie nicht mehr für eine direkte Strahlungsabgabe zur Verfügung. Ebenso nimmt die Verweildauer des Donorfarbstoffs im angeregten Zustand ab. Makroskopisch äußert sich ein Förster-Resonanzenergietransfer anhand der Abnahme der Strahlungsintensität und der Fluoreszenzlebensdauer der Donorfarbstoffe sowie bei zur Strahlung befähigten Akzeptorfarbstoffen anhand einer Zunahme der Strahlungsintensität der Akzeptorfarbstoffe.
Donor und Akzeptor sind zumeist Fluoreszenzfarbstoffe, weshalb oft der Begriff Fluoreszenz-Resonanzenergietransfer als Synonym verwendet wird.[10] Fluoreszenz ist jedoch keine essenzielle Voraussetzung und am Energietransfer nicht beteiligt.[1] Auch zwischen Donoren, die zu anderen Formen der Strahlung, wie Phosphoreszenz, Biolumineszenz oder Chemolumineszenz, befähigt sind, und geeigneten Akzeptorfarbstoffen kann ein Förster-Resonanzenergietransfer beobachtet werden. Akzeptorfarbstoffe dürfen sogar nicht-emissiv sein und können zur Fluoreszenzlöschung führen (dark quencher).[11]
FRET-Effizienz
Die Effizienz des Förster-Resonanzenergietransfers , die Werte zwischen 0 und 1 annehmen kann, ist das Verhältnis aus der Anzahl an Energietransfers und der Anzahl der Donoranregungen. Sie spiegelt sich auch in der Förster-Resonanzenergietransferrate im Verhältnis zur Summe der Raten für Strahlungsemission des Donorfarbstoffs , Energietransfer und der Formen strahlungsfreien Abbaus wider:
Um eine möglichst effiziente strahlungsfreie Energieübertragung vom Donorfarbstoff auf den Akzeptorfarbstoff über den Förster-Resonanzenergietransfer zu ermöglichen, müssen drei wesentliche Kriterien erfüllt sein:[11]
- Abstand: Donorfarbstoff und Akzeptorfarbstoff sollten nur wenige Nanometer voneinander entfernt sein.
- Spektrum: Das Strahlungsemissionsspektrum des Donorfarbstoffs muss mit dem Absorptionsspektrum des Akzeptorfarbstoffs überlappen.
- Orientierung: Donor- und Akzeptorfarbstoff sollten möglichst parallele elektronische Schwingungsebenen haben.
Abstand
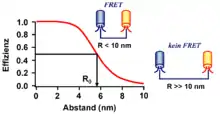
Das Ausmaß des Förster-Energietransfers, dargestellt als die Transferrate , ist von der Strahlungsemissionsrate des Donorfarbstoffs oder dessen Verweildauer im angeregten Zustand (Fluoreszenzlebensdauer) und in besonderer Weise vom Abstand zwischen Donor- und Akzeptorfarbstoff abhängig. Üblicherweise liegt dieser bei einem Förster-Resonanzenergietransfer im Bereich von etwa 0,5 bis 10 nm, wobei die Effizienz des Energietransfers mit der sechsten Potenz des Abstands beider Farbstoffe abnimmt.
Die Transferrate wird zudem vom Förster-Radius des Donor-Akzeptorfarbstoff-Paars bestimmt. entspricht dem Abstand zwischen beiden Farbstoffen, bei dem die Energieübertragung zu 50 % erfolgt:
Damit unterscheidet sich der Förster-Resonanzenergietransfer von einer Energieübertragung, die auf einer reinen Emission und Absorption von Strahlung beruht und die mit dem Quadrat des Abstands von Donor und Akzeptor abnimmt. Ebenso unterscheidet er sich von dem insbesondere bei sehr kleinen Abständen (< 0,5 nm) zu beobachtenden Dexter-Elektronentransfer, der auf einem Überlappen der Elektronenorbitale beruht und exponentiell mit dem Abstand abnimmt.[12]
Das Kriterium des geringen Abstandes zwischen Donor und Akzeptor führt dazu, dass der Förster-Resonanzenergietransfer oft als „optisches Nanometermaß“ genutzt wird.[3] Seine Nutzung erlaubt eine Abstandsmessung eines Donors zu seinem Akzeptor im Bereich des Nahfelds deutlich unterhalb des Auflösungsvermögens konventioneller optischer Verfahren, wie der Mikroskopie. Daher hat sich die Nutzung des Förster-Resonanzenergietransfers insbesondere in der Biochemie und der Zellbiologie als eine wertvolle Methode etabliert.
Spektren
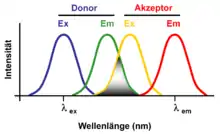
Eine Voraussetzung für einen Energietransfer ist, dass der Akzeptorfarbstoff zur Energieaufnahme befähigt ist. Dazu muss die zu transferierende Energiemenge, welche der Energiedifferenz aus angeregtem Zustand und Grundzustand entspricht, im Bereich der möglichen Energieaufnahme des Akzeptorfarbstoffs liegen. Dies ist gegeben, wenn das Emissionsspektrum des Donorfarbstoffs mit dem Absorptionsspektrum des Akzeptorfarbstoffs überlappt. Die Größe der überlappenden Fläche der Spektren von Donor- und Akzeptorfarbstoff, dargestellt als das Integral , ist proportional zur Transferrate und zur sechsten Potenz des Förster-Radius :
- ,
wobei die normierte Strahlungsintensität des Donorfarbstoffs bei der Wellenlänge und der Extinktionskoeffizient des Akzeptorfarbstoffs ist.
Orientierung
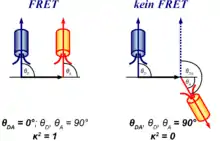
Für einen optimalen Energietransfer sollten Donor- und Akzeptorfarbstoff möglichst parallele elektronische Schwingungsebenen haben. Die Transferrate und die sechste Potenz des Förster-Radius des Donor-Akzeptor-Paars sind proportional zum Orientierungsfaktor :
- ,
wobei der Winkel zwischen dem Emissionsdipol des Donorfarbstoffs und dem Absorptionsdipol des Akzeptorfarbstoffs sowie und die Winkel zwischen beiden Dipolen und dem Verbindungsvektor zwischen Donor- und Akzeptorfarbstoff sind. kann Werte zwischen 0 und 4 annehmen, wobei der Wert 0 bei Rechtwinkligkeit (Orthogonalität) der Dipole und der Wert 1 bei parallel und der Wert 4 bei kollinear angeordneten Dipolen erreicht wird. Für frei bewegliche Farbstoffe, beispielsweise bei Untersuchung von Prozessen in Lösung, beträgt .[13] Sind hingegen Donor- und Akzeptorfarbstoff fixiert (z. B. am selben Protein oder in Membranen), so kann von diesem Wert abweichen und der Förster-Resonanzenergietransfer kann Aufschluss über die Änderung der Schwingungsebenen und damit der Lage beider Farbstoffe zueinander geben.
Messung
Da der Förster-Resonanzenergietransfer ein strahlungsfreier Energietransfer ist, lässt er sich nicht direkt nachweisen und quantifizieren. Jedoch können die Folgen eines Energietransfers, die Abnahme der Strahlungsintensität und der Fluoreszenzlebensdauer des Donorfarbstoffs sowie bei zur Strahlungsabgabe befähigten Akzeptorfarbstoffen die Akzeptoremission, mit Hilfe geeigneter instrumenteller Methoden nachgewiesen werden. Für diesen Zweck eignen sich beispielsweise Fluoreszenzmikroskope oder Fluorimeter. Um einen auf dem Förster-Mechanismus beruhenden Energietransfer nachzuweisen, muss streng genommen auch eine umgekehrte Proportionalität zwischen der Energietransferrate und der sechsten Potenz des Abstands beider Farbstoffe vorliegen. In der Praxis, insbesondere in der Biochemie, wird jedoch die Art des Energietransfers nur selten geprüft.[14]
Messung der Strahlungsemission des Donors
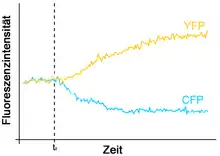
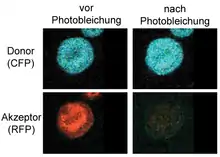
Da der Förster-Resonanzenergietransfer zu einer Abnahme der Strahlungsemission des Donorfarbstoffs führt, eignet sich dessen Messung für eine Detektion eines Resonanzenergietransfers. Eine Quantifizierung der FRET-Effizienz erfolgt durch Messung der Strahlungsintensität des Donorfarbstoffs in Ab- und in Anwesenheit des Akzeptorfarbstoffs :[13]
Die Strahlungsintensität kann dabei nicht nur in Form eines parallel durchgeführten Kontrollexperiments in Abwesenheit des Akzeptors ermittelt werden. kann auch in Anwesenheit des Akzeptors bestimmt werden, sofern angenommen werden kann, dass der Abstand zwischen Donor- und Akzeptorfarbstoff in einer für einen Förster-Resonanzenergietransfer irrelevanten Größenordnung befindet. Dies wird beispielsweise in der Biochemie bei Proteinen ausgenutzt, die mit Farbstoffen markiert sind und auf einen äußeren Reiz, beispielsweise ein Signalstoff, assoziieren oder dissoziieren. Eine weitere Methode der Bestimmung von trotz Anwesenheit des Akzeptorfarbstoffs besteht in seiner Zerstörung, beispielsweise mit Hilfe der Photobleichung. Die Photobleichung des Akzeptorfarbstoffs, die zu einer Zunahme der Strahlungsintensität des Donorfarbstoffs auf einen Wert ohne Resonanzenergietransfer führt, findet insbesondere bei immobilisierten Proben, beispielsweise in der Fluoreszenzmikroskopie, Anwendung.
Messung der Energieübertragung auf den Akzeptor
Einen weiteren Hinweis auf einen Resonanzenergietransfer liefert die Zunahme der Strahlungsintensität des Akzeptorfarbstoffs, sofern dieser zur Strahlungsemission befähigt ist. In der Praxis ist jedoch das Emissionsspektrum des Akzeptorfarbstoffs oft vom Anregungsspektrum und dem Emissionsspektrum des Donorfarbstoffs überlagert. Zudem lässt sich eine direkte Anregung des Akzeptorfarbstoffs durch eine zur Anregung des Donorfarbstoffs verwendete Strahlungsquelle oft nicht vermeiden. Durch eine gezielte Auswahl von Donor- und Akzeptorfarbstoff lassen sich jedoch diese Probleme minimieren.
Das Problem der direkten Anregung des Akzeptorfarbstoffs durch eine zur Anregung des Donorfarbstoffs verwendete Strahlungsquelle entfällt bei Verwendung eines chemi- oder biolumineszenten Donors. Insbesondere biolumineszente Donorfarbstoffen, wie die Luciferase von Renilla reniformis und deren Substrat Coelenterazin, in Kombination mit dem grün fluoreszierenden Protein (GFP) oder dessen Abkömmlingen finden bei der Abstandsbestimmung von Proteinen mit Hilfe des Biolumineszenz-Resonanzenergietransfers Anwendung.[10]
Eine weitere Möglichkeit der Vermeidung einer Ergebnisverfälschung durch eine direkte Akzeptoranregung besteht in einer kurzzeitigen Anregung eines Donorfarbstoffs mit einer langen Fluoreszenzlebensdauer und einer zeitverzögerten Messung der Akzeptorfluoreszenz. Für dieses Verfahren, das auch time-resolved FRET genannt wird, werden insbesondere langlebige Lanthanoide, wie Tb3+, Dy3+, Eu3+ oder Sm3+, als Donoren verwendet. Diese bieten zudem den Vorteil, dass ihre aus diskreten Peaks bestehenden Emissionsspektren das des Akzeptors Allophycocyanin kaum überlappen.[15]
Auch der chemische oder chromatographische Nachweis photolytischer Reaktionsprodukte des Akzeptorfarbstoffs kann zur Berechnung der FRET-Effizienz genutzt werden.[16]
Messung der Fluoreszenzlebensdauer
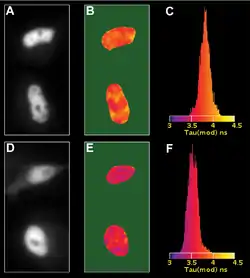
Die durch den Förster-Resonanzenergietransfer reduzierte Verweildauer des Donorfarbstoffs im angeregten Zustand lässt sich über die Messung seiner Fluoreszenzlebensdauer für den Nachweis eines Energietransfers und zu dessen Quantifizierung nutzen. Für die Berechnung der FRET-Effizienz wird die Fluoreszenzlebensdauer des Donorfarbstoffs in Ab- und Anwesenheit des Akzeptorfarbstoffs bestimmt:
Die Bestimmung der Fluoreszenzlebensdauer erfolgt in der Regel als bildgebendes Verfahren mit Hilfe der Fluoreszenzlebensdauer-Mikroskopie (FLIM). Die Messung selbst erfolgt pixelweise. Die Fluoreszenzlebensdauer kann dabei beispielsweise über eine Messung des zeitlichen Fluoreszenzabfalls mit Hilfe der zeitkorrelierten Einzelphotonenzählung nach einer ultrakurzen, pulsatilen Anregung bestimmt werden. Weitaus häufiger wird jedoch die Messung der Phasenverschiebung nach einer intensitätsmodulierten Anregung zur Bestimmung der Fluoreszenzlebensdauer genutzt (Phasenfluorimetrie).[13]
Vorkommen und Nutzung
Photosynthese
Gemeinsam mit dem Dexter-Energietransfer ist der Förster-Resonanzenergietransfer für die Funktion des Lichtsammelkomplexes bei der Photosynthese verantwortlich.[17] Die Aufgabe dieses Komplexes, der aus verschiedenen Membranproteinen, Chlorophyllen, Carotinoiden und bei Cyanobakterien und verschiedenen Algen aus Phycobilinen besteht, ist die effektive Sammlung der Lichtenergie und deren Weiterleitung an das Reaktionszentrum der Lichtreaktion. Ein stufenweiser Energietransfer von Carotinoiden oder Phycobilinen über Chlorophyll b auf das Chlorophyll a im Kern des Lichtsammelkomplexes führt zu einer effektiven Sammlung von Energie aus Licht unterschiedlicher Wellenlängen unter Freisetzung und Übertragung von Elektronen. Durch den Förster-Resonanzenergietransfer wird das Absorptionsspektrum des Lichtsammelkomplexes um Wellenlängenbereiche erweitert, die Chlorophyll a selbst nicht nutzen kann.[18]
Biolumineszenz

In der Natur wird der Förster-Resonanzenergietransfer im Rahmen der Biolumineszenz, der Lichterzeugung durch Lebewesen, genutzt. Ein Beispiel hierfür ist die pazifische Quallenart Aequorea victoria. In ihren Leuchtorganen ist zum einen das Photoprotein Aequorin mit seinem gebundenen Cofaktor Coelenterazin enthalten. Dieses produziert in isolierter Form und in Gegenwart von Ca2+ ein blaues Licht. Zum anderen ist in den Leuchtorganen das grün fluoreszierende Protein (GFP) enthalten. Dank eines effizienten Energietransfers vom Aequorin auf das grün fluoreszierende Protein leuchtet Aequorea victoria mit einer blau-grünen Farbe.[19]
Ein weiteres Beispiel für die Nutzung des Förster-Resonanzenergietransfer im Tierreich ist die Biolumineszenz der Seefedernart Renilla reniformis. Bei ihr erfolgt der Energietransfer von einer Luciferase, der Renilla-Luciferase (RLuc), auf das grün fluoreszierende Protein.
Sowohl das auf dem Förster-Resonanzenergietransfer basierende Leuchtsystem von Aequorea victoria aus Aequorin und dem grün fluoreszierenden Protein als auch das von Renilla reniformis aus der Renilla-Luciferase und dem grün fluoreszierenden Protein werden auch experimentell in der Biochemie zum Nachweis von Protein-Protein-Interaktionen genutzt.
Halbleitertechnik
Beim Betrieb organischer Halbleiter als aktives Material in organischen Leuchtdioden (OLEDs) spielt der Förster-Resonanzenergietransfer eine entscheidende Rolle. Durch die im Wellenlängenbereich nicht zwangsläufig deckungsgleichen Spektren von Emission und Absorption entsteht „von selbst“ ein 4-Niveau-System, wie es für Laser benötigt wird. Gleichzeitig wird eine günstige Auskopplungssituation erreicht, da das emittierte Licht weniger stark reabsorbiert wird.
Der Energietransfer in organischen Leuchtdioden, die sich derzeit unter anderem als mögliche Alternative zum Flüssigkristallbildschirm in der Entwicklung befinden, basiert auf dem Förster-Resonanzenergietransfer, dem Dexter-Energietransfer und der direkten Generierung von Exzitonen zwischen einem angeregten Host (Donor) und einem phosphoreszierenden Gast (Akzeptor).[20] Als Hostmaterialien finden beispielsweise Carbazole, Polyphenylene und Fluorene Anwendung, während als Gastfarbstoffe phosphoreszierende Osmium-, Platin- und insbesondere Iridium-Komplexe genutzt werden.[21]
Biochemie
In der Proteinbiochemie und darauf basierend auch in der Zellbiologie und der Pharmakologie wird der Förster-Resonanzenergietransfer analytisch genutzt, um Protein-Protein-Interaktionen und die Wechselwirkung von Proteinen mit anderen Stoffen nachzuweisen. Im Gegensatz zu den meisten anderen Methoden, wie beispielsweise der Co-Immunpräzipitation, der Affinitätschromatographie, des Hefe-Zwei-Hybrid-Systems und der bimolekularen Fluoreszenzkomplementation, erlaubt die Messung des Förster-Resonanzerenergietransfers eine Beobachtung von Protein-Protein-Interaktionen in Echtzeit mit einer zeitlichen Auflösung im Millisekundenbereich.[22]
Analyse von Protein-Protein-Interaktionen
Im Rahmen der auf der Messung des Förster-Resonanzenergietransfers basierenden Protein-Protein-Interaktionsstudien werden die zu untersuchenden Proteinpaare mit Hilfe von Paaren fluoreszierender oder sonstiger lumineszierender Farbstoffe markiert, sodass bei einer Interaktion der zu untersuchenden Proteine eine Zunahme des Förster-Resonanzenergietransfers zwischen den gekoppelten Farbstoffen beobachtet werden kann. Diese auf dem Förster-Resonanzenergietransfers basierenden Protein-Protein-Interaktionsstudien werden beispielsweise zur Aufklärung von Signalweiterleitungswegen in der Zelle und bei der Suche nach neuen Wirkstoffen mit Hilfe des Hochdurchsatz-Screenings eingesetzt.[23][24][25][26]
Für die Markierung der zu untersuchenden Proteine stehen verschiedene Verfahren zur Verfügung. Die unselektive direkte chemische Markierung, beispielsweise mit Hilfe von Fluoresceinisothiocyanat (FITC) oder Tetramethylrhodaminisothiocyanat (TRITC), eignet sich insbesondere für isolierte Proteine. Eine selektive, wenngleich indirekte Markierung besteht in der Verwendung Fluoreszenz-markierter Antikörper, die gegen die zu untersuchenden Proteine gerichtet sind. Die Markierung mit Hilfe einfacher molekularbiologischer Methoden hat sich insbesondere in der Zellbiologie etabliert. Auf diese Weise können Abkömmlinge des grün fluoreszierenden Proteins (GFP), wie beispielsweise das Donor-Akzeptorpaar CFP-YFP, auch in vivo an die zu untersuchenden Proteine gekoppelt werden können.[27] Ebenso wird auch die biolumineszente Renilla-Luciferase als Donor in Kombination mit einem GFP-Abkömmling als Akzeptor im Rahmen von Biolumineszenz-Resonanzenergietransferuntersuchungen genutzt.[28] Als Nachteil dieser Farbstoffe gilt ihre Größe, welche die Protein-Protein-Interaktionsanalyse beeinflussen kann. Dieses Problem kann mit Hilfe niedermolekularer Verbindungen, wie beispielsweise Fluorescein arsenical helix binder (FlAsH) und Resorufin arsenical helix binder (ReAsH), die an spezifische mit molekularbiologischer Methoden eingefügte Aminosäuresequenzen der zu untersuchenden Proteine binden, umgangen werden.[29]
Analyse von Protein-Konformationsänderungen
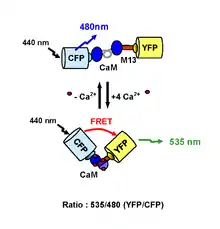
Werden sowohl der Donor- als auch der Akzeptorfarbstoff an ein und dasselbe Proteinmolekül gekoppelt, kann die Beobachtung eines intramolekularen Förster-Resonanzenergietransfers auch Rückschlüsse auf die Konformation und Konformationsänderung von Proteinen ermöglichen.[22] Dieses Prinzip wird unter anderem von FRET-basierten Biosensor-Proteinen, wie beispielsweise dem Ca2+-Indikator Cameleon[30] und Epac zum Nachweis von zyklischem Adenosinmonophosphat (cAMP)[31], genutzt, die in Gegenwart ihres Substrates einer Konformationsänderung unterliegen. Auch die endogen in Proteinen vorkommenden schwach fluoreszierenden Aminosäuren Tyrosin und Tryptophan lassen sich als Akzeptoren in Kombination mit geeigneten Donoren, wie beispielsweise Terbium, für eine auf einem Förster-Resonanzenergietransfer beruhende Protein-Strukturaufklärung nutzen.[32]
Molekularbiologie
In der Molekularbiologie finden DNA-basierte Verfahren unter Ausnutzung des Förster-Resonanzenergietransfers eine breite Anwendung. Hierbei werden Farbstoff-gekoppelte DNA-Oligonukleotide verwendet, bei denen durch Formierung eines Duplexes ein Energietransfer beobachtet werden kann oder alternativ bei Zerstörung ihrer Tertiärstruktur ein Energietransfer beendet wird. Diese können als analytische Werkzeuge bei der Polymerasekettenreaktion (PCR), Hybridisierung, Ligation, Spaltung, Rekombination und Synthese von Nukleinsäuren genutzt werden. Darüber hinaus werden sie bei der DNA-Sequenzanalyse, der Mutationsanalyse und der Konzentrationsbestimmung von DNA und RNA eingesetzt.[33]
Für diese Vielzahl an Anwendungsgebieten werden unterschiedliche Farbstoff-gekoppelte Oligonukleotide eingesetzt. Neben Donoren, wie beispielsweise Fluorescein, werden als Akzeptor-Farbstoffe das rot fluoreszierende Rhodamin und verwandte Farbstoffe sowie nicht-fluoreszierende dark quencher eingesetzt. Wenngleich letztere keine Identifizierung eines Energietransfers anhand einer Zunahme der Akzeptoremission erlauben, bieten sie den Vorteil der Möglichkeit einer Einkanalmessung der Donorfluoreszenz, die nicht von einer Akzeptorfluoreszenz überlagert ist.
Hybridisierung
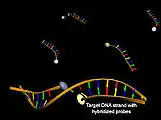 Struktur von Hybridisierungssonden vor (oben) und nach Hybridisierung mit der Ziel-DNA (unten) unter Zunahme der Akzeptorfluoreszenz (gelb)
Struktur von Hybridisierungssonden vor (oben) und nach Hybridisierung mit der Ziel-DNA (unten) unter Zunahme der Akzeptorfluoreszenz (gelb)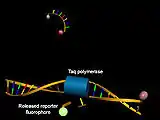 Struktur von Hydrolysesonden vor (oben) und nach Hybridisierung mit der Ziel-DNA und Abspaltung des 5'-Terminus unter Zunahme der Donorfluoreszenz (grün)
Struktur von Hydrolysesonden vor (oben) und nach Hybridisierung mit der Ziel-DNA und Abspaltung des 5'-Terminus unter Zunahme der Donorfluoreszenz (grün)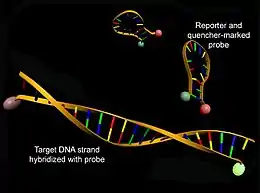 Struktur von Molecular Beacons vor (oben) und nach Hybridisierung mit einer Ziel-DNA (unten) unter Zunahme der Donorfluoreszenz (grün)
Struktur von Molecular Beacons vor (oben) und nach Hybridisierung mit einer Ziel-DNA (unten) unter Zunahme der Donorfluoreszenz (grün)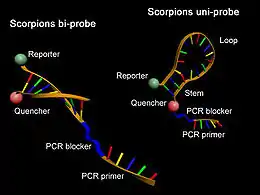 Struktur von Scorpion-Primern (rechts) und Scorpion-Bi-Primern (links)
Struktur von Scorpion-Primern (rechts) und Scorpion-Bi-Primern (links)
Zu den Förster-Resonanzenergietransfer nutzenden molekularbiologischen Werkzeugen, die zur Identifizierung von DNA mittels Hybridisierung genutzt werden, zählen die sogenannten Hybridisierungssonden (LightCycler-Sonden). Sie bestehen aus zwei nicht-komplementären Oligonukleotiden, wobei jeweils ein Farbstoff des Donor-Akzeptor-Paars an das 3'-Ende des einen und an das 5'-Ende des anderen Oligonukleotids gekoppelt ist. Binden beide Oligonukleotide in unmittelbarer Nähe an einen DNA-Einzelstrang, so kann ein Förster-Resonanzenergietransfer nach Donoranregung durch Abnahme der Donorfluoreszenz und Zunahme der Akzeptorfluoreszenz beobachtet werden.[33] Eine Abwandlung dieser Methode besteht in der Verwendung von Hybridisierungssonden, die aus zueinander komplementären DNA-Strängen bestehen. Sie erlauben ebenfalls eine Konzentrationsbestimmung einer Ziel-DNA, wobei durch Kompetition zwischen Ziel-DNA und komplementären Strang der Sonde nach Hybridisierung eine Abnahme des Energietransfers zu beobachten ist.[34]
Ebenfalls im Rahmen von Hybridisierungsanalysen werden Molecular Beacons eingesetzt. Diese bestehen aus einer Schleifen-Stamm-Struktur mit einem selbstkomplementären Stamm an den 3'- und 5'-Enden, an denen sich ein Donor-Fluoreszenzfarbstoff bzw. ein Quencher befinden, und einer zur Ziel-DNA komplementäre Schleife. Eine Abnahme eines Energietransfers kann durch Zunahme der Donorfluoreszenz nach Anregung infolge einer Hybridisierung der Sonde mit einer komplementären Ziel-DNA und eines Auflösens der Tertiärstruktur der Molecular Beacons beobachtet werden.[35]
Polymerasekettenreaktion (PCR)
Insbesondere im Rahmen der quantitativen Echtzeit-PCR werden DNA-Oligonukleotid-basierte Sonden zur Bestimmung der Konzentration der synthetisierten DNA unter Analyse des Förster-Resonanzenergietransfers genutzt. Neben Hybridisierungssonden und Molecular Beacons finden hierbei insbesondere Hydrolysesonden (TaqMan-Sonden) Anwendung. Diese bestehen aus kurzen, zur Ziel-DNA komplementären DNA-Oligonukleotiden, an deren 5'- und 3'-Enden ein Donor-Fluoreszenzfarbstoff bzw. ein Quencher gekoppelt wurde. Während in Abwesenheit ausreichender Mengen komplementärer Ziel-DNA dank des Förster-Resonanzenergietransfers die Donorfluoreszenz unterdrückt wird, nimmt diese dank der 5'-Exonukleaseaktivität der Taq-Polymerase nach Hybridisierung unter Abspaltung des Donor-gekoppelten 5'-terminalen Nukleotids zu.[33]
Ebenfalls auf der Nutzung des Förster-Resonanzenergietransfers basiert die quantitative Echtzeit-PCR unter Verwendung von Scorpion-Primern. Diese bestehen wie Molecular Beacons aus einer Donor-Fluoreszenzfarbstoff- und Quencher-gekoppelten Schleifen-Stamm-Struktur in Verbund mit einem PCR-Primer. Im Gegensatz zu anderen FRET-Sonden werden Scorpion-Primer im Rahmen der Polymerasekettenreaktion in die synthetisierte DNA eingebaut. Wie bei der Verwendung von Molecular Beacons kann bei Scorpion-Primern eine Abnahme eines Energietransfers durch Zunahme der Donorfluoreszenz nach Anregung infolge eines Einbaus des Primers und einer Hybridisierung der Schleife-Stamm-Struktur mit der Ziel-DNA unter Auflösung der Tertiärstruktur beobachtet werden.[36]
Literatur
- Theodor Förster: Zwischenmolekulare Energiewanderung und Fluoreszenz, Ann. Physik 6(2):55, 1948. doi:10.1002/andp.19484370105
- Joseph R. Lakowicz: Principles of Fluorescence Spectroscopy. Plenum Publishing Corporation, 2. Ausgabe, 1999.
- Eintrag zu Förster-resonance-energy transfer (FRET). In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.FT07381 – Version: 2.3.1.
Weblinks
- Olympus: Applications in Confocal Microscopy: Fluorescence Resonance Energy Transfer (FRET) Microscopy. Archiviert vom Original am 9. Mai 2015; abgerufen am 13. Juli 2016 (englisch).
- Interaktives Tutorial zur Optimierung der fluoreszenzmikroskopischen Messbedingungen des Herstellers Nikon (englisch)
- FLIM FRET Imaging (Tutorial von Becker & Hickl, website)
Einzelnachweise
- S. E. Braslavsky: Glossary of terms used in photochemistry, 3rd edition (IUPAC Recommendations 2006). In: Pure and Applied Chemistry. Band 79, Nr. 3, 1. Januar 2007, ISSN 1365-3075, doi:10.1351/pac200779030293.
- Förster T: Zwischenmolekulare Energiewanderung und Fluoreszenz. In: Ann. Physik. 437, 1948, S. 55. doi:10.1002/andp.19484370105.
- Stryer L: Fluorescence energy transfer as a spectroscopic ruler. In: Annu. Rev. Biochem.. 47, 1978, S. 819–46. doi:10.1146/annurev.bi.47.070178.004131. PMID 354506.
- Clegg, Robert M.: The history of FRET. In: Lakowicz, Joseph R.; Chris D. Geddes (Hrsg.): Reviews in Fluorescence 2006. Springer, Berlin 2006, ISBN 0-387-29342-6, S. 1–46.
- Cario G, Franck J: Über Zerlegung von Wasserstoffatomen durch angeregte Quecksilberatome. In: Z. Physik. 11, 1922, S. 161–166.
- Perrin J: Fluorescence et induction moleculaire par resonance. In: C. R. Hebd. Seances Acad. Sci.. 184, 1927, S. 1097–1100.
- Perrin F: Théorie des transferts d'activation entre molécules de méme espèce. In: Ann. Chim. Phys. (Paris). 17, 1932, S. 283–314.
- Kallmann H, London F: Über quantenmechanische Energieübertrangungen zwischen atomaren Systemen. In: Z. Physik. Chem. B. 2, 1928, S. 207–243.
- Förster T: Energiewanderung und Fluoreszenz. In: Die Naturwissenschaften. 6, 1946, S. 166–175.
- Marullo S, Bouvier M: Resonance energy transfer approaches in molecular pharmacology and beyond. In: Trends Pharmacol. Sci.. 28, Nr. 8, August 2007, S. 362–365. doi:10.1016/j.tips.2007.06.007. PMID 17629577.
- Demchenko AP: Förster Resonance Energy Transfer. In: Introduction to Fluorescence Sensing. Springer, Berlin 2008, ISBN 1-4020-9002-1, S. 91–99.
- Dexter DL: A theory of sensitized luminescence in solids. In: J Chem Phys. 21, 1953, S. 836. doi:10.1063/1.1699044.
- Robert M. Clegg: Forster resonance energy transfer - FRET what is it, why do it, and how it's done. In: Theodorus W. J. Gadella (Hrsg.): FRET and FLIM techniques. Elsevier, Amsterdam 2009, ISBN 0-08-054958-6, S. 1–58.
- Demchenko AP: Förster Resonance Energy Transfer. In: Mechanisms of Signal Transduction. Springer, Berlin 2008, ISBN 1-4020-9002-1, S. 249–298.
- Bazin H, Trinquet E, Mathis G: Time resolved amplification of cryptate emission: a versatile technology to trace biomolecular interactions. In: Rev. Mol. Biol.. 82, Nr. 3, Januar 2002, S. 233–250. doi:10.1016/S1389-0352(01)00040-X. PMID 11999692.
- Mekler VM: A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. In: Photochem. Photobiol.. 59, Januar, S. 615–620. doi:10.1111/j.1751-1097.1994.tb09665.x.
- Laible PD et al.: Detailed Balance in Förster–Dexter Excitation Transfer and Its Application to Photosynthesis. In: J. Phys. Chem. B. 102, Nr. 9, 1998, S. 1641–1648. doi:10.1021/jp9730104.
- Kê, Bacon: Photosystem II. In: Photosynthesis: photobiochemistry and photobiophysics. Kluwer Academic, 2001, ISBN 0-7923-6791-X, S. 199–322.
- Kendall JM, Badminton MN: Aequorea victoria bioluminescence moves into an exciting new era. In: Trends Biotechnol.. 16, Nr. 5, Mai 1998, S. 216–24. PMID 9621461.
- Yang X, Neher D: Scherf U, Müllen K (Hrsg.): Organic Light Emitting Devices: Synthesis, Properties and Applications. Wiley-VCH, Weinheim 2006, ISBN 3-527-31218-8, S. 333–368.
- Kappaun S, Slugovc C, List EJ: Phosphorescent organic light-emitting devices: working principle and iridium based emitter materials. In: Int J Mol Sci. 9, Nr. 8, August 2008, S. 1527–1547. doi:10.3390/ijms9081527. PMID 19325819. PMC 2635741 (freier Volltext).
- Truong K, Ikura M: The use of FRET imaging microscopy to detect protein-protein interactions and protein conformational changes in vivo. In: Curr. Opin. Struct. Biol.. 11, Nr. 5, Oktober 2001, S. 573–8. PMID 11785758.
- Gaits F, Hahn K: Shedding light on cell signaling: interpretation of FRET biosensors. In: Sci. STKE. 2003, Nr. 165, Januar 2003, S. PE3. doi:10.1126/stke.2003.165.pe3. PMID 12527820.
- Boute N, Jockers R, Issad T: The use of resonance energy transfer in high-throughput screening: BRET versus FRET. In: Trends Pharmacol. Sci.. 23, Nr. 8, August 2002, S. 351–354. PMID 12377570.
- Cooper MA: Advances in membrane receptor screening and analysis. In: J. Mol. Recognit.. 17, Nr. 4, 2004, S. 286–315. doi:10.1002/jmr.675. PMID 15227637.
- Goddard JP, Reymond JL: Recent advances in enzyme assays. In: Trends Biotechnol.. 22, Nr. 7, Juli 2004, S. 363–370. doi:10.1016/j.tibtech.2004.04.005. PMID 15245909.
- Giepmans BN, Adams SR, Ellisman MH, Tsien RY: The fluorescent toolbox for assessing protein location and function. In: Science. 312, Nr. 5771, April 2006, S. 217–24. doi:10.1126/science.1124618. PMID 16614209.
- Pfleger KD, Eidne KA: Illuminating insights into protein-protein interactions using bioluminescence resonance energy transfer (BRET). In: Nat. Methods. 3, Nr. 3, März 2006, S. 165–74. doi:10.1038/nmeth841. PMID 16489332.
- Griffin BA, Adams SR, Tsien RY: Specific covalent labeling of recombinant protein molecules inside live cells. In: Science. 281, Nr. 5374, Juli 1998, S. 269–72. PMID 9657724.
- Miyawaki A, Griesbeck O, Heim R, Tsien RY: Dynamic and quantitative Ca2+ measurements using improved cameleons. In: Proc. Natl. Acad. Sci. USA. 96, Nr. 5, März 1999, S. 2135–40. PMID 10051607. PMC 26749 (freier Volltext).
- Ponsioen B, Zhao J, Riedl J, et al.: Detecting cAMP-induced Epac activation by fluorescence resonance energy transfer: Epac as a novel cAMP indicator. In: EMBO Rep.. 5, Nr. 12, Dezember 2004, S. 1176–80. doi:10.1038/sj.embor.7400290. PMID 15550931. PMC 1299185 (freier Volltext).
- Allen JE, McLendon GL: Tryptophan and tyrosine to terbium fluorescence resonance energy transfer as a method to “map” aromatic residues and monitor docking. In: Biochem. Biophys. Res. Commun.. 349, Nr. 4, November 2006, S. 1264–8. doi:10.1016/j.bbrc.2006.08.165. PMID 16979582.
- Didenko VV: DNA probes using fluorescence resonance energy transfer (FRET): designs and applications. In: BioTechniques. 31, Nr. 5, November 2001, S. 1106–16, 1118, 1120–1. PMID 11730017. PMC 1941713 (freier Volltext).
- Morrison LE, Halder TC, Stols LM: Solution-phase detection of polynucleotides using interacting fluorescent labels and competitive hybridization. In: Anal. Biochem.. 183, Nr. 2, Dezember 1989, S. 231–44. PMID 2624314.
- Tyagi S, Kramer FR: Molecular beacons: probes that fluoresce upon hybridization. In: Nat. Biotechnol.. 14, Nr. 3, März 1996, S. 303–8. doi:10.1038/nbt0396-303. PMID 9630890.
- Whitcombe D, Theaker J, Guy SP, Brown T, Little S: Detection of PCR products using self-probing amplicons and fluorescence. In: Nat. Biotechnol.. 17, Nr. 8, August 1999, S. 804–7. doi:10.1038/11751. PMID 10429248.