Aequorin
Aequorin ist ein Photoprotein aus biolumineszenten Quallen der Gattung Aequorea. Am besten untersucht ist dabei Aequorin aus Aequorea victoria. In Aequorin liegt Coelenterazin, ein Luciferin, gebunden vor. Nach Zugabe von Calciumionen emittiert es in vitro Lichtquanten mit einer Wellenlänge von λmax = 470 nm (A. victoria), weswegen es auch als das „blau-fluoreszierende Protein“ bezeichnet wird. Im Folgenden wird auf das Aequorin aus A. victoria verwiesen.
| Aequorin-1 (Aequorea victoria) | ||
|---|---|---|
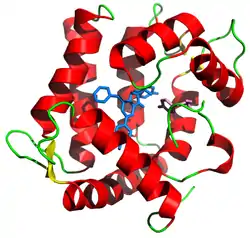 | ||
| Bändermodell von Aequorin-2 nach PDB 1EJ3 mit hervorgehobenen Tyrosin 184 (pink) und gebundenen Coelenterazin (blau) | ||
|
Vorhandene Strukturdaten: 1sl8 | ||
| Masse/Länge Primärstruktur | 189 Aminosäuren | |
| Kofaktor | Ca2+ | |
| Bezeichner | ||
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.13.12.5, Monooxygenase | |
| Substrat | Coelenterazin, Luziferin + O2 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Cnidaria | |
Geschichte
Aequorin wurde ursprünglich 1961 von Osamu Shimomura aus Aequorea victoria isoliert.[1] Die Struktur von Coelenterazin, dem gebundenen Luciferin, wurde 1974 aufgeklärt.[2] 1990 wurde das Gen für Aequorin aus A. victoria kloniert.[3]
Struktur
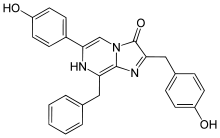
Aequorin besteht aus dem eigentlichen Apoprotein Apoaequorin (189 Aminosäuren, 22 kDa) und seiner prosthetischen Gruppe Coelenterazin, das mit einer Molmasse von 423 sehr viel kleinere Luciferin. Coelenterazin ist dabei über eine Peroxidbrücke an das Protein gebunden.
Das Apoprotein enthält vier Helix-loop-helix-Motive (EF-Hands), von denen drei Calciumionen binden können. Die Kristallstruktur Aequorins wurde im Jahre 2000 mit einer Auflösung von 2,3 Å bestimmt und publiziert.[4]
Aequorin ist eines der am besten untersuchten Calciumionen-bindenden Photoproteine. Es wird auch vermutet, dass es aus regulären calciumbindenen Proteinen wie Calmodulin hervorgegangen ist.[5]
Biochemie
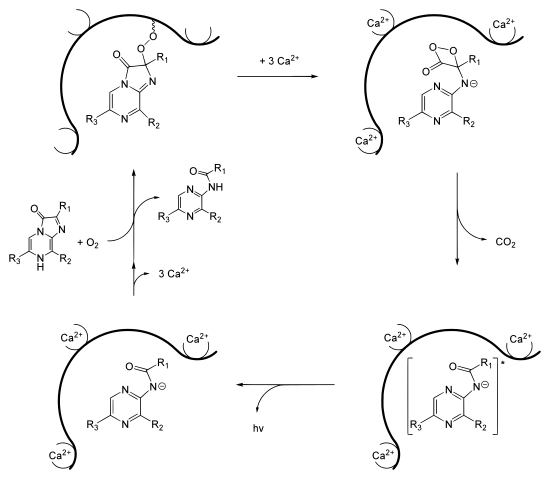
Aequorin enthält ein durch eine Peroxidbrücke gebundenes Coelenterazinmolekül, dem eigentlichen Luciferin. Wenn die drei Bindungsstellen mit Calciumionen besetzt werden, ändert sich die Konformation des Proteins, so dass eine intramolekulare Reaktion ausgelöst wird. Infolgedessen wird Coelenterazin zu einem instabilen Dioxetan umgesetzt. Nach Decarboxylierung entsteht das Anion von Coeleteramid in einem elektronisch angeregtem Zustand. Nach Relaxation in den Grundzustand wird ein Lichtquant freigesetzt.
Aequorin kann nach Freisetzung der gebundenen Calciumionen durch molekularem Sauerstoff und einem neuen Molekül Coelenterazin regeneriert werden. Der genaue Mechanismus ist bislang aber noch unbekannt.
Die Quantenausbeute dieser Reaktion liegt bei Q = 0,15–0,20.[6]
In-vivo-Aktivität
Die Qualle A. victoria leuchtet blau-grün, da Aequorin einen Teil der Energie der Biolumineszenzreaktion strahlungsfrei über den Förster-Resonanzenergietransfer an das grün fluoreszierende Protein (GFP) überträgt.[7]
Anwendungen
Da die Biolumineszenz Aequorins Calciumionen benötigt, kann es als intramolekularer Calciumsensor verwendet werden. Bereits 1967 wurde die intrazellulare Calciumkonzentration sich kontrahierender Muskelfibrillen analysiert.[8] 1985 wurde die cDNA von Aequorin kloniert.[9] Dies erlaubt die Transformation des Gens für Apoaequorin in verschiedene Organismen (Bakterien, Hefen, Pflanzen und tierische Zellen). So konnte beispielsweise die cytosolische Calciumkonzentration nach gewissen Reizen beispielsweise bei Pflanzen (Wind oder Kälteschock)[10] oder Hefen (Pheromone)[11] gemessen werden.
Durch Anbringen einer speziellen Sequenz wird Apoaequorin in spezielle Organellen transportiert. Dies erlaubt das Messen der Calciumkonzentration z. B. in Mitochondria[12] oder dem Zellkern.[13] Fluoreszierende, Calciumionen-bindende Chelatorfarbstoffe (z. B. Fura-2) sind dagegen nicht so sensitiv und werden kaum so selektiv in das gewünschte Organell gebracht.
Als Calciumsensor ist Aequorin auch deshalb beliebt, weil es mit Antikörpern oder Proteinen verbunden werden kann und ein sehr gutes Signal-Rausch-Verhältnis aufweist. In allen Fällen muss das Luciferin Coelenterazin als Substrat für Aequorin vorliegen, was als hydrophobes Molekül aber leicht durch die Zellmembran diffundieren kann.
Siehe auch
Literatur
- JM. Kendall, MN. Badminton: Aequorea victoria bioluminescence moves into an exciting new era. In: Trends Biotechnol., 16, 1998, 5, S. 216–224; PMID 9621461
- O. Shimomura: The discovery of aequorin and green fluorescent protein. In: J Microsc, 2005, 217, Pt 1, S. 1–15; PMID 15655058
Einzelnachweise
- O. Shimomura et al.: Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. In: J Cell Comp Physiol., 1962, 59, S. 223–239, PMID 13911999
- O. Shimomura et al.: Mechanism of the luminescent intramolecular reaction of aequorin. In: Biochemistry, 13, 1974, 16, S. 3278–3286; PMID 4152180
- AK. Campbell et al.: From Luc and Phot genes to the hospital bed. In: J Biolumin Chemilumin., 5, 1990, 2, S. 131–139; PMID 1970919
- JF. Head: The crystal structure of the photoprotein aequorin at 2.3 A resolution. In: Nature, 405, 2000, 6784, S. 372–376; PMID 10830969; nature.com (PDF; englisch)
- FI. Tsuji et al.: Molecular evolution of the Ca(2+)-binding photoproteins of the Hydrozoa. In: Photochem Photobiol., 62, 1995, 4, S. 657–661; PMID 7480150
- J.M. Kendall, M.N. Badminton: Aequorea victoria bioluminescence moves into an exciting new era. In: Trends Biotechnol., 16, 1998, 5, S. 216–224. PMID 9621461
- JM Kendall, MN Badminton: Aequorea victoria bioluminescence moves into an exciting new era. In: Trends Biotechnol.. 16, Nr. 5, Mai 1998, S. 216–24. PMID 9621461.
- EB. Ridgway, CC. Ashley: Calcium transients in single muscle fibers. In: Biochem Biophys Res Commun., 29, 1967, 2, S. 229–234; PMID 4383681
- S. Inouye et al.: Cloning and sequence analysis of cDNA for the luminescent protein aequorin. In: Proc Natl Acad Sci USA, 82, 1985, 10, S. 3154–3158; PMID 3858813; pnas.org (PDF; englisch)
- MR. Knight et al.: Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium. In: Nature, 352, 1991, 6335, S. 524–526; PMID 1865907
- J. Nakajima-Shimada et al.: Monitoring of intracellular calcium in Saccharomyces cerevisiae with an apoaequorin cDNA expression system. In: Proc Natl Acad Sci USA, 88, 1991, 15, S. 6878–6882; PMID 1862111; pnas.org (PDF; englisch)
- R. Rizzuto et al.: Rapid changes of mitochondrial Ca2+ revealed by specifically targeted recombinant aequorin. In: Nature, 358, 1992, 6384, S. 325–327; PMID 1322496
- M. Brini et al.: Nuclear Ca2+ concentration measured with specifically targeted recombinant aequorin. In: EMBO J., 12, 1993, 12, S. 4813–4819; PMID 8223490; PMC 413931 (freier Volltext).