Dinoflagellaten
Die Dinoflagellaten (Dinoflagellata; von altgriechisch δῖνος dinos, deutsch ‚wirbelnd‘ und lateinisch flagellum ‚Peitsche‘, ‚Geißel‘), auch als Peridineae und Panzergeißler bezeichnet, sind ein Taxon, das vorwiegend Einzeller umfasst. Zu ihren kennzeichnenden Merkmalen gehören zwei während des mobilen Lebenszyklus vorhandene Flagellen und Chromosomen, die während der Interphase kondensiert sind. Dinoflagellaten haben keine Histone. Weltweit werden rund 2.400 rezente Arten unterschieden (Stand: 2012)[1], die großteils im Meer leben und dabei einen Hauptteil des Phytoplanktons bilden. Der Unterstamm umfasst sowohl autotrophe als auch heterotrophe Arten.
| Dinoflagellaten | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Ceratium sp. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Dinoflagellata | ||||||||||||
| (Bütschli, 1885) Cavalier-Smith, 1991 |
Merkmale
Grundsätzliche Merkmale
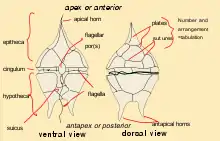
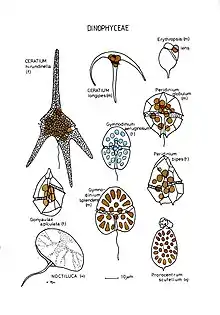
Innerhalb der Dinoflagellaten herrscht eine extrem große Formenvielfalt. Die Größe reicht von 2 µm (Gymnodinium simplex) bis zu 2 mm (Noctiluca miliaris), wobei die meisten Arten zwischen 10 und 100 µm groß werden.
Die Form der freischwimmenden Zelle ist eiförmig bis rundlich, wobei das Anterior meist mehr zugespitzt ist als das Posterior. Die meisten Dinoflagellaten besitzen zwei lange Geißeln. Eine Geißel ist nach hinten gerichtet (longitudinale Geißel), sie liegt im inneren Abschnitt in einer Furche des Zellleibs, ragt aber meist mehr oder weniger lang nach hinten daraus hervor. Die andere Geißel, die in einer Ebene senkrecht dazu schlägt (transversale Geißel), windet sich nach links um den Zellleib, sie liegt meist vollständig innerhalb einer Furche. Die transversale Geißel erlaubt der Zelle Drehungen und trägt am meisten zum Vortrieb bei. Die longitudinale Geißel dient in erster Linie zur Steuerung der Bewegungsrichtung. Diese Anordnung der Geißeln wird als dinokont bezeichnet. Bei den Prorocentrales sitzen, abweichend dazu, beide Geißeln frei am Hinterende der Zelle, dies wird als desmokont bezeichnet. Bei einigen Gattungen treten völlig abweichend gestaltete, zum Teil geißellose Zellen auf.
Bei vielen Arten sind die direkt unterhalb der Zellmembran liegenden Vakuolen mit Zellulose gefüllt und so zu mehr oder weniger massiven Platten verstärkt.[2] Wenn solche intrazellulären Platten vorhanden sind, wird diese Hülle als Theka und die entsprechenden Arten thekat bezeichnet. Wenn die Alveolen nicht oder nur sehr wenig verstärkt sind, werden die Arten athekat oder nackt genannt. Die Theka bildet ein Mosaik aus einzelnen Platten; dieses kann zur Artbestimmung benutzt werden.
Eine Querfurche, das sogenannte Cingulum (Gürtel, en. auch girdle[3]) läuft rund um die Zelle und teilt diese somit in ein Anterior (Episoma) und Posterior (Hyposoma). Ist eine Theka vorhanden, werden die Teile als Epitheka bzw. Hypotheka bezeichnet. Ist keine Theka vorhanden, spricht man von athekaten Dinoflagellaten. Bei morphologischen Beschreibungen dieser Dinoflagellaten werden die Begriffe Epicone und Hypocone anstatt Epi- und Hypotheka verwendet. Nach posterior verläuft ausgehend von der Querfurche eine Längsfurche, der sogenannte Sulcus. Die transversale Geißel schlägt im Cingulum, die longitudinale Geißel im Sulcus.
Geißeln
Die longitudinale Geißel ist meist etwas abgeflacht. Sie trägt gelegentlich einen spärlichen Besatz mit Flimmerhärchen (Mastigonema), der aber auch vollständig fehlen kann. Die transversale Geißel ist innerhalb des furchenartigen Cingulum über eine bandförmige Verbindung längs mit der Zelle verbunden. Sie schlägt mit einer wellenartigen Bewegung. Ihre freie Außenkante ist meist mit Härchen besetzt. Das Cingulum umgibt die Zelle meist nicht kreisförmig, sondern ist etwas spiralig gestaltet, so dass das hintere Ende der transversalen Geißel weiter hinten zu liegen kommt als die Wurzel, die Spirale ist meist relativ flach, kann aber bei einigen Gattungen recht steil sein. Beim Schlag wird die Zelle so in eine Drehbewegung (immer nach links) versetzt.
Amphiesma und Zellskelett
Der äußere Region des Zellkörpers der Dinoflagellaten weist eine Reihe morphologischer Besonderheiten auf. Unterhalb der Zellmembran sitzt ein System von flachen Vakuolen, die als amphiesmale Vesikel oder Alveolen bezeichnet werden, diese haben die Dinoflagellaten mit einer Reihe anderer Einzeller wie den Wimperntierchen (Ciliaten) gemeinsam, mit denen sie, nach diesem Merkmal, im Taxon der Alveolata vereinigt werden. Die äußere Region, die die Vakuolen enthält, wird als Amphiesma oder auch Cortex (Rinde) bezeichnet. Innerhalb der Vesikel wird bei den gepanzerten (thekaten) Dinoflagellaten, in jeweils einem Vesikel immer eine Platte aus Zellulose abgeschieden, die sich letztlich zu einer geschlossenen Hülle verbinden können. Durch die Bildung und Lage innerhalb einer Vakuole liegt die Hülle allerdings innerhalb der Zelle (intrazellulär) und ist also von der Zellmembran umschlossen. Bei wenigen Dinoflagellaten sind die Vakuolen des Amphiesmas ausschließlich mit Flüssigkeit gefüllt. Bei vielen anderen enthalten sie festes Material, dass sich aber nicht zu einem geschlossenen Panzer versteift, diese werden gemeinsam athekat (also: ohne Theka) genannt. Bei den thekaten Dinoflagellaten wird die Anordnung der Platten zur Bestimmung der Gattungen und Arten verwendet, jede Platte hat dazu in einem ausgefeilten System jeweils einen besonderen Namen erhalten. Unterhalb der Vesikel sitzt bei manchen Arten eine zweite, dünne Lage aus Fasern, die Pellicula genannt wird. Sie enthält neben Zellulose das Polymer Sporopollenin. Bei vielen Dinoflagellaten kann der äußere Panzer abgeworfen werden (Ecdysis genannt), die Pellicula bildet dann die äußere Hülle von Cysten genannten Überdauerungsstadien.
Einige basale athekate Dinoflagellaten, zum Beispiel der Gattung Oxyrrhis, besitzen auf der Oberfläche (also extrazellulär) kleine, oft sternförmige Schüppchen aus Zellulose. Andere, wie Dicroerisma und Actinscus besitzen interne Skelettelemente aus Siliciumdioxid. Bei Achradina und Monaster können diese die Zelle körbchenartig einschließen.
Zellkern
Innerhalb der Eukaryoten besitzt der Zellkern der Dinoflagellaten einzigartige Eigenschaften, er wird deshalb mit dem besonderen Ausdruck Dinokaryon belegt. Die DNA ist bei ihnen nicht in Nukleosomen organisiert, deren charakteristische Proteine, die Histone, fehlen fast vollständig. Insgesamt ist der Proteinanteil des Zellkerns weitaus geringer als bei anderen Eukaryoten, meist nur etwa 10 Prozent. Anstelle der Histone werden nur bei ihnen vorkommende, besondere Proteine nachgewiesen, deren Herkunft durch horizontalen Gentransfer aus Viren nachgewiesen werden konnte (dinoflagellate viral nucleoproteins; DVNPs). Während früher angenommen wurde, dass Histone völlig fehlen, wurden inzwischen alle Histonfamilien, wenn auch in geringerem Gehalt und in teilweise stark abweichender Struktur, bei den Dinoflagellaten nachgewiesen, sie haben vermutlich bei ihnen eine besondere Rolle bei der Transkription beibehalten.[4]
Sowohl der DNA-Gehalt der Dinoflagellaten gehört zu den höchsten bei allen Eukaryoten, auch ihr Genom ist ungewöhnlich umfangreich. Die Chromosomen sind auch während der Interphase kondensiert und im Elektronenmikroskop sichtbar. Die Chromosomen bilden eine Girlandenstruktur, wobei die einzelnen Fibrillen nur 2,5 nm im Durchmesser haben. Die übrigen Eukaryoten besitzen Fibrillen mit zehnfachem Durchmesser mit einem zentralen Nucleohistonstrang. Die Struktur der Chromosomen wurde mit Flüssigkristallen verglichen. Der Gehalt an nicht-kodierender DNA der Dinoflagellaten ist außergewöhnlich hoch. Es wird angenommen, dass nur die äußeren, schleifenförmigen Enden der Chromosomen, die aus dem Zellkern nach außen vorragen, kodierende Abschnitte enthalten. Auch die Mitose ist bei ihnen äußerst ungewöhnlich. Die den Nukleus umgebende Membran bleibt während des gesamten Mitosezyklus erhalten. Bei der Teilung bilden sich fingerförmige Einstülpungen, die letztlich den Kern ganz durchdringen und so Torus-artige Strukturen hervorbringen. Die Mitosespindel wird innerhalb des Torus ausgebildet, wobei seine Anheftungsstellen (die Kinetochoren) in der inneren Membran des Torus sitzen. Je nach Verwandtschaftsgruppe werden zwischen einem und fünf (oder sechs) solcher Tunnel durch den Zellkern ausgebildet. Auch während der Interphasen ist der Zellkern, neben der üblichen Kernhülle, durch ein Netzwerk aus Membranen durchzogen, aus denen ie Tunnelstrukturen gebildet werden.[5]
Weiterhin ist nur innerhalb der Dinoflagellaten die modifizierte Base Hydroxymethyluracil (HOMeU) in der DNA nachgewiesen. Mit einem Gesamtanteil von 4–19 % ersetzt sie 12–70 % der Thymin-Basen.[6] Die Chromosomenzahl schwankt zwischen 5 bei Syndinium turbo und 274 bei Ceratium hirundinella.[7]
Chloroplast
Der Chloroplast hat wie der der Euglenida drei Membranen. Im Unterschied zu diesen gleicht er aber nicht dem einer Grünalge, sondern dem einer Rotalge, was auf die Herkunft von einer symbiontischen Rotalge hindeutet.[8]
Nematocysten
Viele Dinoflagellaten besitzen komplexe, der Verteidigung oder dem Beutererwerb dienende Organellen, die Extrusomen, Trichozysten, Mucocysten oder Nematocysten genannt werden (genauso benannt, aber nicht homolog zu den Nematocysten der Nesseltiere). Bei Polykrikos kofoidii wurden die Nematocysten im Detail untersucht. Dinoflagellaten der Gymnodiniales besitzt hapunen-artige Nematocysten, die der räuberischen Ernährung dienen. Sie arbeiten quasi im Tandem mit einem weiteren, Taeniocyste genannten, Organell, mit dem sie einen morphologisch verbundenen Komplex bilden. Die Taeniocysten bilden dabei eine weitere Art von Extrusomen. Die Nematocysten bestehen aus einer quergestreiften Kapsel, die im Zellinneren liegt und durch eine deckelartige Struktur (Operculum) außen aus der Zellhülle hervorragt. Im Inneren der quer gestreiften Kapsel liegt ein aufgerollter Faden, an dessen Vorderende ein verstärkte, stilett-artige Spitze sitzt. Die Nematocysten feuern, indem der Deckel abgeworfen wird und der Faden mit der Spitze, unter hohem Druck, herausgeschleudert wird. Auslösend dafür könnte entweder, wie bei den Nematocysten der Nesseltiere, erhöhter osmotischer Druck sein, oder die Kapselwand wird muskelartig kontrahiert. Bei anderen Dinoflagellaten-Arten sitzt anstelle eines Stiletts eine hohle nadelartige Spitze an, die in Art einen Injektionsnadel ein Toxin appliziert. Bei Nematodinium sitzt innerhalb der Kapsel noch ein Ring von Unterkapseln, die den Vortrieb des Stiletts weiter verstärken. Die Nematocysten der Dinoflagellaten gehören zu den komplexesten Organellen überhaupt.[9]
Biolumineszenz

Einige Arten sind zur Biolumineszenz fähig, wobei dieses Leuchten eine Reaktion auf mechanische Stimulation ist. In der Natur sind dies Deformationen der Zellmembran, die durch Scherkräfte hervorgerufen werden. Stark aufgewühltes Wasser, wie brechende Wellen oder schnell schwimmende Fische können solche Stimulationen auslösen. Im Labor kann auch mittels Chemikalien eine Reaktion induziert werden. Zu den Dinoflagellaten gehören die einzigen biolumineszenten autotrophen Lebewesen wie etwa Vertreter der Gattungen Gonyaulax, Protogonyaulax, Pyrodinium und Pyrocystis. Auch bei heterotrophen Arten wie Noctiluca miliaris oder einigen Vertretern der Gattungen Ceratium kann Biolumineszenz beobachtet werden.
Das emittierte Licht ist blau-grün und hat ein Maximum bei 474–476 nm. Da diese Wellenlänge nahe dem maximalen Transmissionsgrad des Meerwassers liegt, wird angenommen, dass die Sichtbarkeit des Lichtes den selektiven Vorteil verursacht. In Experimenten mit leuchtenden und nicht-leuchtenden Spezies konnte gezeigt werden, dass im Falle von Biolumineszenz die Prädation vermindert wurde. Vermutlich werden Feinde durch den Lichtblitz abgeschreckt. Wie bei fast allen Arten der Biolumineszenz ist dies auf eine Reaktion von Luciferasen und Luciferinen zurückzuführen.
Toxine
Einige Arten produzieren äußerst starke Gifte. Das Saxitoxin beispielsweise wird von Vertretern der Gattung Alexandrium (Gonyaulax) produziert. Wenn die giftigen Dinoflagellaten von Muscheln gefressen werden, reichert sich das Gift in den Muscheln an und kann dann auch für Menschen gefährlich werden. Bei einer Massenvermehrung von giftigen Arten wird soviel Gift produziert, dass auch Fische und andere Meereslebewesen getötet werden.[10] Karenia brevis produziert die Brevetoxine und kann bei den von ihnen erzeugten „Roten Tiden“ zu Massensterben bei Fischen, Vögeln und Säugern führen.
Die Krankheit Ciguatera,[11] eine Art Fischvergiftung, wird durch Stoffwechselprodukte der Art Gambierdiscus toxicus hervorgerufen. Über die Nahrungskette gelangen die Dinoflagellaten-Toxine Ciguatoxin und Maitotoxin in Fische, die dadurch ebenfalls stark giftig werden. Die Vergiftung kann unter Umständen beim Menschen tödlich verlaufen.
Das Toxin von Pfiesteria piscicida dagegen wird nicht über die Nahrungskette angereichert, sondern ist direkt giftig für Fische und Menschen.[12]
Verbreitung und Lebensräume
Dinoflagellaten sind kosmopolitisch im Salz- wie auch im Süßwasser verbreitet und können dort aufgrund ihres Formenreichtums viele Habitate besiedeln. Rund 75 % aller Arten werden dem marinen Plankton zugerechnet,[1] mit der größten Artenvielfalt in tropischen Gewässern. Sie sind aber auch benthische Lebewesen und dringen auch in die Sedimente ein. Darüber hinaus sind sie ebenfalls in der Polarregion und in Meereis anzutreffen.
Im Süßwasser sind weniger Arten verbreitet. Weltweit sind 420 Arten aus Binnengewässern bekannt (etwa 17 Prozent der Artenzahl),[1] die Seen, Tümpel und Moore besiedeln. Das Verbreitungsgebiet reicht etwa vom Äquator bis 78° nördlicher Breite (Insel Spitzbergen). Die Höhenunterschiede reichen von −209 Meter in Israel bis auf 4150 Meter in Hochgebirgsseen von Mexiko.
Da einige Arten Symbiosen eingehen oder als Parasiten leben, werden auch Lebewesen als Habitate genutzt. Beispielsweise leben Dinoflagellaten als Endosymbionten in vielen Korallen und werden dann als Zooxanthellen bezeichnet. Autotrophe Arten sind auf lichtdurchflutete Wasserschichten angewiesen, heterotrophe Arten können auch in vollkommen dunkle Tiefen vordringen.
Ernährung
Etwa die Hälfte der Dinoflagellaten ist autotroph und kann mit Hilfe der Assimilation der Chloroplasten anorganischen Kohlenstoff nutzen. Jedoch sind fast sämtliche photosynthetisch aktive Arten auxotroph und benötigen Vitamine (Cobalamine, Biotin, Thiamin) für katalytische Zwecke. Diese werden über Phagocytose aufgenommen. Autotrophe Arten gehen auch eine Symbiose mit Nesseltieren (Cnidaria), insbesondere Korallen, Weichtieren (Mollusca) aber auch Foraminiferen (Foraminifera) und Wimpertierchen (Ciliata), ein.
Heterotrophe Dinoflagellaten ernähren sich von einem vielfältigen Spektrum von Planktonorganismen, das von Nanoplankton bis zu großen Kieselalgen reicht.[13][14] Darunter fallen auch Dinoflagellaten der eigenen wie auch anderer Arten, Detritus und selbst Eier und Larven von Ruderfußkrebsen. Im einfachsten Fall wird die Nahrung durch Phagocytose aufgenommen (beispielsweise Noctiluca miliaris). Durch spezielle Zellstrukturen wie Pedunkel oder Pallium können sich heterotrophe Dinoflagellaten aber auch von Organismen ernähren, die um ein Vielfaches größer als sie selbst sind (beispielsweise Pfiesteria[15] oder Protoperidinium).[13][14]
Autotrophie
Die autotrophen Arten enthalten Plastiden mit Chlorophyll a bzw. einige Arten auch Chlorophyll c. Als Haupt-Carotinoid enthalten sie meist Peridinin anstatt von Fucoxanthin. Ihre Färbung reicht von gelbbraun bis rötlich, da das Chlorophyll von braunen und gelben Carotinoiden und roten Xanthophyllen überdeckt wird. Stärke ist das Hauptassimilationsprodukt, das in Körnchen außerhalb der Chloroplasten gespeichert wird. Es wurden aber auch fettartige Stoffe nachgewiesen. Die Plastiden sind meist mit drei Membranen umgeben, von denen eine mit dem endoplasmatischen Retikulum verbunden ist.
Grundsätzlich können Dinoflagellaten sehr verschiedene Plastiden beherbergen, die vom Grundtyp abweichen. Dies ist auf Phagotrophie zurückzuführen, die auch bei autotrophen Arten aufrechterhalten wird. Dies führte in der Stammesgeschichte zu einer weiteren, tertiären Endocytobiose. Die aufgenommenen Organismen können hierbei aus unterschiedlichen Gruppen, wie Haptophyta, Cryptophyceae, Heterokontophyta oder eines Chlorophyten zurückgehen. Der ursprünglich von den Rotalgen stammende Chloroplast ist hierbei völlig oder weitgehend zurückgebildet und erscheint im letzteren Fall als inaktiver Augenfleck (Stigma). Gelegentlich ist in den Chloroplasten auch ein Nucleomorph enthalten.
Grundtypen der Heterotrophie
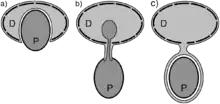
Die Fraßmechanismen heterotropher Dinoflagellaten lassen sich mit drei Grundtypen beschreiben.
- Phagozytose: Die Beute wird durch den Sulcus direkt und vollständig aufgenommen und in eine Fraßvakuole eingeschlossen (beispielsweise Noctiluca miliaris).
- Myzozytose: Vom Sulcus aus wird ein charakteristischer Plasmastrang ausgestülpt. Dieser Pedunkel durchstößt die Zellhülle der Beute, und saugt den Zellinhalt in eine Fraßvakuole. Die Zellbestandteile der Beute werden dabei nicht sofort verdaut. Chloroplasten beispielsweise können erhalten bleiben und so als Kleptoplastiden im Dinoflagellaten weiter funktionieren (beispielsweise Dinophysis[16]) Die Zellhülle der Beute wird nicht in die Vakuole eingeschlossen.
- Pallium: Vom Sulcus aus wird ein schlauch- oder segelförmiges Pseudopodium ausgestülpt, dass die Beute mit einer dünnen Lage Zellplasma umgibt und so eine Fraßvakuole bildet. Da diese Vakuole außerhalb der Theka gebildet wird, ist die Größe des Palliums und damit die Größe der Beute nicht von der Größe des Dinoflagellaten begrenzt, so dass auch eine um ein Vielfaches größere Beute verdaut werden kann (beispielsweise Protoperidinium.[17]) Im Pallium wird die Beute verdaut und in verflüssigter Form aufgenommen.
Die Grundtypen Myzozytose und Pallium kommen hauptsächlich bei thekaten (gepanzerten) Arten vor und werden gelegentlich als extrazelluläre Verdauung bezeichnet. Dies stimmt genau betrachtet nicht, denn in jedem Fall wird die Beute in einer Fraßvakuole innerhalb des Zellplasmas verdaut, jedoch können sich diese Fraßvakuolen außerhalb der Theka befinden. Dies kann als Überwindung der Beschränkungen durch die Theka interpretiert werden und eröffnete den heterotrophen Arten ein erweitertes Beutespektrum.
Beutefang
Der untypische Dinoflagellat Noctiluca miliaris besitzt einen kurzen Tentakel, der wie eine Leimrute eingesetzt wird. Nahrungspartikel wie Kieselalgen und Detritus bleiben daran hängen und werden dann vom Tentakel zum Cytostom befördert.
Der thekate Dinoflagellat Stoeckeria algicida dagegen nutzt ein schlagartig ausgestoßenes Proteinfilament (englisch: tow filament), um die Beute über eine vergleichsweise große Entfernung einzufangen.[18] Ein vergleichbares Filament wird von Protoperidinium benutzt, um sich an Kieselalgen-Ketten zu verankern.[13]
Fortpflanzung
Die Fortpflanzung erfolgt überwiegend vegetativ. Bei bepanzerten Arten werden die Platten in der Regel schräg zum Gürtel gesprengt, wobei die fehlende Hälfte später nachwächst. Es besteht aber auch die Möglichkeit, dass der Panzer abgeworfen und von den Tochterzellen völlig neu gebildet wird. Unter ungünstigen Lebensbedingungen entstehen dickwandige, überdauerungsfähige Zysten.
Geschlechtliche Fortpflanzung wurde nur bei wenigen Arten nachgewiesen. Hierbei wurden Anisogamie mit zygotischem Kernphasenwechsel als auch Isogameten, die in Gametangien entstehen, freigesetzt werden und miteinander verschmelzen, beschrieben.
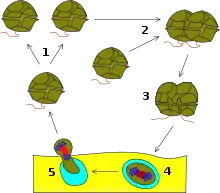
1 – Binäre Fissiparie, 2 – Sexuelle Reproduktion, 3 – Planozygote, 4 – Hypnozygote, 5 – Planomeiocyte.
Ökologische Bedeutung
Zusammen mit den Kieselalgen sind die Dinoflagellaten die Hauptprimärproduzenten organischer Stoffe im Meer, bilden dort also zusammen mit den Kieselalgen den Hauptteil der Basis der Nahrungspyramide. In Hochgebirgsseen können sie bis zu 50 % der Biomasse ausmachen.
Die heterotrophen Dinoflagellaten können mit ihren spezialisierten Fraßmechanismen ein weites Spektrum von Beuteorganismen fressen, das von Nanoplankton kleiner als 10 µm bis zu großen kettenbildenden Kieselalgen reicht. Dadurch stellen die heterotrophen Dinoflagellaten einen wichtigen Teil der mikrobiellen Schleife[19] dar (englisch microbial loop[20]).
Unter für sie günstigen Bedingungen vermehren sich in tropischen und subtropischen Gewässern bestimmte Arten in extremem Ausmaß, so dass sich die oberen Schichten des Meeres rot bis braun färben. Man nennt diese Algenblüte auch Rote Flut oder Rote Tide (englisch red tide).
Biostratigraphie
Durch ihre sehr widerstandsfähige, organische Zellwand werden Dinoflagellatenzysten nicht durch Kalklösung zerstört, sondern bleiben auch nach langen Zeiträumen erhalten. Außerdem haben viele Zysten eine charakteristische Form. Das spielt für die Altersdatierung (Biostratigraphie) von Sedimenten eine entscheidende Rolle.
Andere Fossilgruppen wie Foraminiferen besitzen eine zu geringe Artenvielfalt und Dinoflagellatenzysten treten nahezu in allen Gewässern auf, wo sie heute als Klimaindikatoren verwendet werden. Erst 1988 begann man in Deutschland mit der Aufstellung von „Dinoflagellaten-Zonen“, die nun regelmäßig verbessert werden.
Systematik
Durch die teilweise sehr komplexen Lebenszyklen der Dinoflagellaten ist die systematische Gliederung Gegenstand wissenschaftlicher Diskussion. Das Taxon gilt als polyphyletisch. Die hier angeführte Gliederung (Gattungen exemplarisch) folgt im Wesentlichen Adl et al. 2012:[21]
- Dinophyceae
- Dinophysales Lindemann 1928
- Dinophysiphycidae (Dinophysaceae Stein 1883 [Citharistaceae Kofoid & Skogsberg 1928; Ornithocercaceae Kofoid & Skogsberg 1928])
- Gonyaulacales F.J.R.Taylor 1980 [Pyrocystales Apstein 1909]
- Gonyaulacaceae Er.Lindemann 1928
- Gonyaulax Diesing, 1866
- Gymnodiniales Lemmermann 1910
- Gymnodiniphycidae (Gymnodiniaceae (Bergh 1881a) Lankester 1885 [Polykrikaceae Kofoid & Swezy 1921])
- Gymnodinium Stein, 1878
- Noctilucales Haeckel, 1894
- Noctilucaceae Kent, 1881
- Noctiluca 1836
- Noctiluca scintillans (Macartney) Kofoid & Swezy, 1921 (syn. Noctiluca miliaris Suriray, nomen invalidum)
- Peridiniales Haeckel 1894
- Heterocapsaceae Fensome et al. 1993 [Heterocapsineae Fensome et al. 1993]
-
- Heterocapsa circularisquama Horiguchi 1995
- Heterodiniaceae Lindemann 1928
- Peridiniphycidae [Peridiniaceae] Ehrenberg, 1831
- Ceratium Schrank, 1793
- Peridiniella
- Peridiniella danica (Paulsen) Okolodkov & Dodge, 1995
- Peridinium Ehrenberg, 1830
- Pfiesteria K. A. Steidinger & J. M. Burkholder
- Pfiesteria piscicida Steidinger & J. M. Burkholder, 1996
- Pseudopfiesteria shumwayae [syn. Pfiesteria shumwayae] Glasgow & J. M. Burkholder, 2001
- Phytodiniales
- Prorocentrales
- Prorocentraceae
- Prorocentrum Ehrenberg, 1834
Belege
Soweit nicht unter Einzelnachweisen angegeben, basiert der Artikel auf folgenden Unterlagen:
- C. Körner, G. Neuhaus, U. Sonnewald, J. W. Kadereit, A. Bresinsky, C. Körner: Lehrbuch der Botanik für Hochschulen. Begründet v. E. Strasburger. Spektrum Akademischer Verlag, Heidelberg 362008, ISBN 978-3-8274-1455-7.
- Taylor: The Biology of dinoflagellates. Blackwell, 1987, ISBN 0-632-00915-2.
- Ettl (Hrsg.): Süßwasserflora von Mitteleuropa: Dinophyceae. Gustav Fischer, Jena 1990, ISBN 3-334-00247-0.
Literatur
- Stefan Nehring: Dinoflagellaten-Dauercysten in deutschen Küstengewässern : Vorkommen, Verbreitung und Bedeutung als Rekrutierungspotential (= Christian-Albrechts-Universität zu Kiel. Institut für Meereskunde: Berichte aus dem Institut für Meereskunde, Nr. 259). Institut für Meereskunde, Abteilung Marine Planktologie, Kiel 1994, DNB 943792797 (Dissertation Universität Kiel [1994], 231 Seiten).
Weblinks
- Dinoflagellaten (Uni Hamburg)
- Video: Biolumineszenz und Tagesrhythmik bei Dinoflagellaten. Institut für den Wissenschaftlichen Film (IWF) 1999, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-2013.
Einzelnachweise
- Fernando Gómez (2012): A quantitative review of the lifestyle, habitat and trophic diversity of dinoflagellates (Dinoflagellata, Alveolata). Systematics and Biodiversity 10 (3): 267–275. doi:10.1080/14772000.2012.721021
- Loeblich, Alfred R. & Loeblich, Laurel A. (1985).Dinoflagellates: Structure of the amphiesma and re-analysis of thecal plate patterns. Hydrobiologia, Band 123, Nr. 2, S. 177–179. (Abstract und Volltext).
- Nordic Microalgae: (Pouchet) J.Schiller, 1933
- Georgi K. Marinov & Michael Lynch (2016): Diversity and Divergence of Dinoflagellate Histone Proteins. G3 Genes Genomes Genetics, Band 6, S. 397-422. doi:10.1534/g3.115.023275.
- Gregory S. Gavelis, Maria Herranz, Kevin C. Wakeman, Christina Ripken, Satoshi Mitarai, Gillian H. Gile, Patrick J. Keeling, Brian S. Leander (2019): Dinoflagellate nucleus contains an extensive endomembrane network, the nuclear net. Scientific Reports Band 9, Nr. 839. doi:10.1038/s41598-018-37065-w
- Taylor: The Biology of dinoflagellates. Blackwell, 1987, ISBN 0-632-00915-2, S. 160.
- Taylor: The Biology of dinoflagellates. Blackwell, 1987, ISBN 0-632-00915-2, S. 618.
- Robert Edward Lee: Phycology, 5. Aufl., Cambridge 2018. S. 231.
- Gregory S. Gavelis, Kevin C. Wakeman, Urban Tillmann, Christina Ripken, Satoshi Mitarai, Maria Herranz, Suat Özbek, Thomas Holstein, Patrick J. Keeling, Brian S. Leander (2017): Microbial arms race: Ballistic “nematocysts” in dinoflagellates represent a new extreme in organelle complexity. Science Advances 3 (3): e1602552. doi:10.1126/sciadv.1602552
- J. H. Landsberg (2002). The effects of harmful algal blooms on aquatic organisms. Reviews in Fisheries Science, 10(2): 113–390.
- A. Swift, T. Swift (1993). Ciguatera. In: J Toxicol Clin Toxicol. 31: 1–29. (Abstract).
- P. D. Moeller, K. R. Beauchesne, K. M. Huncik, W. C. Davis, S. J. Christopher, P. Riggs-Gelasco, A. K. Gelasco (2007). Metal complexes and free radical toxins produced by Pfiesteria piscicida. Environ. Sci. Technol. 41 (4): 1166–1172. doi:10.1021/es0617993
- E. Schnepf und M. Elbrächter: Nutritional strategies in dinoflagellates. Europ. J. Phycology, 1992, Vol. 28: 3–24.
- Vgl. J. Hansen und A. J. Calado: Phagotrophic mechanisms and prey selection in free- living dinoflagellates. Journal of Eukaryotic Microbiology, 1999, Vol. 46, No. 4: 382–389. doi:10.1111/j.1550-7408.1999.tb04617.x.
- A. Gordon und B. Dyer: Relative contribution of exotoxin and micropredation to icthyotoxicity of two strains of Pfiesteria shumwayae (Dinophyceae) Harmful algae. 2005, Vol. 4, No. 2: 423–431.
- Kiyotaka Takishitaa, Kazuhiko Koikeb, Tadashi Maruyamaa und Takehiko Ogatab: Molecular Evidence for Plastid Robbery (Kleptoplastidy) in Dinophysis, a Dinoflagellate causing Diarrhetic Shellfish Poisoning. Protist, 2002, Vol. 153, 293–302. PMID 12389818.
- G. Gaines, F. J. R. Taylor: Extracellular digestion in marine dinoflagellates. Journal of Plankton Research, 1984, Vol. 6, No. 6: 1057–1061.
- Hae Jin Jeong, Jae Seong Kim, Jong Hyeok Kim, Seong Taek Kim, Kyeong Ah Seong, Tae Hoon Kim, Jae Yoon Song, Soo Kyeum Kim (2005). Feeding and grazing impact of the newly described heterotrophic dinoflagellate Stoeckeria algicida on the harmful alga Heterosigma akashiwo. Mar Ecol Prog Ser, Vol. 295: 69–78.
- Naustvoll, Lars J. (2001). The role of heterotrophic dinoflagellates in marine pelagic food webs. Dissertation, University of Oslo.
- S. D. Azam, T. Fenchel, J. G. Field, J. S. Gray, L. A. Meyer-Reil, F. Thingstad: The ecological role of water- column microbes in the sea. Marine Ecology Progress Series, 1983, Vol. 10: 257–263. (Volltext; PDF; 3,8 MB).
- S. M. Adl, A. G. B. Simpson, C. E. Lane, J. Lukeš, D. Bass, S. S. Bowser, M. W. Brown, F. Burki, M. Dunthorn, V. Hampl, A. Heiss, M. Hoppenrath, E. Lara, L. le Gall, D. H. Lynn, H. McManus, E. A. D. Mitchell, S. E. Mozley-Stanridge, L. W. Parfrey, J. Pawlowski, S. Rueckert, L. Shadwick, C. L. Schoch, A. Smirnov und F. W. Spiegel: The Revised Classification of Eukaryotes. Journal of Eukaryotic Microbiology. 59, 2012, S. 429–514, PDF Online.