Genome Editing
Genome Editing oder Genomchirurgie[1], deutsch häufig Genom-Editierung,[2] ist ein Sammelbegriff für molekularbiologische Techniken zur zielgerichteten Veränderung von DNA, einschließlich des Erbguts von Pflanzen, Tieren und Menschen.[3]
Wirkungsweise
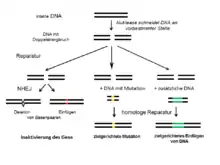
Zum Einführen zielgerichteter Veränderungen im Erbgut von komplexen Organismen werden sogenannte Designer-Endonukleasen eingesetzt.[4] Diese Enzyme schneiden doppelsträngige DNA an einer vorbestimmten Zielsequenz, wodurch Doppelstrangbrüche entstehen.[5] Die Doppelstrangbrüche wiederum aktivieren DNA-Reparatur-Prozesse in der Zelle, wie das Non-homologous end-joining (NHEJ) oder die Homologe Reparatur, die auch als homology directed repair (HDR) bezeichnet wird. Während mittels NHEJ Gene gezielt inaktiviert werden, kann die HDR zum gezielten Einfügen definierter Mutationen oder ganzer DNA-Abschnitte ins Genom herangezogen werden.
Die Zeitschrift Nature Methods kürte das Genome Editing 2011 zur Methode des Jahres.[6]
Enzyme
Zu den häufig verwendeten Klassen von Designer-Nukleasen zählen Zinkfingernukleasen (ZFN), Transcription Activator-like Effector Nucleases (TALENs), die CRISPR/Cas-Methode, das CRISPR/Cpf1-System und Meganukleasen (modifizierte Homing-Endonukleasen).[7][8][9] Die spezifische Erkennung der DNA erfolgt bei der Zinkfingernuklease, der TALEN und der Meganuklease durch einen bestimmten Proteinteil, während sie bei den CRISPR-Systemen durch eine spezifische RNA vermittelt wird.
Anwendungen
Genome Editing wird für gezielte Veränderungen des Genoms von Mikroorganismen (weiße Gentechnik),[10] Pflanzen (grüne Gentechnik),[11] Tieren (rote Gentechnik)[12] und beim Menschen (Gentherapie)[13] eingesetzt. Das Genome Editing kann zum gezielten Zerstören eines Gens (Gen-Knockout), zum Einführen eines Gens an einer spezifischen Stelle im Genom (Gen-Knockin) oder zur Korrektur einer Punktmutation in einem Gen verwendet werden.[3]
Base Editing
Eine neue präzise Methode des Genome Editing besteht darin, einzelne Basen in der DNA-Sequenz zu verändern (Base Editing).[14] Hierbei wird eine mutierte Form der Cas9-Nuklease, die die DNA nicht mehr schneiden kann, mit einer Deaminase gekoppelt. Dieses Fusionsprotein ist in der Lage, mit der sgRNA eine gewünschte DNA-Sequenz spezifisch zu erkennen und verändert durch Desaminierung eine Base. Im Falle der Fusion mit Cytidin-Deaminase wird das Cytidin in Uracil umgewandelt, das durch DNA-Reparatur und Replikation mit Thymidin ersetzt wird. Dadurch wird das Basenpaar C-G zu T-A mutiert.[15] Alternativ kann Cas9 mit einer Adenosin-Deaminase gekoppelt werden, so dass das Adenosin in Inosin umgewandelt wird, das nach DNA-Reparatur und Replikation mit Guanosin ersetzt wird. In diesem Fall wird das Basenpaar A-T zu G-C umgewandelt.[16] Die Effizienz des Base Editing liegt zwischen 5 % und 50 %. Da die DNA nicht geschnitten wird, sind unerwünschte Veränderungen weniger häufig.[17] Alle 12 möglichen Punktmutationen sind mit Prime Editing möglich.[18] 2020 gelang es Forschern erstmals, die Gene von Mitochondrien zu bearbeiten. Sie erstellten dazu einen neuartigen CRISPR-freien Base-Editor „DdCBE“ auf Basis eines Bakteriengifts.[19][20]
Regulatorische Aspekte
Zurzeit besteht keine einheitliche Meinung, ob Genom-editierte Organismen wie gentechnisch veränderte Organismen (GVO) einzustufen und somit die für GVO geltenden Richtlinien anzuwenden sind. Der Zusammenschluss nationaler Wissenschaftsakademien von Mitgliedsstaaten der Europäischen Union (EASAC) weist darauf hin, dass die Regulation des Genome Editing nicht die Technik als solches erfassen soll, sondern die spezifischen Anwendungen in den einzelnen Fachgebieten.[21] Zur Zeit stehen die möglichen Anwendungen in der Landwirtschaft, aber auch der denkbare Einsatz in der Medizin im Vordergrund.
Pflanzenzucht
Experten aus verschiedenen Ländern haben vorgeschlagen, dass Genom-editierte Pflanzen, sofern sie keine Fremd-DNA enthalten, Pflanzen aus konventioneller Züchtung gleichzustellen sind.[22] Diese Meinung berücksichtigt die Tatsache, dass sich Genom-editierte Pflanzen häufig nicht von konventionell gezüchteten Pflanzen unterscheiden und sie sich auch durch herkömmliche Methoden züchten lassen.[23]
Ein Urteil des Europäischen Gerichtshofs (EuGH) vom 25. Juli 2018 setzt Genom-editierte Pflanzen gentechnisch veränderten Organismen (GVO) gleich. Der Gerichtshof argumentiert, dass durch Genome Editing eine auf natürliche Weise nicht mögliche Veränderung am genetischen Material einer Pflanze vorgenommen werde. Er hält fest, dass Genome Editing nicht der konventionellen Mutagenese gleichzusetzen sei, die von den der Regulierung ausgenommen ist, da diese seit Jahrzehnten in der konventionellen Pflanzenzüchtung eingesetzt werde.[24] Diese Beurteilung wird von Wissenschaftlern kritisiert, die darauf hinweisen, dass durch Genome Editing eine wesentlich präzisere Veränderung des Genoms erfolgt als dies bei Mutationszüchtung der Fall ist, bei der durch ionisierende Strahlung oder Genotoxine ziellos Gene verändert werden.[25] Die Zentrale Kommission für die Biologische Sicherheit (ZKBS) sieht keine naturwissenschaftliche Grundlage für die enge Auslegung der GVO-Richtlinie durch den EuGH im Hinblick auf das Genome Editing.[26] In einer Stellungnahme zum EuGH-Urteil weist der Bioökonomierat darauf hin, dass alle Produkte, die mit den neuen Verfahren hergestellt werden, eine sehr aufwendige und teure Zulassungsprozedur durchlaufen müssen. Er plädiert für ein risikobasiertes Genehmigungs- und Zulassungsverfahren.[27] Die Kritik am EuGH-Urteil widerspiegelt die fundamentale Kontroverse über die Gentechnik im Allgemeinen.[28][29]
In den USA sind eine Reihe von Genom-editierte Pflanzen ohne Auflagen durch deren Landwirtschaftsministerium für den kommerziellen Anbau freigegeben worden. Hierbei kann eine Firma vor der Entwicklung der entsprechenden Pflanze beim Ministerium abklären, ob eine Regulation notwendig ist oder nicht. Diese Vorabfrage beschleunigt die Entwicklung neuer Pflanzen wesentlich.[30] Ähnliche Bestimmungen gelten unter anderem in Argentinien, Australien, Brasilien und Japan.[31]
Die international unterschiedlichen Zulassungsvorschriften für Genom-editierte Pflanzen stellen für die Überwachungsbehörden ein kaum lösbares Problem dar, da ohne Vorkenntnisse der genetischen Veränderungen eine Kontrolle importierter Lebensmittel sehr aufwendig ist. In konkreten Fällen wird es nicht möglich sein, zu entscheiden, ob eine Mutation durch Genome Editing oder spontan entstanden ist.[32]
Eine Arbeitsgruppe berichtet im Jahr 2020, dass es ihr gelungen sei, mit PCR eine genomeditierte herbizidresistente Rapslinie spezifisch nachzuweisen.[33] Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) weist darauf hin, dass mit der Methode die Punktmutation nachweisbar ist, dass es aber nicht möglich ist, zu entscheiden, ob die Mutation durch Genome Editing oder durch traditionelle Züchtungsmethoden hergestellt wurde. In der Tat scheint die mit PCR untersuchte Rapslinie durch eine spontane Mutation entstanden zu sein.[34]
Therapie beim Menschen
Die Anwendung des Genome Editing beim Menschen durch die Arbeiten des chinesischen Wissenschaftlers He Jiankui im November 2018 hat Kritik ausgelöst. Er hat nach eigenen Angaben den CCR5-Rezeptor bei mehreren menschlichen Embryonen deaktiviert, um so die dann geborenen Kinder immun gegen HIV zu machen[35][36]. Das Vorgehen des chinesischen Forschers widerspricht nach [37] sowohl den internationalen als auch den chinesischen ethischen Richtlinien. Nach [38] sei ein internationales Gremium nötig, um bindende Vorschriften zu erlassen. Die Technik sei noch nicht ausgereift und es gäbe Alternativen wie die Präimplantationsdiagnostik, als dass man in jedem Falle zu dieser Methode greifen könne. Es gäbe jedoch auch die Auffassung, dass das Verfahren begrenzt sei und dass es wichtige medizinische Erfordernisse gäbe, die anders nicht zu erreichen seien.
Literatur
- S. Chandrasegaran, D. Carroll: Origins of Programmable Nucleases for Genome Engineering. In: Journal of Molecular Biology. Band 428, Nr. 5, 2016, ISSN 0022-2836, S. 963–989, doi:10.1016/j.jmb.2015.10.014, PMID 26506267 (sciencedirect.com – elektronische Veröffentlichung vor dem Druck).
Weblinks
- E-TALEN.org Genome Editing durch TALENs oder CRISPR
- Forschungsstelle Ethik der Genom-Editierung (Universität Tübingen)
- Publikationen des Deutschen Ethikrates zu 'Genomforschung' (Deutscher Ethikrat)
- Verbrauchervotum – Ergebnis der BfR-Verbraucherkonferenz „Genome Editing im Bereich Ernährung und menschliche Gesundheit“ 2019 vom Bundesinstitut für Risikobewertung (BfR)
- Base Editor: Powerful DNA Manipulation: Improved Gene Editing With New Understanding of CRISPR-Cas9 Tool, auf: SciTechDaily vom 1. August 2020, Quelle: University of California – Berkeley
Einzelnachweise
- BBAW: Genomchirurgie beim Menschen. (PDF) S. 10, abgerufen am 2. November 2018.
- siehe etwa Genom-Editierung: Patentstreit um Crispr ist entschieden
- J. Lee et al.: Designed nucleases for targeted genome editing. In: Plant Biotechnology Journal. Band 14, Nr. 2. Wiley, 2016, ISSN 1467-7652, S. 448–462, doi:10.1111/pbi.12465 (wiley.com).
- Christien Bednarski, Toni Cathomen: Maßgeschneidertes Genom — Designer-Nukleasen im Einsatz. In: BIOspektrum. Band 21, Nr. 1, 2015, ISSN 1868-6249, S. 22–24, doi:10.1007/s12268-015-0528-4.
- Royce Wilkinson, Blake Wiedenheft: A CRISPR method for genome engineering. In: F1000Prime Rep. Band 6, Nr. 3, 2014, S. 3, doi:10.12703/P6-3, PMID 24592315, PMC 3883426 (freier Volltext) – (facultyopinions.com).
- Method of the Year 2011. In: Nature Methods. Band 9, Nr. 1, Januar 2012, ISSN 1548-7105, S. 1, doi:10.1038/nmeth.1852, PMID 22312634 (nih.gov).
- K. M. Esvelt, H. H. Wang: Genome-scale engineering for systems and synthetic biology. In: Mol Syst Biol. Band 9, Nr. 1, 2013, S. 641, doi:10.1038/msb.2012.66, PMID 23340847, PMC 3564264 (freier Volltext).
- W. S. Tan, D. F. Carlson, M. W. Walton, S. C. Fahrenkrug, P. B. Hackett: Precision editing of large animal genomes. In: Adv Genet. Band 80, 2012, S. 37–97, doi:10.1016/B978-0-12-404742-6.00002-8, PMID 23084873, PMC 3683964 (freier Volltext).
- H. Puchta, F. Fauser: Gene targeting in plants: 25 years later. In: Int. J. Dev. Biol. Band 57, 2013, S. 629–637, doi:10.1387/ijdb.130194hp.
- Timothy R. Sampson, David S. Weiss: Exploiting CRISPR/Cas systems for biotechnology. In: BioEssays. Band 36, Nr. 1, 2014, ISSN 1521-1878, S. 34–38, doi:10.1002/bies.201300135, PMID 24323919 (wiley.com).
- Daniel F. Voytas, Caixia Gao: Precision Genome Engineering and Agriculture: Opportunities and Regulatory Challenges. In: PLOS Biology. Band 12, Nr. 6, 2014, ISSN 1545-7885, S. e1001877, doi:10.1371/journal.pbio.1001877, PMID 24915127 (plos.org).
- Götz Laible, Jingwei Wei, Stefan Wagner: Improving livestock for agriculture – technological progress from random transgenesis to precision genome editing heralds a new era. In: Biotechnology Journal. Band 10, Nr. 1, 2015, ISSN 1860-7314, S. 109–112, doi:10.1002/biot.201400193 (wiley.com).
- David Benjamin Turitz Cox, Randall Jeffrey Platt, Feng Zhang: Therapeutic genome editing: prospects and challenges. In: Nature Medicine. Band 21, Nr. 2, 2015, ISSN 1546-170X, S. 121–131, doi:10.1038/nm.3793, PMID 25654603 (nature.com).
- Williams. R.: "Better Base Editing in Plants, The Scientist, February 2019". S. 23, abgerufen am 10. Februar 2019.
- Andrew May: Base editing on the rise. In: Nature Biotechnology. Band 35, Nr. 5, 2017, ISSN 1546-1696, S. 428–429, doi:10.1038/nbt.3871 (nature.com).
- Nicole M. Gaudelli, et al.: Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage. In: Nature. Band 551, Nr. 7681, 2017, ISSN 1476-4687, S. 464–471, doi:10.1038/nature24644, PMID 29160308 (nature.com).
- Jin-Soo Kim: Precision genome engineering through adenine and cytosine base editing. In: Nature Plants. Band 4, Nr. 3, 2018, ISSN 2055-0278, S. 148–151, doi:10.1038/s41477-018-0115-z (nature.com).
- Md Mahmudul Hassan, et al.: Prime Editing Technology and Its Prospects for Future Applications in Plant Biology Research. In: sciencemag.org. BioDesign Research, 2020, S. 1–14, abgerufen am 7. Oktober 2020 (englisch, doi:10.34133/2020/9350905).
- The powerhouses inside cells have been gene-edited for the first time. In: New Scientist, 8. Juli 2020. Abgerufen am 12. Juli 2020.
- Beverly Y. Mok, Marcos H. de Moraes, Jun Zeng, Dustin E. Bosch, Anna V. Kotrys, Aditya Raguram, FoSheng Hsu, Matthew C. Radey, S. Brook Peterson, Vamsi K. Mootha, Joseph D. Mougous, David R. Liu: A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. In: Nature. 583, Nr. 7817, Juli 2020, ISSN 1476-4687, S. 631–637. doi:10.1038/s41586-020-2477-4. PMID 32641830. PMC 7381381 (freier Volltext).
- Robin Fears, Volker ter Meulen: How should the applications of genome editing be assessed and regulated? In: eLife. Band 6, 2017, ISSN 2050-084X, S. e26295, doi:10.7554/eLife.26295, PMID 28375079.
- Sanwen Huang, et al.: A proposed regulatory framework for genome-edited crops. In: Nature Genetics. Band 48, Nr. 2, 2016, ISSN 1546-1718, S. 109–111, doi:10.1038/ng.3484 (nature.com).
- Lutz Grohmann, et al.: Detection and Identification of Genome Editing in Plants: Challenges and Opportunities. In: Frontiers in Plant Science. Band 10, 2019, ISSN 1664-462X, S. 236, doi:10.3389/fpls.2019.00236, PMID 30930911 (frontiersin.org).
- Gerichtshof der Europäischen Union: Durch Mutagenese gewonnene Organismen sind genetisch veränderte Organismen (GVO) und unterliegen grundsätzlich den in der GVO-Richtlinie vorgesehenen Verpflichtungen. Abgerufen am 13. Februar 2019.
- Ann Ehrenhofer-Murray: Chance verpasst: ein rückwärtsgewandtes Urteil des EuGH zu Genom-editierten Organismen. In: BIOspektrum. Band 24, Nr. 6, 2018, ISSN 1868-6249, S. 573–575, doi:10.1007/s12268-018-0959-9.
- ZKBS: Genome Editing – Auswirkungen des EuGH-Urteils auf die Pflanzenzüchtung. Abgerufen am 13. Februar 2019.
- Bioökonomierat: Genome Editing: Europa benötigt ein neues Gentechnikrecht. In: BÖRMEMO 07. 19. Januar 2019, abgerufen am 13. Februar 2019.
- Eva Gelinsky, Angelika Hilbeck: European Court of Justice ruling regarding new genetic engineering methods scientifically justified: a commentary on the biased reporting about the recent ruling. In: Environmental Sciences Europe. Band 30, Nr. 1, 2018, ISSN 2190-4715, S. 52, doi:10.1186/s12302-018-0182-9, PMID 30613460.
- IG Saatgut: Interessengemeinschaft für gentechnikfreie Saatgutarbeit: Neue Gentechnik: Präzise, sicher und unentbehrlich?! Abgerufen am 26. Februar 2019.
- Emily Waltz: With a free pass, CRISPR-edited plants reach market in record time. In: Nature Biotechnology. Band 36, Nr. 1, 2018, ISSN 1546-1696, S. 6–7, doi:10.1038/nbt0118-6b (nature.com).
- Stefan Jansson: Gene-edited plants: What is happening now? In: Physiologia Plantarum. Band 164, Nr. 4, 2018, ISSN 1399-3054, S. 370–371, doi:10.1111/ppl.12853 (wiley.com).
- Heidi Ledford: CRISPR conundrum: Strict European court ruling leaves food-testing labs without a plan. In: Nature. Band 572, Nr. 7767, 2019, S. 15, doi:10.1038/d41586-019-02162-x (nature.com).
- P. Chhalliyil, et al.: A Real-Time Quantitative PCR Method Specific for Detection and Quantification of the First Commercialized Genome-Edited Plant. In: Foods. Nr. 9, 2020, S. 1245 ff., doi:10.3390/foods9091245.
- Neue Nachweismethode verspricht spezifsche Detektion genom-editierter Rapslinien – was kann das Verfahren tatsächlich leisten? Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, 9. September 2020, abgerufen am 14. Oktober 2020.
- ZEIT online: Emmanuelle Charpentier:Crispr-Entdeckerin kritisiert Genversuche an Babys. Abgerufen am 20. Februar 2019.
- Robin Lovell-Badge: CRISPR babies: a view from the centre of the storm. In: Development. Band 146, Nr. 3, 2019, ISSN 0950-1991, doi:10.1242/dev.175778, PMID 30728161 (biologists.org).
- Sheldon Krimsky: Ten ways in which He Jiankui violated ethics. In: Nature Biotechnology. Band 37, Nr. 1, 2019, ISSN 1546-1696, S. 19–20, doi:10.1038/nbt.4337 (nature.com).
- Jon Cohen: What now for human genome editing? In: Science. Band 362, Nr. 6419, 2018, ISSN 0036-8075, S. 1090–1092, doi:10.1126/science.362.6419.1090, PMID 30523087 (sciencemag.org).