Methylen
Methylen ist das einfachste organische Carben.[2] Es ist der Grundbaustein für die Methylengruppe.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
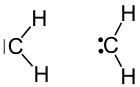 | ||||||||||
| Strukturformel als Singulett-Carben (links) und als Triplett-Carben (ein Diradikal, rechts) | ||||||||||
| Allgemeines | ||||||||||
| Name | Methylen | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | CH2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 14,03 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Struktur

Methylen ist gewinkelt aufgebaut und besitzt im Triplett-Grundzustand einen H,C,H-Bindungswinkel von 134.037(45)°, bestimmt durch Mikrowellenspektroskopie und hochaufgelöste Infrarotspektroskopie.[3] Singulett-Methylen ist energiereicher als Triplett-Carben. Als H,C,H-Bindungswinkel wird 103°[3] oder 105°[4] angegeben.
Gewinnung und Darstellung
Methylen lässt sich durch photochemische Spaltung von Diazomethan unter Bildung von Stickstoff darstellen.[5]
Dabei entsteht genau betrachtet Singulett-Methylen.[6] Wenn man die photochemische Spaltung von Diazomethan in Gegenwart eines Sensibilisators (z. B. Benzophenon) durchführt, entsteht jedoch Triplett-Methylen.[6] Weiterhin kann die Verbindung durch die Umsetzung von Diiodmethan mit einer Zn/Cu-Legierung in einer Simmons-Smith-Reaktion erzeugt werden.[7]
Der Nachweis der Existenz von Methylen gelang zuerst spektroskopisch 1959 durch Gerhard Herzberg, der es durch Blitzlichtphotolyse von Diazomethan herstellte.[8] Vorhergesagt wurde dessen Existenz schon von J. U. Nef in Chicago 1897.
Eigenschaften
Methylen besitzt einen Triplett-Grundzustand und ist darum paramagnetisch. Es kann somit wie molekularer Sauerstoff als Diradikal betrachtet werden. Methylen ist als reaktive Zwischenstufe unter besonderen Bedingungen stabil (z. B. unter hoher Verdünnung in Inertgas),[9] aber auf Grund des Elektronensextettes kurzlebig und sehr reaktiv (Elektronenmangelverbindung). Vor allem Additionsreaktionen sind sehr schnell und exotherm. Methylen reagiert mit sich selbst und tendiert bei ausreichenden Konzentrationen dazu, sich zu Ethen zu dimerisieren.[10]
Literatur
- I. Shavitt: Geometry and singlet-triplet energy gap in methylene: a critical review of experimental and theoretical determinations. In: Tetrahedron. 41, 1985, S. 1531–1542, doi:10.1016/S0040-4020(01)96393-8.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Roald Hoffmann: Molecular Orbitals of Transition Metal Complexes. Oxford 2005, ISBN 0-19-853093-5, S. 7.
- J. Vogt, B. Mez-Starck, N. Vogt and W. Hutter: "MOGADOC - A Database for Gasphase Molecular Spectroscopy and Structure" J. Mol. Struct. 485-486 (1999) 249-254
- Reinhard Brückner: Reaktionsmechanismen, Spektrum Akademischer Verlag, 3. korrigierte Auflage, 2007, ISBN 978-3-8274-1579-0, S. 115.
- Szántay Csaba: Elméleti szerves kémia, 4., átdolgozott, bővített. Auflage, Műegyetemi Kiadó, Budapest 1996, S. 287, ISBN 963-420-501-1.
- Joachim Buddrus: Grundlagen der Organischen Chemie. 4. Auflage, de Gruyter Verlag, Berlin 2011, ISBN 978-3-11-024894-4, S. 178–179.
- Eintrag zu Carbene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2013.
- G. Herzberg, J. Shoosmith: Spectrum and Structure of the Free Methylene Radical. In: Nature. Band 183, Nr. 4678, Juni 1959, S. 1801–1802, doi:10.1038/1831801a0.
- Curt Wentrup: Reaktive Zwischenstufen I: Radikale, Carbene, Nitrenen, gespannte Ringe. Thieme, Stuttgart 1979, ISBN 3-13-560101-3, S. 138–204.
- Milan Lazár: Free radicals in chemistry and biology. CRC Press, Boca Raton 1989, ISBN 0-8493-5387-4.