Traubesche Synthese
Die Traubesche-Purin-Synthese, oder auch Traube-Synthese, ist ein vielseitiges Verfahren zur Synthese von Purin und dessen Derivaten aus Pyrimidinderivaten. Sie ist eine nach dem deutschen Chemiker Wilhelm Traube (1866–1942) benannte Namensreaktion der organischen Chemie. Sie wurde 1900 zum ersten Mal publiziert.[1]
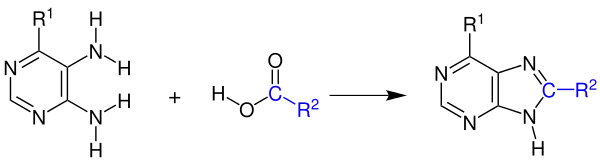
Heutzutage wird sie hauptsächlich industriell genutzt, um Coffein in mehreren Schritten aus Cyanessigsäure und Harnstoff herzustellen.
Mechanismus
Der Mechanismus wird hier exemplarisch anhand der Reaktion von 5,6-Diaminopyrimidin-4-ol und Ameisensäure demonstriert:[2]
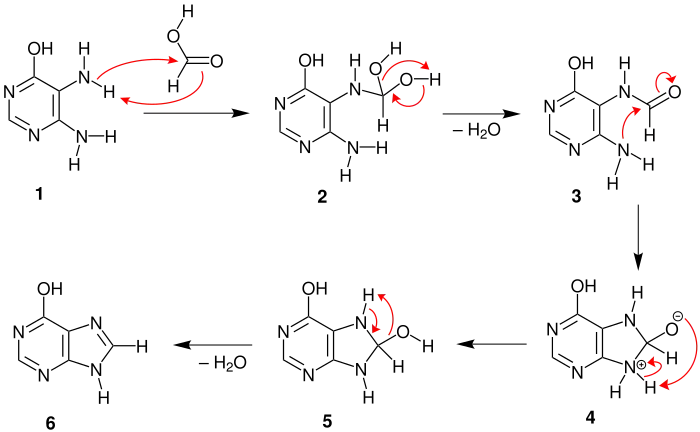
Zunächst versetzt man das Pyrimidinderivat 1 mit Ameisensäure. Diese lagert sich an das Pyrimidinderivat an, sodass man das instabile Diol 2 erhält. Durch Wasserabspaltung entsteht daraus das Amid 3. Nun findet durch einen intramolekularen, nucleophilen Angriff eine Cyclisierung statt, wobei sich das reaktive Intermediat 4 bildet. Durch einen intramolekularen [1,3]-Protonentransfer entsteht das Diol 5. Dieses reagiert durch Abspaltung von Wasser zum Purinderivat 6.
Es ist äußerst wichtig, dass als Edukt stets ein sehr reines Pyrimidin eingesetzt wird, da es andernfalls zur Bildung unerwünschter Nebenprodukte kommen kann.[2] Doch selbst unter diesen Bedingungen kann es dazu kommen, dass man keine Purinderivate erhält. Dies liegt daran, dass das Edukt nur bis zur Formylierung reagiert, aber im Anschluss nicht cyclisiert.[3]
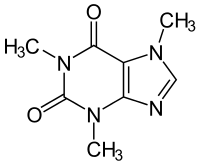
Coffein-Herstellung
Die industrielle Synthese von Coffein ausgehend von Cyanessigsäure und N,N′-Dimethylharnstoff ist eine der wichtigsten Anwendungen der Traube-Purin-Synthese.
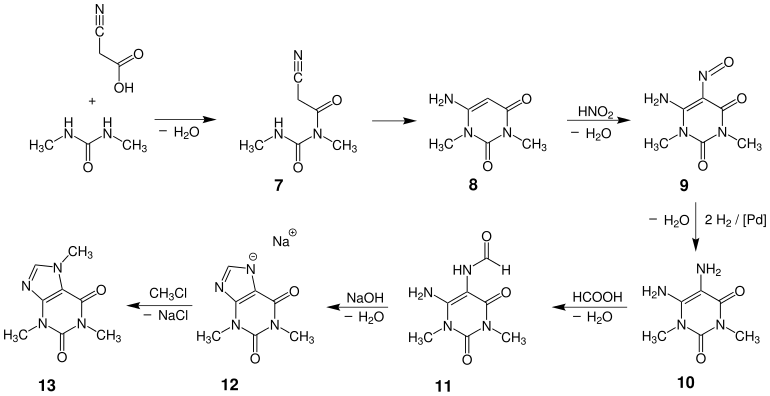
Synthese von Coffein
Ausgehend von Cyanessigsäure und Dimethylharnstoff beginnt die Synthese mit einer Kondensation des Amidstickstoffs an der Carboxygruppe der Cyanessigsäure, wodurch es zur Bildung des Amids 7 kommt. Die Cyclisierung verläuft durch einen nukleophilen Angriff des zweiten Stickstoffs am Nitril, wodurch die Verbindung 8, ein Derivat des Uracils, erhalten wird. Durch anschließende Nitrosylierung mit Salpetriger Säure wird diese zur Nitrosoverbindung 9 umgesetzt, die im nächsten Schritt durch Wasserstoff an einem Platinkatalysator zum Amin 10 reduziert wird. Durch anschließende Formylierung einer Aminogruppe mit Ameisensäure wird das Formamid 11 erhalten, welches im nächsten Schritt durch Einwirkung von Natronlauge zu dem Imidazoliumsalz 12, dem Natriumsalz des Theophyllins, cyclisiert wird. Ausgehend von diesem Salz kann Coffein 13 durch Reaktion mit Chlormethan erhalten werden.
Es existieren viele weitere Anwendungsmöglichkeiten dieser Reaktion. So z. B. eine Modifikation, mit deren Hilfe man die Kondensation eines 4,5-Diaminopyrimidines mit einem Aldehyd zu einem einstufigen Prozess verbessern konnte, bei dem lediglich schwache Basen eingesetzt werden müssen und eine begleitende Oxidation mit Luft stattfindet.[4]
Literatur
- J. J. McKetta, W. A. Cunningham: Encyclopedia of Chemical Processing and Design. Band 5: Blowers to Calcination. 1. Auflage, Marcel Dekker Inc., 1977, ISBN 0824724550, S. 435–437.
Einzelnachweise
- W. Traube: Der synthetische Aufbau der Harnsäure, des Xanthins, Theobromins, Theophyllins und Caffeïns aus der Cyanessigsäure. in: Chem. Ber. 33, 1900, S. 3035–3056; doi:10.1002/cber.19000330352.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. 3 Bände. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2789–2792.
- R. Robins, K. Dille, C. Willits, B. Christensen: Purines. II. The Synthesis of Certain Purines and the Cyclization of Several Substituted 4,5-Diaminopyridines – Correction. In: Journal of the American Chemical Society. Band 75, Nr. 24, 1953, S. 6359–6359, doi:10.1021/ja01120a618.
- Aleem Gangjee, Anil Vasudevan, and Sherry F. Queener: Conformationally Restricted Analogues of Trimethoprim: 2,6-Diamino-8-substituted Purines as Potential Dihydrofolate Reductase Inhibitors from Pneumocystis carinii and Toxoplasma gondii1. In: Journal of Medicinal Chemistry. Band 40, Nr. 19, 1997, S. 3032–3039, doi:10.1021/jm970271t.