Proteinkinase A
Die Proteinkinase A (PKA) ist eine cAMP-abhängige Proteinkinase und zählt zu den Serin/Threonin-Kinasen. Sie ist im Vergleich zu anderen Proteinkinasen am besten untersucht und charakterisiert. PKA ist an der Regulation im Energiestoffwechsel (Glykogen, Lipiden, Kohlenhydrate) beteiligt. Außerdem spielt PKA eine wichtige Rolle bei der Modifikation von Synapsen und der Kontrolle bei Ionenkanälen. Schließlich werden über PKA spezielle Transkriptionsfaktoren aktiviert, das so genannte cAMP-responsive element-binding protein (CREB). Durch einen Coaktivator (CREB-binding protein) wird die Transkription von Zielgenen ermöglicht, die über ein cAMP-Antwortelement (cAMP responsive element) verfügen.
| Proteinkinase A | ||
|---|---|---|
 | ||
| Proteinkinase A nach PDB 1CMK --> | ||
| Bezeichner | ||
| Gen-Name(n) | PRKACA, PRKACB, PRKACG, PRKAR1A, PRKAR1B, PRKAR2A, PRKAR2B | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.11.11, Proteinkinase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | ATP + Protein | |
| Produkte | ADP + Phosphoprotein | |
Namensgebend ist die Aktivierung durch cyclisches AMP (cAMP), ein sekundärer Botenstoff, dessen intrazelluläre Bildung durch eine Reihe hydrophiler Hormone ausgelöst wird.
Aufbau
In höher entwickelten Eukaryoten liegt das Enzym in Abwesenheit von cAMP als ein Tetramer vor, bestehend aus zwei verschiedenen Protein-Untereinheiten. Damit ist es ein sogenanntes Heterotetramer (R2C2). Der Komplex besteht aus
- zwei regulatorischen Untereinheiten R mit hoher Affinität für cAMP mit einer Masse von je 43–45 kDa und
- zwei katalytischen Untereinheiten C mit Bindungsplätzen für Substrat und Coenzym (ATP) mit einer Masse von je 40 kDa.
In niederen, unizellulären Eukaryoten, beispielsweise in Backhefe, im Schleimpilz Dictyostelium discoideum oder im Malariaerreger Plasmodium falciparum, liegt PKA als Heterodimer aus je einer R- und C-Untereinheit vor.[1]
In Säugern wurden vier Isoformen der R-Untereinheit (RIα, RIβ, RIIα und RIIβ) sowie drei Typen der C-Untereinheit (Cα, Cβ und Cγ) nachgewiesen. Durch die verschiedenen Isoformen können sich sehr viele unterschiedliche Heterotetramere formen. Diese Vielfältigkeit trägt zur Spezifität und Variabilität beim PKA-Signalweg in der Zelle bei.
Die R-Untereinheiten haben alle einen ähnlichen Aufbau und unterscheiden sich in der Gesamtlänge. Am N-Terminus ist eine Dimersierungsdomäne lokalisiert, durch die sich beide R-Untereinheiten kontaktieren. Zudem haben die so genannten A-Kinase-Ankerproteine (AKAP) die Möglichkeit, durch diese N-terminalen Domäne an die PKA zu binden. Am C-Terminus finden sich zwei cAMP-Bindedomänen, die die Bindung von cAMP ermöglichen. Zwischen N- und C-Terminus liegt eine autoinhibitorische Sequenz. Sie dient als Erkennungssequenz für die C-Untereinheit. Dadurch wird die Substratbindestelle der C-Untereinheit so lange blockiert, bis die C-Untereinheit nach Aktivierung von cAMP freigesetzt wird.
Der N-Terminus der C-Untereinheit ist mit Myristinsäure modifiziert. Die Bedeutung hierfür ist jedoch noch nicht verstanden.
Aktivierung und Wirkungen
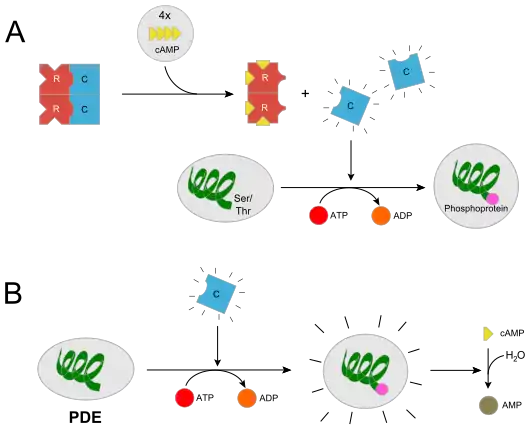
In höheren Eukaryoten ist der R2C2-Komplex inaktiv, da die regulatorischen Untereinheiten das katalytische Zentrum der C-Untereinheit blockieren. Die kooperative Bindung zweier Moleküle cAMP an die R-Untereinheiten führt durch Dissoziation des Komplexes in ein R2-Komplex und zwei aktive C-Untereinheiten. Der Enzymkomplex wird bereits durch cAMP-Konzentrationen in der Größenordnung von 10 nM (10−9 mol·l−1) aktiviert. Durch Binden von cAMP an die R-Untereinheit wird eine große Konformationsänderung ausgelöst. In höheren Eukaryonten werden vier, in niederen zwei Moleküle cAMP gebunden. In dessen Folge wird die Affinität zwischen der R- und der C-Untereinheit um den Faktor 104 bis 105 gesenkt, so dass die C-Untereinheiten abdissoziieren können. Die freien C-Untereinheiten können nun eine Reihe von Substraten phosphorylieren, die PKA ist aktiv. Hierbei werden Substrate an spezifischen Threonin- bzw. Serinresten phosphoryliert, indem die γ-Phosphatgruppe ATPs transferiert wird. Die Aktivität der PKA erstreckt sich bei cytosolischen Substraten über mehrere Minuten. Wenn die PKA Transkriptionsfaktoren im Zellkern phosphoryliert, verlängert sich ihre Wirkungsdauer um mehrere Stunden.
PKA hat eine Vielzahl von Wirkungen sowohl im Cytosol einer Zelle (Interkonvertierung von Enzymen) als auch in deren Kern (Aktivierung von Transkriptionsfaktoren). Im Cytosol vermittelt sie sowohl den Glycogen-(Glykogenolyse) als auch den Lipidabbau (Lipolyse).
Die Hydrolyse der Fette (Triglyceride) wird durch PKA-regulierte Lipasen kontrolliert. Gleichzeitig wird ein Schrittmacherenzym der Fettsäuresynthese, die Acetyl-CoA-Carboxylase, inhibiert, was die lipolytische Wirkung des cAMP noch steigert.
Die Proteinsequenz, die Ziel einer Phosphorylierung durch die PKA ist, hat die Konsensussequenz Arg-Arg-x-Ser-x, wobei x bevorzugt eine kleine, hydrophobe Aminosäure ist.
Die Untereinheiten der PKA treten jeweils in verschiedenen Formen auf, z. B.
- eine RI-Isoform,
- eine RII-Isoform;
letztere unterscheidet sich von der RI-Isoform durch ihre Autophosphorylierbarkeit. Die RII-Untereinheit kann an einer Stelle durch die C-Untereinheit des Holoenzyms (R2C2) phosphoryliert werden. Dies hebt aber nicht den inaktiven Status auf.
Die C-Untereinheit weist zwei spezifische Serin/Threonin-Phosphorylierungsstellen. Diese sind Threonin 197 und Serin 338, ersteres befindet sich in der Aktivierungsschleife der C-Untereinheit. Thr 197 ist Ziel einer Autophosphorylierung. Für die katalytische Aktivität der C-Untereinheit sind drei Aminosäuren wichtig: Aspartat 166, Lysin 168 und Aspartat 171.[1] Diese drei Aminosäuren sind in allen Serin-/Threoninproteinkinasen hochkonserviert erhalten.
Regulation
Die PKA wird nicht nur durch die Menge an cAMP reguliert. Es ist bekannt, dass sie auch durch ihren subzellulären Aufenthaltsort reguliert werden kann. So assoziiert die PKA, die eine RII-Untereinheit besitzt, ans Cytoskelett und mit dem Golgiapparat. Vermittelt wird dies durch ein spezielles Protein, dem Proteinkinase A-Ankerprotein (protein kinase A anchor protein).
Es gibt außerdem noch einen feedback-Kontrollmechanismus. Hierbei aktiviert die PKA eine cAMP-Phosphodiesterase (PDE; vgl. Bild (B)). Die aktivierte PDE hydrolysiert cAMP zu AMP. Dadurch wird die Aktivität der PKA selbst heruntergefahren oder kommt zum Erliegen. Das ist vor allem dann nützlich, wenn kein extrazelluläres Signal mehr zur Bildung von cAMP vorliegt. Unter diesen Umständen soll dieser second messenger schnell inaktiviert werden.
Literatur
- Gerhard Krauss: Biochemistry of Signal Transduction and Regulation. Wiley-VCH Verlag GmbH & Co. KGaA; 4. erweiterte und verbesserte Auflage 2008; ISBN 978-3-527-31397-6, S. 327ff.
- Shemarova, IV. (2009): cAMP-dependent signal pathways in unicellular eukaryotes. In: Crit Rev Microbiol 35(1); 23–42; PMID 19514907; doi:10.1080/10408410802645646
Einzelnachweise
- Shemarova, IV. (2009): cAMP-dependent signal pathways in unicellular eukaryotes. In: Crit Rev Microbiol 35(1); 23–42; PMID 19514907; doi:10.1080/10408410802645646