Adenosinrezeptoren
Adenosinrezeptoren, auch A-Rezeptoren, P1-Purinozeptoren oder P1-Rezeptoren genannt, sind Rezeptoren, die durch das Purinnukleosid Adenosin aktiviert werden. Die vier derzeit bekannten Vertreter dieser Gruppe von Purinozeptoren, die als A1, A2A, A2B und A3 bezeichnet werden, spielen im Zentralnervensystem sowie bei der Regulation von Herz-Kreislauf-Funktionen und Immunreaktionen eine Rolle. Diese Effekte werden über eine rezeptorvermittelte Aktivierung von G-Proteinen ausgelöst. Die Wirkungen der Xanthine Coffein, Theophyllin und Theobromin können zumindest teilweise über eine Interaktion mit Adenosinrezeptoren erklärt werden. In Tiermodellen sowie klinischen Studien konnte nachgewiesen werden, dass A2A-Rezeptorantagonisten, zusammen mit der Einnahme von Levodopa oder D2-Rezeptoragonisten, die therapeutischen Effekte dieser amplifizieren können.[1][2] Der A2A-Rezeptorantagonist Istradefyllin wird zur Behandlung des Morbus Parkinson genutzt. Mit Regadenoson wurde 2008 in den USA der erste A2A-Agonist zur Therapie zugelassen.[3] Weitere Antagonisten und Agonisten werden derzeit als potenzielle Arzneistoffe entwickelt.[4]
| A1 | A2A | A2B | A3 | |
|---|---|---|---|---|
| Genetik | ||||
| Gen-Name | ADORA1 | ADORA2A | ADORA2B | ADORA3 |
| Genlocus | 1q32.1 | 22q11.23 | 17p12-p11.2 | 1p21-p13 |
| Protein | ||||
| UniProt-Bez. | P30542 | P29274 | P29275 | P33765 |
| Struktur | 7TM | 7TM | 7TM | 7TM |
| Länge | 326 Aminosäuren | 412 Aminosäuren | 332 Aminosäuren | 318 Aminosäuren |
| Pharmakologie | ||||
| Signaltransduktion | Gi/o | Gs | Gs | Gi/o |
| Funktion | negative Inotropie und Chronotropie | Schmerz Hemmung der Plättchenaggregation Vasodilatation |
Freisetzung von Entzündungsmediatoren | Mastzelldegranulation |
| Agonisten | Adenosin N6-Cyclopentyladenosin |
Adenosin Regadenoson CGS-21680 2-(1-(E)-Hexenyl)adenosin-5'-N-ethyluronamid (HENECA) ATL-146e |
Adenosin BAY 60–6583 |
Adenosin CP-532,903 CF-101 (IB-MECA) 2-Cl-IB-MECA |
| Antagonisten | Coffein Theophyllin 8-Cyclopentyl-1,3-dipropylxanthin (DPCPX) |
Coffein Theophyllin Istradefyllin ZM 241385 SCH 58261 |
Theophyllin MRS 1753 MRS 1706 PSB 1115 |
Theophyllin VUF 5574 MRS 1220 MRS 1523 MRS 1191 |
Geschichte
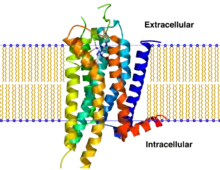
Alan Drury und Albert von Szent-Györgyi Nagyrápolt entdeckten im Jahr 1929, dass Adenosin verschiedene Körperfunktionen beeinflussen kann.[5] Diese Effekte wurden ursprünglich auf Transportproteine und intrazelluläre Vorgänge zurückgeführt. Entgegen dieser Hypothese postulierte 1974 L. Bruce Cobbin, dass spezifische Rezeptoren für diese Effekte verantwortlich seien.[6] Dass es sich bei dem Adenosinrezeptor nicht nur um einen einzigen Rezeptor handelt, sondern dass mehrere Isoformen existieren, wurde Ende der 1970er Jahre nachgewiesen.[7][8] Auf der Suche nach neuen G-Protein-gekoppelten Rezeptoren wurden mit dem A1- und dem A2A-Rezeptor Ende der 1980er Jahre die ersten Adenosinrezeptoren eher zufällig kloniert.[9] Die dreidimensionale Struktur eines Adenosinrezeptors, des A2A-Rezeptors, konnte 2008 als Fusionsprotein mit Hilfe der Röntgenstrukturanalyse aufgeklärt werden. Damit ist dieser Rezeptor einer der ersten G-Protein-gekoppelten Rezeptoren, für den detaillierte Informationen über seine räumliche Struktur vorliegen.[10][11][12]
Einzelnachweise
- Micaela Morelli, Fabio Blandini, Nicola Simola, Robert A. Hauser: A2AReceptor Antagonism and Dyskinesia in Parkinson’s Disease. In: Parkinson's Disease. Band 2012, 2012, S. 1–8, doi:10.1155/2012/489853, PMID 22754707, PMC 3382949 (freier Volltext).
- Marie Therese Armentero, Annalisa Pinna, Sergi Ferré, José Luis Lanciego, Christa E. Müller: Past, present and future of A2A adenosine receptor antagonists in the therapy of Parkinson's disease. In: Pharmacology & Therapeutics. Band 132, Nr. 3, Dezember 2011, S. 280–299, doi:10.1016/j.pharmthera.2011.07.004, PMID 21810444, PMC 3205226 (freier Volltext).
- Reuters: CV Therapeutics and Astellas Announce FDA Approval for Lexiscan(TM) (regadenoson) Injection. (en, PDF; 23kB)
- Fredholm BB, IJzerman AP, Jacobson KA, Klotz KN, Linden J: International Union of Pharmacology. XXV. Nomenclature and classification of adenosine receptors. In: Pharmacol Rev. 53, Nr. 4, 2001, S. 527–52. PMID 11734617.
- A. N. Drury, A. Szent-György: The physiological activity of adenine compounds with especial reference to their action upon the mammalian heart. In: The Journal of Physiology. Band 68, Nr. 3, 1929, S. 213–237, doi:10.1113/jphysiol.1929.sp002608, PMID 16994064, PMC 1402863 (freier Volltext).
- Cobbin LB, Einstein R, Maguire MH: Studies on the coronary dilator actions of some adenosine analogues. In: Br J Pharmacol. 50, Nr. 1, Januar 1974, S. 25–33. PMID 4362949. PMC 1776578 (freier Volltext).
- van Calker D, Müller M, Hamprecht B: Adenosine regulates via two different types of receptors, the accumulation of cyclic AMP in cultured brain cells. In: J. Neurochem. 33, Nr. 5, November 1979, S. 999–1005. PMID 228008.
- Londos C, Cooper DM, Wolff J: Subclasses of external adenosine receptors. In: Proc. Natl. Acad. Sci. U.S.A. 77, Nr. 5, Mai 1980, S. 2551–2554. PMID 6248853. PMC 349439 (freier Volltext).
- Libert F, Parmentier M, Lefort A, et al.: Selective amplification and cloning of four new members of the G protein-coupled receptor family. In: Science. 244, Nr. 4904, Mai 1989, S. 569–572. PMID 2541503.
- Jaakola VP, Griffith MT, Hanson MA, et al.: The 2.6 angstrom crystal structure of a human A2A adenosine receptor bound to an antagonist. In: Science. 322, Nr. 5905, November 2008, S. 1211–1217. doi:10.1126/science.1164772. PMID 18832607. PMC 2586971 (freier Volltext).
- Xu F, Wu H, Katritch V, et al.: Structure of an agonist-bound human A2A adenosine receptor. In: Science. 332, Nr. 6027, 2011, S. 322–327. doi:10.1126/science.1202793. PMID 21393508. PMC 3086811 (freier Volltext).
- Lebon G, Warne T, Edwards PC, et al.: Agonist-bound adenosine A2A receptor structures reveal common features of GPCR activation. In: Nature. 474, Nr. 7352, 2011, S. 521–525. doi:10.1038/nature10136. PMID 21593763. PMC 3146096 (freier Volltext).