Hormonsensitive Lipase
Die hormonsensitive Lipase (HSL) ist das Enzym, das gespeicherte Fette in Fettzellen und Cholesterinester in ihre Bestandteile zerlegt und diese so zur Verfügung stellt. Die HSL ist damit von zentraler Bedeutung für den Fettstoffwechsel und die Synthese der Steroidhormone. Durch ihre – je nach Phosphorylierung – unterschiedliche Aktivität ist sie außerdem ein Ansatzpunkt zur Regulation des Fettabbaus durch von Hormonen ausgelöste Signalkaskaden, wobei Katecholamine den Fettabbau steigern und Insulin ihn bremst. HSL-Homologe sind bereits in Zweiseitentieren zu finden. Beim Menschen ist sie in Fettzellen und Gewebetypen lokalisiert, die Cholesterin benötigen. Dies schließt die Inselzellen des Pankreas mit ein, da dort Cholesterin für den Prozess der Insulinsekretion verbraucht wird.[1][2]
| Hormonsensitive Lipase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1076 Aminosäuren | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Name | LIPE | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.1.79, Lipase | |
| Reaktionsart | Spaltung einer Fettsäure-Esterbindung | |
| Substrat | Cholesterinester, Tri-/Di-/Monoacylglycerin + H2O | |
| Produkte | Cholesterin, Diacyl-/Monoacyl-/Glycerin + Fettsäure | |
| Vorkommen | ||
| Homologie-Familie | HSL | |
| Übergeordnetes Taxon | Zweiseitentiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 3991 | 16890 |
| Ensembl | ENSG00000079435 | ENSMUSG00000003123 |
| UniProt | Q05469 | P54310 |
| Refseq (mRNA) | NM_005357 | NM_001039507 |
| Refseq (Protein) | NP_005348 | NP_001034596 |
| Genlocus | Chr 19: 42.4 – 42.43 Mb | Chr 7: 25.38 – 25.4 Mb |
| PubMed-Suche | 3991 | 16890 |
Mäuse ohne HSL schalten in ihrer Skelettmuskulatur die Energiegewinnung von Lipid auf Kohlenhydrat um. Die weitreichenden Änderungen im Stoffwechsel solcher Mäuse deuten darauf hin, dass Fettabbauprodukte eine Rolle als Signalmoleküle spielen. Solche Mäuse sind nicht mehr in der Lage, Energie aus ihren Fettreserven zu gewinnen. Studien lassen es für möglich erscheinen, dass die bei Diabetes mellitus beobachtete Fettleibigkeit aus ungenügendem Abbau der Skelettmuskelfette durch HSL entsteht. Aus diesen und anderen Gründen ist HSL ein Target bei der Behandlung dieser Krankheit.[3][4][5]
Katalysierte Reaktion
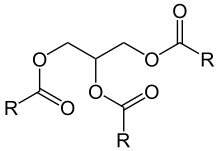 + H2O ⇒
+ H2O ⇒ 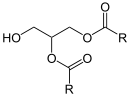 + Fettsäure
+ Fettsäure
Fettsäure wird von einem Acylglycerin abgespalten. Als Substrat werden außerdem Cholesterinester, Steroid-Fettsäureester, Retinylester und p-Nitrophenylester akzeptiert. HSL ist damit diejenige Lipase mit dem breitesten Wirkspektrum.[6]
Literatur
- Kraemer FB, Shen WJ: Hormone-sensitive lipase: control of intracellular tri-(di-)acylglycerol and cholesteryl ester hydrolysis. In: J. Lipid Res.. 43, Nr. 10, Oktober 2002, S. 1585–94. PMID 12364542.
Weblinks
- D’Eustachio/reactome.org: Hormone-sensitive lipase (HSL)-mediated triacylglycerol hydrolysis
Einzelnachweise
- UniProt Q05469
- Larsson S, Wierup N, Sundler F, Eliasson L, Holm C: Lack of cholesterol mobilization in islets of hormone-sensitive lipase deficient mice impairs insulin secretion. In: Biochem. Biophys. Res. Commun.. 376, Nr. 3, November 2008, S. 558–62. doi:10.1016/j.bbrc.2008.09.045. PMID 18804448.
- Pinent M, Hackl H, Burkard TR, et al: Differential transcriptional modulation of biological processes in adipocyte triglyceride lipase and hormone-sensitive lipase-deficient mice. In: Genomics. 92, Nr. 1, Juli 2008, S. 26–32. doi:10.1016/j.ygeno.2008.03.010. PMID 18572100.
- Fernandez C, Hansson O, Nevsten P, Holm C, Klint C: Hormone-sensitive lipase is necessary for normal mobilization of lipids during submaximal exercise. In: Am. J. Physiol. Endocrinol. Metab.. 295, Nr. 1, Juli 2008, S. E179–86. doi:10.1152/ajpendo.00282.2007. PMID 18492774.
- Jocken JW, Blaak EE: Catecholamine-induced lipolysis in adipose tissue and skeletal muscle in obesity. In: Physiol. Behav.. 94, Nr. 2, Mai 2008, S. 219–30. doi:10.1016/j.physbeh.2008.01.002. PMID 18262211.
- ExPASy: EC 3.1.1.79