Second Messenger
Second messenger ist ein englischer Fachterminus der Biologie und Medizin, den man mit sekundärer Botenstoff ins Deutsche übersetzen kann. Auch sekundärer Messenger oder Sekundärsignal sind in der Fachliteratur anzutreffende, synonyme Begriffe. Ein second messenger ist eine intrazelluläre chemische Substanz, deren Konzentration als Antwort auf ein Primärsignal (first messenger = Ligand) verändert wird.
Der second messenger dient der intrazellulären Weiterleitung eines von außen (extrazellulär) kommenden primären Signals, das die Zellmembran nicht passieren kann. Das Primärsignal überträgt Signale zwischen Zellen; der second messenger dient der Signalübertragung innerhalb der Zelle, ist also intrazellulär. Dabei steht der second messenger oft nur am Anfang einer oder mehrerer längerer, intrazellulärer Signalketten, die auch der Signalverstärkung dienen und schließlich zu einer Zellantwort auf das Primärsignal führen. Second messenger wurden zunächst für die Signalweiterleitung hydrophiler Hormone, wie z. B. Insulin, Glucagon und Adrenalin, oder Neurotransmitter, wie z. B. Glutamat, beschrieben.
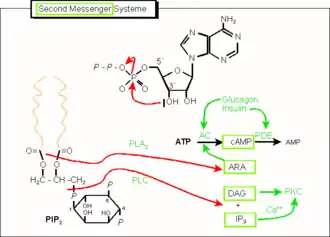
Die Abbildung 1 behandelt exemplarisch die beiden am häufigsten vorkommenden und am längsten bekannten second messenger-Systeme (cAMP und IP3). Weitere Vertreter der Klasse sind cyclisches GMP (cGMP, ein cAMP-analoges Nukleotid), aber auch Gase wie Stickstoffmonoxid und (möglicherweise) Kohlenstoffmonoxid.
Cyclisches Adenosinmonophosphat (cAMP) als second messenger
Bildung
ATP ist die Vorstufe des am längsten bekannten sekundären Messengermoleküls, des cyclischen AMP (cAMP). Dieses wird durch Adenylylcyclase (Adenylatcyclase, AC) gebildet, die ihrerseits häufig durch die α-Untereinheit eines G-Proteins (Gs) aktiviert wird.
Wirkung
Die Wirkung von cAMP beruht hauptsächlich auf der Aktivierung der cAMP-abhängigen Proteinkinase A (PKA), die Phosphatgruppen auf Proteine überträgt. Diese phosphorylierten Proteine können unterschiedliche Funktionen ausüben.
- Die phosphorylierten Proteine dienen als aktivierte Enzyme. Ein Beispiel hierfür ist die Zellantwort von Muskelzellen auf Adrenalin. Innerhalb von Sekunden kommt es dabei zu einer Glucosefreisetzung aus Glykogen.
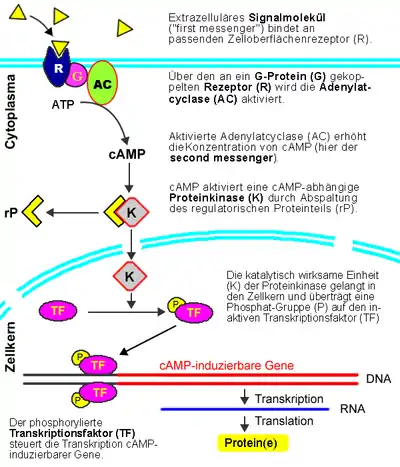
- Die phosphorylierten Proteine dienen als aktivierte Transkriptionsfaktoren, bzw. Genregulatorproteine. Eine typische Signalkette sieht vereinfacht so aus: Hormon oder Neurotransmitter → Rezeptor → G-Protein → Adenylatcyclase → cyclisches AMP (cAMP) → Genregulatorprotein → Gentranskription → Genprodukt(e) (Siehe Abbildung 2). Vom Primärsignal bis zur Zellantwort können hier Minuten bis Stunden vergehen.
Abbau
Die Lebensdauer von cAMP wird durch die große Familie der Phosphodiesterasen (PDE) limitiert. Die bekannten Wirkungen von Koffein gehen – zumindest teilweise – darauf zurück, dass dieses methylierte Xanthin ein Inhibitor der PDE ist. cAMP wird also nicht so schnell abgebaut. Andererseits besteht eine Wirkung des Insulins in der Aktivierung der PDE in der Leber. Dadurch sinkt die cAMP-Konzentration und gleichzeitig die Bereitstellung von Glucose.
Cyclisches Guanosinmonophosphat (cGMP) als second messenger
Cyclisches Guanosinmonophosphat (cGMP), ist dem cAMP chemisch sehr ähnlich und wird analog cAMP von einer Guanylylcyclase aus GTP erzeugt. Die Guanylylcyclase kann dabei entweder membrangebunden oder löslich vorliegen. cGMP übt zwei Funktionen aus. Es kann cGMP-abhängige Proteinkinasen aktivieren oder den Öffnungszustand von Kationenkanälen beeinflussen. Letzteres spielt z. B. bei der visuellen Signaltransduktion, also beim Sehvorgang in den Lichtsinneszellen, eine wichtige Rolle. Die Zellantwort auf Belichtung ist hier allerdings nicht der Auf-, sondern der Abbau von cGMP! Ein einziges absorbiertes Photon kann über einen G-Protein-gekoppelten Prozess zur Hydrolyse von ca. Hunderttausend cGMP-Molekülen führen.
Inositol-1,4,5-trisphosphat (IP3) als second messenger
Ein weiteres bedeutendes und dazu weit verzweigtes Signalsystem leitet sich von den Phospholipiden der Zellmembran, hier insbesondere von Phosphatidylinositolbisphosphat (PIP2) ab. Bei dieser Signalübertragung wird über das G-Protein nicht die Adenylatcyclase, sondern das membrangebundene Enzym Phospholipase C (PLC) aktiviert. Diese spaltet PIP2 in Inositoltrisphosphat (IP3) und Diacylglycerol (DAG). Ersteres bewirkt über die Aktivierung von IP3-Rezeptoren die Freisetzung von Calciumionen aus intrazellulären Calciumspeichern (z. B. aus dem ER), letzteres ist zusammen mit Calcium ein Aktivator der Ca2+-abhängigen Proteinkinase C (PKC). Wie bei der Proteinkinase A werden von Proteinkinase C nun Proteine phosphoryliert. Die Wirkungen sind ähnlich vielfältig. Eine alternative Prozessierung PIP2-verwandter Phospholipide besteht in der Abspaltung der Arachidonsäure (ARA) durch Phospholipase A2 (PLA2). Arachidonsäure (C20:4) stimuliert einerseits Sekretionsprozesse und ist andererseits die Quelle der Prostaglandine, einer besonderen Klasse von Gewebshormonen.
Calciumionen als second messenger
Calciumionen (Ca2+) sind zentrale Signalionen innerhalb der Zelle, auch wenn diese meist nicht am Anfang einer intrazellulären Signalkette stehen. Durch Hormone oder elektrische Stimulation kann ein Anstieg der Calciumkonzentration der Zelle erfolgen. Die freie Calciumionenkonzentration ist in einer nicht erregten Zelle im Vergleich zum Außenmedium extrem niedrig. Durch das Öffnen spezifischer Ionenkanäle kann die Konzentration um mehrere Zehnerpotenzen erhöht werden.
Calciumionen haben eine Vielzahl unterschiedlicher Effekte und wirken auf viele wichtige Prozesse, beispielsweise bei der Kontraktion von Muskeln, bei der Zellteilung, der Sekretion, der Genexpression oder bei Reaktion mit dem Intermediärstoffwechsel. Bei Pflanzen spielt es unter anderem bei der Auslösung bestimmter Wachstumsprozesse eine wichtige Rolle.
Calciumionen können auf zwei unterschiedliche Weisen als Signalmolekül fungieren. Entweder besitzen Zielmoleküle wie Proteinkinase C, Villin oder Phospholipase A2 eine spezifische Bindestelle für Calciumionen. Die Aktivität dieser Moleküle wird durch die Calciumionen direkt beeinflusst. Ein in allen Eukaryonten vorkommendes und weit verbreitetes Zielprotein ist Calmodulin, was vier Calciumionen binden kann. Dieses kann im calciumgebundenen Zustand wiederum an andere Proteine andocken und jene aktivieren. Hier wirkt Calcium indirekt.
Stickstoffmonoxid (NO) als second messenger
Das gasförmige Stickstoffmonoxid (NO) kann ebenfalls als second messenger fungieren. Ursprünglich wurde die Bedeutung von NO als Botenstoff im Zusammenhang mit der Kontraktion und Entspannung von Blutgefäßen entdeckt. Mittlerweile ist bekannt, dass fast jede Zelle in Säugern durch NO reguliert werden kann und dass es als universaler Botenstoff für die intra- und interzelluläre Kommunikation dient.
NO wird enzymatisch aus der Aminosäure L-Arginin gebildet, was eine Stickstoffmonoxidsynthase (NO-Synthase, NOS) katalysiert. Hierbei entsteht Citrullin, das im Harnstoffzyklus wieder zu Arginin regeneriert werden kann. Die NO-Synthasen sind als Dimere aktiv und können als inaktive Monomere vorliegen. Es gibt drei verschiedene NO-Synthasen, die unterschiedlich sensitiv auf Calciumionen reagieren. Eine Form, NOS II, wird hierbei aber nicht durch Calciumionen reguliert, sondern durch die Transkription seiner mRNA. Die NO-Synthase benötigt verschiedene Cofaktoren, wie beispielsweise FAD, Häm oder/und Sauerstoff.
NO ist ein kleines, wasserlösliches Molekül, das Biomembranen ungehindert passieren kann. Da es als Radikal vorliegt, hat es in Wasser nur eine kurze Lebensdauer von ca. 4 Sekunden. Es reagiert mit Sauerstoff, Fe(II) in Hämen und SH-Gruppen, was die Bildung von S-Nitrosylgruppen (RS-NO) nach sich zieht. Enzymgebunden ist NO wesentlich länger stabil als frei in Lösung.
Durch extra- oder intrazelluläre Signale wird die Bildung von NO stimuliert. Es kann dabei innerhalb derselben Zelle als Botenstoff dienen oder ein Signal einer benachbarten Zelle auslösen. Daher hat es sowohl die Eigenschaft eines autokrinen oder parakrinen Hormons, als auch eines intrazellulären Botenstoffs.
Physiologisch übt NO sowohl eine regulatorische als auch eine toxische Funktion aus. Letztere spielt insbesondere im Nervensystem eine Rolle. Möglicherweise wird während eines Schlaganfalles eine erhöhte Menge an NO gebildet, das zum Absterben von Nervenzellen führt.
Die regulatorische Funktion von Stickstoffmonoxid ist vielfältig, da es mit vielen Effektorproteinen reagieren kann. So kann NO beispielsweise eine NO-sensitive Guanylylcyclase aktivieren, so dass die Menge an cGMP steigt. Dies hat vielfältige Folgen (siehe oben). Ein weiteres Effektormolekül ist Hämoglobin, das an einer reaktiven Cysteingruppe, Cys 93, und am Eisenatom durch NO nitrolysiert werden kann. Durch diese Prozesse können Erythrozyten Stickstoffmonoxid speichern und durch die Blutgefäße transportieren. In Abhängigkeit vom Sauerstoffgehalt dissoziiert NO wieder ab und kann mit Glutathion oder anderen Cysteinen reagieren. Dadurch gelangt NO schließlich ins Endothel kleiner Blutgefäße und bewirkt dort eine Weitung dieser Blutgefäße. Das geformte cGMP aktiviert die Proteinkinase G, die dann die Mysoin-light-chain Kinase phosphoryliert. Die phosphorylierte MLCK kann nicht mehr die Myosin light chain in der glatten Muskulatur aktivieren, weswegen keine Kontraktion möglich ist. Es kommt zu einer Entspannung der glatten Muskulatur und damit zu einer Vasodilatation.
Literatur
- Gerhard Krauss: Biochemistry of Signal Transduction and Regulation. Wiley-VCH Verlag GmbH & Co. KGaA; 4. erweiterte und verbesserte Auflage 2008; ISBN 978-3-527-31397-6, S. 327ff.
- Bruce Alberts, Dennis Bray, Karen Hopkin, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter, Lutz Nover (Hrsg.) und Pascal von Koskull-Döring (Hrsg.): Lehrbuch der Molekularen Zellbiologie. Wiley-VCH; 3. vollständig überarbeitete Auflage 2005; ISBN 978-3-527-31160-6
- Rolf Knippers: Molekulare Genetik. Thieme, Stuttgart; 9., kompl. überarb. Auflage 2006; ISBN 978-3-13-477009-4