Korrosionselement
Ein Korrosionselement ist eine Gefügeanordnung in einem Bauteil, die sich wie eine kurzgeschlossene galvanische Zelle verhält und zur Korrosion des Werkstoffs führt.
Varianten
Korrosionselemente unterscheiden sich im Aufbau der Komponenten, die als Anode, Kathode und Elektrolyt fungieren. Ihnen gemeinsam ist die elektrische Anordnung: Anode und Kathode sind sowohl über den Elektrolyten als auch durch direkten Kontakt elektrisch leitend miteinander verbunden. Eine externe Spannungsquelle ist dabei nur im letzten Fall im Spiel:
Selektive Korrosion
Selektive Korrosion tritt auf an Kristalliten in einem Legierungsgefüge, die aus Verbindungen mit unterschiedlichem elektrochemischen Potential bestehen, z. B. an Kupfer- und Zink-Kristalliten in Messing, die an der Oberfläche über einen Wasserfilm miteinander reagieren. Bei der selektiven Korrosion verläuft der Korrosionsangriff bevorzugt (selektiv) entlang bestimmter Gefügebereiche des Werkstoffs. Nach dem Bereich des zerstörten Gefüges unterscheidet man:
- Interkristalline Korrosion, wenn die Zerstörung entlang der Korngrenzen verläuft,
- Transkristalline Korrosion, wenn sie durch die Körner läuft oder in Verbindung damit kommt.
Da die selektive Korrosion im Korngrößenbereich auftritt, ist sie mit bloßem Auge nicht erkennbar und deshalb besonders gefährlich. Anzeichen: Absätze auf der Korrosionsschicht (bläulich unter Lupe erkennbar).
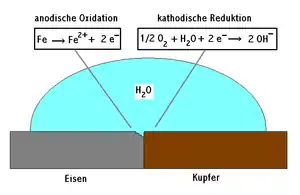
Kontaktkorrosion
Kontaktkorrosion entsteht, wenn zwei Metalle mit unterschiedlichem Lösungspotenzial durch einen Elektrolyt (Wasser, feuchte Luft ...) leitend verbunden sind. Dabei wird das unedlere Metall zur Anode und das edlere zur Kathode. Diese zusätzliche Polarisierung führt zu einer beschleunigten Auflösung der Anode.
Beispiele: Schraube aus Kupfer in einem Aluminiumblech, Edelstahlblech mit Stahlblech verschraubt.
Das Ausmaß der Kontaktkorrosion wird minimiert, wenn:
- die Potenzialdifferenz ein Minimum annimmt,
- die beteiligten Metalle korrosionshemmende Deckschichten ausbilden,
- die Leitfähigkeit des Elektrolyten minimal ist.
Die Flächenverhältnisse der Elektroden beeinflussen die Stromdichten und somit auch die Korrosionsgeschwindigkeit. Bei der weit verbreiteten Sauerstoffkorrosion ist der kathodische Umsatz (und somit auch die Kathodenstromdichte) durch Diffusions- und Konvektionsvorgänge begrenzt. Minimale anodische Auflösungsstromdichten können daher über folgendes Flächenverhältnis realisiert werden:
Da Kontaktkorrosion in der Regel nur geringe Reichweiten (< 5 mm) hat, sind die Flächenverhältnisse von untergeordneter Bedeutung.
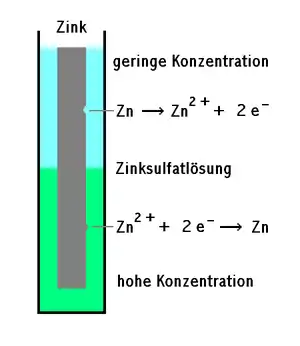
Konzentrationselement
Dieses besteht aus einer Metalloberfläche, benetzt von einem Elektrolyten mit lokal unterschiedlicher Konzentration, z. B. in einem Spalt. Die Oxidation des Metalls findet dabei im Bereich mit der geringeren Konzentration des Elektrolyten statt, die Reduktion im Bereich mit der höheren Konzentration.
Ein Belüftungselement ist ein Konzentrationselement, bei dem der Sauerstoffgehalt im Elektrolyten variiert.
Mechanische Spannungen
Ein homogenes Gefüge, das lokal verformt wurde bzw. lokal unter Spannung steht, begünstigt Korrosion. Beispiele: Spannungsrisskorrosion, Schwingungsrisskorrosion.
Fremdspannungskorrosion
Fremdspannungskorrosion tritt auf bei einer Potentialdifferenz im Material, hervorgerufen durch äußere Spannungsquellen. Beispiel: Metallrohre, verlegt in der Nähe von elektrischen Gleichspannungsleitungen (siehe auch Opferanode).
Chemische Reaktionen
Im Allgemeinen oxidiert die Anode und löst sich auf. Die Reaktionen an der Kathode hängen u. a. vom pH-Wert und der Sauerstoffkonzentration ab. e− bezeichnet Elektronen, H+ bezeichnet Protonen und Me bezeichnet Metallatome oder -ionen.
Anodenreaktion:
- Meunedel → Meunedel+ + e−
Kathodenreaktion:
- (1) Falls Metallionen vorliegen, die edler sind als die der Anodenreaktion, scheiden sie sich auf der Kathode ab:
- Meedel+ + e− → Meedel
- (2) In saurem Milieu (pH-Wert < 5) bildet sich Wasserstoff:
- 2 H+ + 2 e− → H2
- (3) In saurem Milieu entsteht Wasser, wenn Sauerstoff vorhanden ist:
- O2 + 4 H+ + 4 e− → 2 H2O
- (4) In basischem Milieu (pH-Wert > 7) reagiert Wasser zu Hydroxid:
- 2 H2O + 2 e− → H2 + 2 OH−
- (5) Wie (4), in Anwesenheit von Sauerstoff:
- O2 + 2 H2O + 4 e− → 4 OH−
Literatur
- Fonds der Chemischen Industrie: Korrosion / Korrosionsschutz. Folienserie und Textheft Nr. 8, Frankfurt am Main 1994, DNB 948212381.
- Elsbeth Wendler-Kalsch, Hubert Gräfen: Korrosionsschadenkunde. Springer Verlag, Berlin/ Heidelberg 2012, ISBN 978-3-642-30431-6.
- Ulrich Bette, Markus Büchler: Taschenbuch für den kathodischen Korrosionsschutz. 8. Auflage, Vulkan-Verlag GmbH, Essen 2010, ISBN 978-3-8027-2556-2
Weblinks
- Ausgewählte Korrosionselemente und deren Reaktionen (abgerufen am 10. September 2018)
- Der Begriff Korrosion (abgerufen am 10. September 2018)
- Elektrochemische Korrosionselement (abgerufen am 10. September 2018)
- GALVANISCHE KORROSION – GRUNDLAGEN BERÜCKSICHTIGEN UND RICHTIG EINSCHÄTZEN (abgerufen am 10. September 2018)
- Korrosion und Korrosionsschutz (abgerufen am 10. September 2018)