Wasserstoffelektrode
Der Begriff Wasserstoffelektrode wird allgemein für Elektroden verwendet, an denen Wasserstoffgas H2 entwickelt oder verbraucht wird. Die Wasserstoffelektrode ist ein wichtiges Hilfsmittel für Messungen in der Elektrochemie und der Physikalischen Chemie: Sie ist eine der wichtigsten Referenzelektroden, das heißt, sie dient zur Bestimmung des Potentials anderer Elektroden durch eine einfache Spannungsmessung. Das Potential ist die wichtigste Größe zur Beschreibung des elektrochemischen Zustands einer Elektrode.
Besonders bedeutsam sind die Normal- (NHE) und die Standardwasserstoffelektrode (SHE), da deren Potential als Nullpunkt der Standardpotentialskala definiert ist. Das Potential von Wasserstoffelektroden wird durch die Reaktion:
beschrieben.
Standard-Wasserstoffelektrode (SHE)
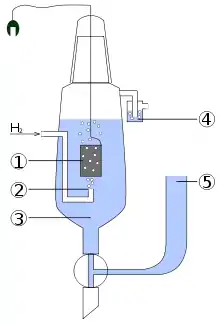
1 – platinierte Platinelektrode
2 – Wasserstoffeinstrom
3 – Lösung mit Säure (H+=1 mol/l)
4 – Abschluss zur Vermeidung von Störungen durch Sauerstoff
5 – Reservoir
Die Standardwasserstoffelektrode (engl. Standard Hydrogen Electrode, kurz SHE) ist auf eine Ionen-Aktivität von 1 mol/l und einem Wasserstoff-Druck von 1013 hPa bei jeder Temperatur normiert. Sie dient zunächst wie jede Bezugselektrode dem Zweck, ein genau definiertes Potential zu liefern. Darüber hinaus ist sie zur Bestimmung von Standardpotentialen besonders geeignet, da ihr Potential definitionsgemäß der Nullpunkt der Potentialskala ist. Das absolute Elektrodenpotential der Wasserstoffelektrode beträgt bei 298,15 K nach IUPAC-Empfehlung 4,44±0,02 V.[1]
Im Gegensatz zur Standardwasserstoffelektrode arbeitet die Normalwasserstoffelektrode (NHE = Normal Hydrogen Electrode) mit der Ionen-Konzentration des Wasserstoffs unter ansonsten gleichen Bedingungen.
Aufbau und Funktion
Dem Potential der Wasserstoffelektrode liegt folgende Reaktion zugrunde:
Das technische Problem bei einer Wasserstoffelektrode ist, dass Wasserstoff als Gas weder Elektrodenform annehmen kann, noch elektrisch leitet. Daher verwendet man eine Hilfselektrode in Form eines neutralen Edelmetalls (Platin). Diese wird mit Wasserstoffgas umspült, das an der Platinoberfläche adsorbiert und dieses mit einer hauchdünnen Schicht von Wasserstoffatomen überzieht. Somit erhält man einen "Wasserstoffblock", der im Inneren aus Platin besteht – die Wasserstoffelektrode.
Die Standard-Wasserstoffelektrode, die den Nullpunkt der Standardpotentialskala festlegt, besteht daher aus einem platinierten (d. h. elektrolytisch mit Platinmohr überzogenem) Platinblech, das in eine Säure-Lösung mit einer Ionenaktivität der Protonen von eintaucht. Die Platinelektrode wird von Wasserstoffgas bei einem Druck von 1013 hPa und einer Temperatur von 298,15 K umspült. Das Wasserstoffgas adsorbiert teilweise am Platin, bildet ein Gleichgewicht mit den Wasserstoffionen der Säure und legt so das elektrochemische Potential fest.
Das elektrische Potential, das sich an dieser Elektrode bildet, ist das Standardpotential, das als identisch Null definiert wird.
Bedeutung und Handhabung
Da Standardpotentiale relativ zur Standard-Wasserstoffelektrode gemessen werden, hat diese Elektrode eine große Bedeutung für die Physikalische Chemie. Ihre Handhabung ist jedoch sehr umständlich: Zum einen erfordert sie den Umgang mit Wasserstoffgas, wobei durch geschlossene Gefäße die Knallgasbildung vermieden werden muss. Eine sauerstofffreie Atmosphäre im Elektrolytgefäß ist auch nötig, da Sauerstoff das Potential der Elektrode verfälschen kann. Zum anderen ist eine Platinelektrode anfällig für Verunreinigungen, so dürfen keine Fettspuren z. B. von Fingerabdrücken vorhanden sein; um eine hohe katalytische Aktivität zu sichern, sollte sie neu platiniert werden. Für genaue Messungen ist zudem die Druckkontrolle gefordert. Aus diesen Gründen werden Wasserstoffelektroden für Routineuntersuchungen kaum verwendet, ebenso eher selten für Forschungsarbeiten, außer diese zielten darauf ab, Standardpotentiale zu bestimmen. Viel häufiger wurden Kalomel- oder Silber-Silberchlorid-Elektroden (Ag/AgCl) benutzt, bei denen keine gasförmigen Reaktanten auftreten, sodass praktisch keine Druckabhängigkeit auftritt. Heute werden vorwiegend Ag/AgCl-Elektroden eingesetzt, um das giftige Kalomel zu vermeiden. Sie sind im Gegensatz zu Wasserstoffelektroden auch kommerziell in vielen verschiedenen Varianten messfertig erhältlich.
Normal-Wasserstoffelektrode (NHE)
Im Experiment können die Standardbedingungen der SHE nicht eingestellt werden. Dazu zählt die Aktivität der Protonen und der Gasdruck von 1013 hPa. Daher wird empfohlen, als Elektrolyt eine 1 mol/l Salzsäure sowie Wasserstoffgas bei atmosphärischen Bedingungen einzusetzen. In diesem Fall spricht man von der Normal-Wasserstoffelektrode. Die Abweichungen zur SHE sind minimal, aber aufgrund der Nernst-Gleichung pH-abhängig.
Reversible Wasserstoffelektrode (RHE)
Für manche elektrochemischen Untersuchungen werden auch Wasserstoffelektroden verwendet, die bei Umgebungsdruck betrieben werden; die Wasserstoffelektroden für die Wasserelektrolyse arbeiten oft bei Überdruck. Für Untersuchungen in Säuren oder Laugen benutzt man manchmal auch eine Wasserstoffelektrode in derselben Lösung wie die zu messende Elektrode; sie ist nicht durch eine Salzbrücke getrennt. Auf diese Weise kann man erreichen, dass sich das gemessene Potential nicht mit dem pH-Wert ändert.
Bei der Elektrolyse von Wasser treten Überspannungen auf: Die benötigte Zellspannung ist aufgrund kinetischer Hemmung höher als die Gleichgewichtsspannung. Die Überspannung steigt mit zunehmender Stromdichte an den Elektroden. Die Messung von Gleichgewichtspotentialen erfolgt daher möglichst stromlos.
Siehe auch
Weblinks
Einzelnachweise
- Eintrag zu standard hydrogen electrode. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S05917.