Prinzip vom kleinsten Zwang
Das Prinzip von Le Chatelier, auch Prinzip vom kleinsten Zwang genannt, wurde von Henry Le Chatelier[1] und Ferdinand Braun[2] zwischen 1884 und 1888 formuliert:
- „Übt man auf ein chemisches System im Gleichgewicht einen Zwang aus, so reagiert es so, dass die Wirkung des Zwanges minimal wird.“
oder genauer gesagt:
- „Übt man auf ein System, das sich im chemischen Gleichgewicht befindet, einen Zwang durch Änderung der äußeren Bedingungen aus, so stellt sich infolge dieser Störung des Gleichgewichts ein neues Gleichgewicht, dem Zwang ausweichend, ein.“
Das Prinzip ist somit sehr allgemein gefasst, sodass es keine quantitativen Aussagen zulässt. Trotzdem findet es häufig Anwendung, da eine qualitative Vorhersage in vielen Bereichen für erste Schritte ausreichend ist. Des Weiteren ist es sehr leicht anwendbar.
Beispiele:
- Dem Zwang Temperaturerhöhung bzw. -erniedrigung wird mit Wärmeverbrauch bzw. -erzeugung ausgewichen.
- Wird für eine Mischung aus Flüssigkeit und Gas der Druck erhöht (Zwang), so geht ein Teil des Gases in die flüssige Phase über (geringere Teilchenabstände → weniger in der Gasphase)
„Zwänge“ sind in diesem Sinne Änderungen von Temperatur, Druck oder Stoffmengenkonzentration:
- Erhöht man die Temperatur, wird die wärmeliefernde Reaktion zurückgedrängt und umgekehrt.
- Erhöht man den Druck, weicht das System so aus, dass die volumenverkleinernde Reaktion gefördert wird, und umgekehrt.
- Ändert man die Konzentration, z. B. indem man ein Produkt aus dem Ansatz entfernt, so reagiert das Gleichgewichtssystem, indem dieses Produkt nachproduziert wird.
Die Richtigkeit dieses Konzepts kann sowohl empirisch, also im Experiment, als auch durch Berechnungen von Temperatur-, Druck- und Konzentrationsabhängigkeit der freien Reaktionsenthalpie bestätigt werden.
Temperaturänderung
Wärmezufuhr und Wärmeentzug bewirken eine Gleichgewichtsverschiebung, d. h. die Einstellung eines neuen Gleichgewichts mit veränderten Konzentrationen. Wärmeentzug begünstigt die Wärme liefernde (exotherme) Reaktion, Wärmezufuhr die Wärme verbrauchende (endotherme) Reaktion. Dadurch fällt die Temperaturänderung des Systems geringer aus als ohne Gleichgewichtsverschiebung.
Eine Temperaturänderung führt immer zu einer Änderung der Gleichgewichtskonzentrationen. Welche Konzentration dabei zunimmt bzw. abnimmt, hängt davon ab, ob die Bildung der Produkte exotherm oder endotherm ist:
| Störung | Art der Reaktion | Zunahme der |
| Temperaturerhöhung | exotherm | Edukte |
| endotherm | Produkte | |
| Temperaturerniedrigung | exotherm | Produkte |
| endotherm | Edukte |
Als Beispiel kann das Gasgemisch aus dem Gleichgewicht zwischen dem braunen Stickstoffdioxid und dem farblosen Distickstofftetroxid dienen:
Die Enthalpie der Hinreaktion beträgt , d. h. es handelt sich um eine exotherme Reaktion, da Energie frei wird. Die Rückreaktion ist endotherm: .
Erhöht man nun die Temperatur bei konstantem Volumen, wird die Reaktion in die entgegengesetzte, also in die endotherme Richtung ablaufen, womit sich das Gleichgewicht nach links verschiebt, das Gasgemisch wird dunkler. Temperatursenkung bewirkt die exotherme Reaktion, wodurch sich das Gleichgewicht nach rechts verschiebt und das Gasgemisch sich aufhellt.
Volumen- oder Druckänderung
Das chemische Gleichgewicht von Reaktionen, an denen keine Gase beteiligt sind, wird kaum durch eine von außen bewirkte Volumenänderung beeinflusst. Sind hingegen gasförmige Stoffe beteiligt, wird das Gleichgewicht nur dann beeinflusst, wenn sich die Teilchenzahl in der Gasphase durch die Gleichgewichtsverschiebung ändert.
Eine Druckänderung wirkt sich nur in einem geschlossenen System auf das Gleichgewicht aus. Je nach Reaktionsbedingung kann man eine Druckänderung oder eine Volumenänderung feststellen: Das System verringert den durch eine Volumenverkleinerung erzeugten Druck, indem es zugunsten der Seite abläuft, die die geringere Teilchenzahl aufweist und somit das kleinere Volumen benötigt. Dadurch fällt die Druckerhöhung weniger stark aus als wenn die Gase zu keiner Reaktion fähig wären. Entsprechend verschiebt eine Volumenvergrößerung das Gleichgewicht in Richtung größerer Teilchenzahlen.
Die Lage des Gleichgewichts kann durch eine Druckerhöhung von außen beeinflusst werden:
- bei konstantem Reaktionsvolumen durch weitere Zufuhr von Edukten
- bei veränderlichem Reaktionsvolumen durch Kompression.
Findet die Reaktion in einem offenen System statt, kann das bei der Reaktion entstehende Gas ständig entweichen. Dadurch wird ständig neues Gas produziert, das wiederum entweicht. Diese Störung des Gleichgewichts führt dazu, dass es sich nicht einstellen kann: die Reaktion verläuft vollständig zur Produktseite.
Eine bekannte Reaktion ist die Herstellung von Ammoniak im Haber-Bosch-Verfahren aus Stickstoff und Wasserstoff[3]:
Es entstehen also aus 4 Gasmolekülen auf der Eduktseite links, 2 Gasmoleküle auf der Produktseite rechts. Wird nun der Druck erhöht, weicht das System auf die volumenverkleinernde Seite – also diejenige mit weniger Molekülen – aus. Somit lässt sich durch Druckerhöhung die Bildung von Ammoniak begünstigen.
Das gleiche Prinzip lässt sich auch auf das Stickstoffdioxid-Distickstofftetroxid-Gleichgewicht übertragen.
Stoffmengenänderung
Durch Zufuhr bzw. Wegnahme eines Reaktionspartners wird das Gleichgewicht gestört, die Reaktion läuft folglich, bis das Gleichgewicht wieder erreicht ist, vermehrt in eine Richtung. Verändert man die Konzentration von einem der am Gleichgewicht beteiligten Stoffe, ändern sich dadurch auch die Konzentrationen aller anderen Partner. Soll eine Gleichgewichtsreaktion vollständig zugunsten eines Produkts ablaufen, genügt es, eines der Edukte aus dem Reaktionsgemisch zu vervielfachen oder eines der Produkte aus dem Reaktionsgemisch zu entfernen. Die Rückreaktion wird dadurch solange unterbunden, bis das ursprüngliche Gleichgewicht wiederhergestellt ist.
Da das Gleichgewicht nur von der Temperatur und gegebenenfalls vom Druck abhängt, erfolgt die Reaktion nach der Veränderung der Konzentration so, dass das ursprüngliche Gleichgewicht wiederhergestellt wird. Für eine Gleichgewichtsreaktion:
mit
lassen sich dabei folgende Fälle unterscheiden:
| Änderung | bewirkt |
| Zugabe von A bzw. B | Zunahme der Produkte |
| Zugabe von C bzw. D | Zunahme der Edukte |
| Entzug von A bzw. B | Abnahme der Produkte |
| Entzug von C bzw. D | Abnahme der Edukte |
Eine Änderung der Reaktionsbedingungen Temperatur und Druck führt zu einer Verschiebung des Gleichgewichts und somit zu einer Änderung der Gleichgewichtskonzentrationen.
Der Einfluss von Änderungen der Stoffmenge auf die Lage eines Gleichgewichts lässt sich an der Veresterung von Carbonsäuren bzw. der Hydrolyse von Carbonsäureestern verdeutlichen.
Wenn eine Carbonsäure in einem Alkohol gelöst wird, befindet sich das System zunächst nicht im Gleichgewicht. Hat sich das Gleichgewicht eingestellt (z. B. nach Zugabe eines Katalysators oder nach – sehr langem – Warten) so hat sich die Menge des Alkohols auf Grund des großen Überschusses kaum verändert; es hat sich der Ester und eine entsprechende Menge Wasser gebildet und es ist eine sehr kleine Menge Carbonsäure übrig. Entzieht man zusätzlich dem Gleichgewicht durch Abdestillation beispielsweise den Ester, so wird aufgrund des Massenwirkungsgesetzes der Ester nachgebildet. Die Zugabe von Schwefelsäure als Katalysator kann durch Bindung des entstehenden Wassers ebenfalls das Gleichgewicht beeinflussen. Man kann also auf diese Weise die Ausbeute an Ester bezogen auf die Carbonsäure sehr gut optimieren.
Andererseits bewirkt eine Zugabe von Wasser zum Reaktionsgemisch eine Störung des Gleichgewichtes, sodass die Esterspaltung (=Hydrolyse) bevorzugt abläuft.
Das bedeutet, dass man durch Zugabe einer Komponente im Überschuss (Alkohol bzw. Wasser) steuern kann, welches Produkt (Ester oder Säure) im Gleichgewicht überwiegt.
Weitere Beispiele:
Kombination aus Temperatur-, Druck- und Stoffmengenänderung
Ein sehr gutes Beispiel für den Einfluss der äußeren Bedingungen auf einen Produktionsprozess ist das oben angedeutete Haber-Bosch-Verfahren. Wie beschrieben vergrößert die Druckerhöhung die Produktausbeute. Da aber die Reaktion eine hohe Aktivierungsenergie benötigt und die Reaktion exotherm ist, wird das Gleichgewicht durch die hohe Temperatur auf die Seite der Edukte, also zu den höheren Volumina, verschoben. Bei der Prozessoptimierung muss also eine optimale Kombination aus Druck und Temperatur gefunden werden. Beim Haber-Bosch-Verfahren wird diese Reaktion daher bei ca. 300 bar Druck und einer Temperatur von 550 °C durchgeführt. Zusätzlich wird die Ausbeute durch Entzug des Ammoniaks, also die Verringerung dessen Stoffmenge im Reaktionsgemisch, erhöht.
Einfluss von Licht
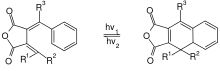
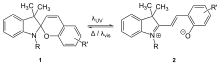
Ein photostationäres Gleichgewicht[4] ist ein Zustand, der durch Lichteinstrahlung im sichtbaren oder ultravioletten Bereich erzeugt wird. Beispiele hierfür sind photochrome Gleichgewichte mit bestimmten Farbstoffen. Je nach Lichteinstrahlung ändert sich der Gleichgewichtszustand und damit die Farbe. Die Rückreaktion kann entweder durch Licht- oder Wärmeabgabe erfolgen. Bestrahlt man z. B. farbloses Spiropyran mit UV-Licht, so tritt unter Bildung von Merocyanin, eine isomere Verbindung des Spiropyrans, eine intensive Blaufärbung auf. In diesem Fall spricht man auch von einem Isomeren-Gleichgewicht. Die Gleichgewichtseinstellung ist in der Regel auch von der Wellenlänge des Lichtes abhängig. So färbt sich das orange Triphenyl-Fulgid bei Bestrahlung mit kurzwelligem Licht bläulich, bei Bestrahlung mit rotem Licht stellt sich wieder die ursprüngliche Farbe ein.
Weblinks
- Nähere Informationen und Beispiele (Prof. Blumes Bildungsserver für Chemie)
- Video: Prinzip von LE CHATELIER BRAUN – Wie lassen sich Gleichgewichte verschieben?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15668.
Einzelnachweise
- le Châtelier, H.-L.: [A general statement of the laws of chemical equilibrium]. In: Comptes rendus hebd. Seanc. Acad. Sci. Paris. Band 99, 1884, S. 786–789.
- Braun, F.: Untersuchungen über die Löslichkeit fester Körper und die den Vorgang der Lösung begleitenden Volum- und Energieänderungen. In: Z. Phys. Chem. 1U, Nr. 1, 1887, S. 259–272, doi:10.1515/zpch-1887-0131.
- Wiberg, Egon., Wiberg, Nils,: Lehrbuch der anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Simone Krees: Chemisches Gleichgewicht und photostationäres Gleichgewicht. Praxis der Naturwissenschaften Chemie, 2/61, Aulis Verlag, März 2012, S. 18–24.