Frost-Diagramm
Ein Frost-Diagramm (auch: Frostdiagramm, seltener Frost-Ebsworth-Diagramm) ist eine grafische Darstellung von Reduktionspotentialen von Halbreaktionen – jeweils für die verschiedenen Oxidationsstufen eines Elements. Sie wurden von Arthur Frost im Jahre 1951 als Alternative zu Latimer-Diagrammen vorgeschlagen[1] und 1964 durch Ebsworth bekannter gemacht.[2] Es wird ein kartesisches Koordinatensystem verwendet, wobei auf der Abszisse die Oxidationszahl steht und auf der Ordinate üblicherweise -Werte der Halbreaktion einer Oxidationsstufe zur Oxidationsstufe 0 (z. B.: ). Der Wert ist direkt proportional zur freien Enthalpie nach:
wobei die Zahl der übertragenen Elektronen und die Faraday-Konstante ist.
Es finden sich auch Frost-Diagramme, in welchen freie Enthalpien statt des -Werts aufgetragen sind. Die Potentialdaten können sich auf elektrochemische Standardbedingungen ( ) beziehen oder auf beliebige andere angegebene Bedingungen (beispielsweise ).
Erstellen
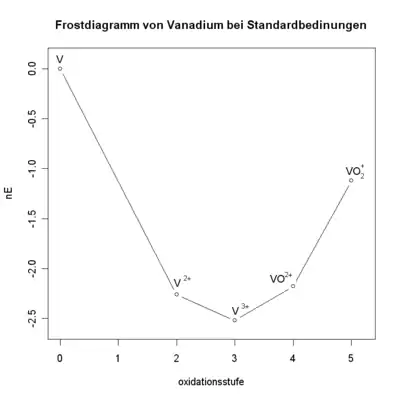
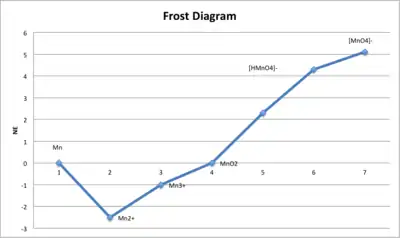
Diagramm für Vanadium in saurer Lösung ():
- Es werden die Standard-Potentiale von den relevanten Redox-Gleichgewichten aus einem Tabellenwerk entnommen:
- Daraus werden die -Werte ermittelt:
- Die Werte werden in ein Koordinatensystem eingetragen.
Interpretation
Aus dem Diagramm lassen sich Informationen über spezielle Redox-Vorgänge gewinnen, sobald eine Oxidationsstufe auf einem Extremwert liegt. Befindet sich eine Verbindung im Frost-Diagramm auf einem Maximum, ist der Zerfall in die beiden Stufen links und rechts davon (Disproportionierung) sehr wahrscheinlich. Liegt eine Verbindung jedoch auf einem Minimum, ist die Reaktion von den beiden benachbarten Verbindungen zu ebendieser Oxidationsstufe (Komproportionierung) sehr wahrscheinlich.
Eine Disproportionierung liegt vor, wenn Dithionat zu Sulfat und Sulfit (bzw. Schwefeltrioxid und Schwefeldioxid in wässriger Lösung) reagiert. Beispielhaft für eine Komproportionierung ist die Reaktion von und zu (siehe Beispieldiagramm).
Quellen
- Arthur Atwater Frost: Oxidation Potential-Free Energy Diagrams. In: American Chemical Society ACS (Hrsg.): Journal of the American Chemical Society (JACS). Band 73, Nr. 6, 1951, S. 2680–2682, doi:10.1021/ja01150a074 (englisch).
- Evelyn Algernon Valentine Ebsworth: A Graphical Method Representing the Free Energies of Oxidation-Reduction Systems. In: RSC (Hrsg.): Education in Chemistry. Band 1, 1964, S. 123.
Weblinks
- 11.2. Hilfsmittel zur Darstellung von Redox-Gleichgewichten: Frost-Diagramme, LMU
- 6.5.1. Sauerstoffsäuren des Stickstoffs – Abbildung 6.5.1.: Frostdiagramm der N-O-Spezies (SVG-Datei), Albert-Ludwigs-Universität Freiburg
- Catherine E. Housecroft, Alan G. Sharpe: Inorganic Chemistry. 2. Auflage. Pearson Education, Harlow 2005, ISBN 978-0-13-039913-7, 7.6 Frost-Ebsworth diagrams, S. 205–207 (englisch, eingeschränkte Vorschau in der Google-Buchsuche – Hilfe zur Interpretation eines Frost-Diagramms).