Latimer-Diagramm
Latimer-Diagramme, auch Potentialdiagramme genannt, sind eine Darstellung von Reduktionspotentialen von Halbreaktionen, jeweils für die verschiedenen Oxidationsstufen eines Elements. Üblicherweise steht das Element in seiner größten Oxidationszahl ganz links, nach rechts nimmt die Oxidationszahl ab. Die einzelnen Stufen sind mit Pfeilen verbunden, über denen das Reduktionspotential der Halbreaktion steht. Diese können sich auf Standardbedingungen (25 °C, pH = 0, c = 1 mol·l−1) beziehen oder auf beliebige andere angegebene Bedingungen (z. B. pH = 14).
Das Diagramm ist nach dem US-amerikanischen Chemiker Wendell Mitchell Latimer (1893–1955) benannt.
Beispiele
Diagramm für Chlor in saurer Lösung (pH = 0)
Soll nun die ausführliche Reduktionsreaktionsgleichung für den ersten Schritt aufgeschrieben werden, muss die Halbreaktion bezüglich der Ladung und auch stöchiometrisch ausgeglichen werden:
Diagramm für Selen bei Standardbedingungen (pH = 0, 25 °C, 105 Pa)
Latimer-Diagramm für Sauerstoff
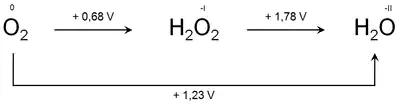
Das Potentialdiagramm für Sauerstoff, Wasserstoffperoxid und Wasser ist rechts gezeigt; die Oxidationszahlen der Sauerstoffatome (0, −1 und −2) sind angegeben.
Das erste Potential, 0,68 V, gilt für die Reduktion des Sauerstoffs zu Wasserstoffperoxid, also für die Reaktion
.
Die zweite Gleichgewichtsreaktion ist die Reduktion von Wasserstoffperoxid zu Wasser mit einem Potential von 1,78 V: .
Das auf dem unteren Pfeil angegebene Potential gilt für die Reduktion von Sauerstoff zu Wasser, also für die Reaktion
.
Das Potential dieser Reaktion, 1,23 V, entspricht auch der Zersetzungsspannung von Wasser und ist der Mittelwert der beiden Einzelpotentiale 0,68 V und 1,78 V, da bei diesen Reaktionen dieselbe Zahl an Elektronen ausgetauscht wird. Wasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen, es disproportioniert. Das erkennt man im Potentialdiagramm daran, dass das rechte Potential, 1,78 V, höher ist als das linke.
Anwendung
Anhand eines Latimer-Diagrammes kann man leicht erkennen, ob eine Oxidationsstufe in Lösung instabil ist und zur Disproportionierung neigt: Wenn – wie üblich – die höchste Oxidationsstufe links steht, wird eine Spezies disproportionieren, wenn das Potential links von ihr kleiner ist als das rechts von ihr. Dementsprechend ist Wasserstoffperoxid instabil.
Möchte man das Potential einer Reaktion bestimmen, bei der sich die Oxidationszahl um mehrere Einheiten ändert, so darf man die Redoxpotentiale der dazwischenliegenden Schritte nicht addieren. Stattdessen muss ein Mittel gebildet werden, dessen Beiträge mit der Zahl der jeweils ausgetauschten Elektronen gewichtet wírd:[1]
Siehe auch
- Frost-Diagramm, eine graphische Darstellung der Zahlenwerte des Latimer-Diagramms
- Pourbaix-Diagramm, das die Potentialwerte für verschiedene pH-Werte darstellt
Literatur
- Wendell Mitchell Latimer: The Oxidation States of the Elements and their Potentials in Aqueous Solutions. Prentice-Hall, New York 1938.