Citrat-Shuttle
Das Citrat-Shuttle (auch Citrat-Malat-Shuttle oder Citrat-Malat-Pyruvat-Zyklus) ist ein Transportmechanismus für das Salz der Citronensäure über die innere Mitochondrienmembran. Dabei wird ein Acetylrest auf Oxalacetat übertragen. Das resultierende Citrat stellt die eigentliche Transportform dar. Das Citrat-Shuttle spielt eine wichtige Rolle bei anabolen Stoffwechselvorgängen wie etwa der Fettsäuresynthese und ist eine alternative Quelle für die Bereitstellung von NADPH.
Der Transportmechanismus wurde 1965 von Melodee S. Kornacker und Eric G. Ball nach Experimenten an Ratten postuliert, weswegen er auch vereinzelt als Ball-Zyklus bezeichnet wird.[1]
Grundlagen
Acetyl-CoA („aktivierte Essigsäure“) ist die übliche Form, in der Essigsäure im Körper vorliegt. Es wird für zahlreiche biochemische Prozesse im Cytosol, z. B. bei der Fettsäuresynthese, benötigt, entsteht jedoch – z. B. im Zuge der β-Oxidation – vorwiegend in der Matrix des Mitochondriums. Die innere Mitochondrienmembran ist jedoch undurchlässig für Acetyl-CoA, so dass es nicht durch die Membran diffundieren kann. Außerdem kann Acetat – im Gegensatz zu langkettigen Fettsäuren – nicht mittels Carnitin transportiert werden. Daraus ergibt sich die Notwendigkeit eines eigenen Transportmechanismus für Acetat.
Mechanismus
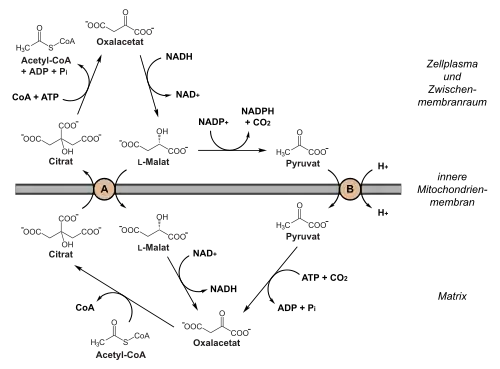
In der Matrix werden zunächst Oxalacetat und Acetyl-CoA durch das Enzym Citrat-Synthase zu Citrat kondensiert. Das gebildete Citrat wird durch einen Antiporter, den Tricarboxylat-Carrier (A, vergleiche Abbildung), aus der Matrix des Mitochondriums transportiert, dabei gelangt pro Molekül Citrat ein Molekül Malat in die Matrix. Auf der cytosolischen Seite spaltet das Enzym ATP-Citrat-Lyase Citrat unter ATP-Verbrauch wieder in Oxalacetat und Acetyl-CoA. Das Oxalacetat wird anschließend durch das Enzym Malat-Dehydrogenase und NADH zu Malat reduziert. Das gebildete Malat kann nun direkt durch den Antiporter wieder in das Mitochondrium gelangen, wo es zu Oxalacetat oxidiert wird und sich der Kreis schließt. Alternativ wird das Malat zu Pyruvat durch ein NADP-abhängiges Malatenzym oxidativ decarboxyliert, über einen Pyruvat/H+-Symporter (B) in die Matrix transportiert und dort – unter Verbrauch eines Moleküls ATP – wieder zu Oxalacetat carboxyliert. Dadurch schließt sich der Kreislauf ebenfalls.
Beim ersten Weg (direkter Transport des Malats) wird für den Transport eines Acetat-Moleküls ein Molekül ATP verbraucht, beim zweiten Weg (Rücktransport über Pyruvat) sind es zwei ATP und zusätzlich wird ein Molekül NADP+ in ein Molekül NADPH reduziert. Neben dem Pentosephosphatweg und dem Citrat-Zyklus (Umwandlung von Isocitrat zu Oxalsuccinat) ist dies die einzige Möglichkeit, NADPH zu generieren.[2]
Einzelnachweise
- Kornacker, MS. und Ball, EG. (1965): Citrate cleavage in adipose tissue. In: Proc Natl Acad Sci USA. Band 54, Nummer 3, September 1965, S. 899–904, PMID 4379378, PMC 219762 (freier Volltext).
- David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8; S. 1076.
Literatur
- Werner Müller-Esterl et al.: Biochemie, eine Einführung für Mediziner und Naturwissenschaftler. Spektrum Akademischer Verlag, 2004, ISBN 3827405343