Glyoxylatzyklus
Der Glyoxylatzyklus ist ein Stoffwechselweg, der die Synthese von C4-Kohlenhydraten aus zwei Molekülen Acetyl-CoA ermöglicht. Bei einem vollständigen Zyklus wird so ein Molekül Succinat gebildet. Er ähnelt dem Citratzyklus und kommt bei Pflanzen, Pilzen, vielen Bakterien und manchen Invertebraten vor, jedoch nicht bei Wirbeltieren.[1] Der Stoffwechselweg wird auch als Krebs-Kornberg-Zyklus bzw. Krebs-Kornberg-Beevers-Zyklus nach seinen Entdeckern Hans Adolf Krebs, Hans Leo Kornberg und Harry Beevers bezeichnet.[2][3]
Alternative Stoffwechselwege zur Assimilation von Acetat sind der Ethylmalonyl-CoA-Weg und der Methylaspartatzyklus.
Biochemie
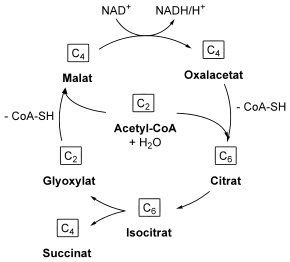
Wie im Citratzyklus beginnt der Glyoxylatzyklus mit der Kondensation eines Moleküls Acetyl-CoA mit Oxalacetat, wodurch Citrat entsteht. Diese Reaktion wird durch eine Citratsynthase katalysiert. Das Citrat wird durch eine Aconitase in Isocitrat überführt.
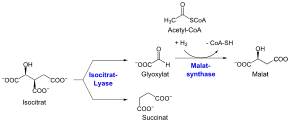
Durch zwei Folgereaktionen werden nun die Decarboxylierungsschritte des Citratzyklus umgangen. Zum einen katalysiert eine Isocitratlyase (EC 4.1.3.1) die Spaltung des Isocitrates zu Succinat und Glyoxylat. Dieses wird dann zum anderen durch eine Malatsynthase (EC 2.3.3.9) mit einem weiteren Molekül Acetyl-CoA zu Malat kondensiert. Da der CoA-Thioester hydrolysiert wird, ist diese Reaktion irreversibel. Der Kreis schließt sich, wenn das Malat zu Oxalacetat durch eine Malatdehydrogenase oxidiert wird, dabei wird auch NADH gewonnen.
Die Nettoreaktion für die Umwandlung zweier Moleküle Acetyl-CoA in Succinat lautet:
Da das freiwerdende Succinat in den Citratzyklus eingespeist werden kann, ist der Glyoxylatzyklus ein Beispiel einer anaplerotischen Reaktion.[1]
Regulation
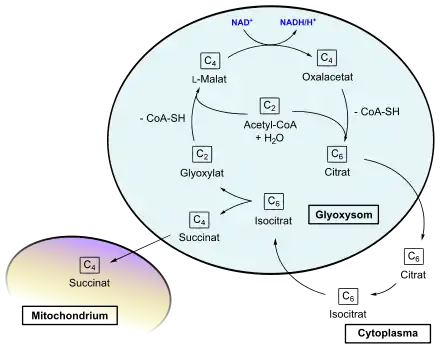
Bei Pflanzen findet eine Kompartimentierung der Reaktion statt. Der Hauptteil der Reaktionen ist in spezialisierten Peroxisomen lokalisiert, in den sogenannten Glyoxysomen. Jedoch wird das gebildete Citrat in das Cytosol gebracht und dort von einer cytosolischen Aconitase in Isocitrat umgesetzt. Dieses wird wieder zurück in das Glyoxysom transportiert und tritt dort in den Glyoxylatzyklus ein. Das gebildete Succinat wird schließlich in ein Mitochondrium transportiert und kann dort in den Citratzyklus einfließen.
In Mikroorganismen findet der Citratzyklus nicht in abgetrennten Zellkompartimenten statt, sondern im Zytoplasma. Infolgedessen überlappen sich Citrat- sowie Glyoxylatzyklus und müssen reguliert werden.
Die Umstellung von Citratzyklus auf Glyoxylatzyklus beinhaltet einen Schaltvorgang an der Isocitratdehydrogenase (IDH, bei Escherichia coli EC 1.1.1.42). Dieses Enzym katalysiert im Citratzyklus die oxidative Decarboxylierung von Isocitrat in α-Ketoglutarat. Im Normalfall dominiert die Aktivität der Isocitratdehydrogenase, und damit die Reaktionsfolge des Citratzyklus. Die Folge ist die Generierung von ATP. Bei Kohlenhydratmangel soll aber stattdessen Isocitrat für den Glyoxylatzyklus gespalten und Kohlenhydrate aufgebaut werden. Für diesen Fall muss die IDH inaktiviert und die Isocitratlyase (IL) stimuliert werden.
Dies geschieht durch eine Phosphorylierung der IDH an einem Serinrest, was durch eine Proteinkinase katalysiert wird.[4] Dies war im Jahre 1989 das erste Beispiel eines interkonvertierbaren Enzyms bei E. coli.
Diese Modifikation kann durch eine Phosphoprotein-Phosphatase rückgängig gemacht werden, so dass die IDH ihre Aktivität zurückerlangt. Diese Phosphatase wird bei einem niedrigen ATP-Spiegel und durch vorhandene Zwischenprodukte der Glykolyse und des Citratzyklus stimuliert, während die IC-Lyase dadurch allosterisch inhibiert wird.[5]
Biologische Bedeutung
Das gebildete Succinat wird in Oxalacetat überführt. Dieses kann in Phosphoenolpyruvat überführt werden, was eine Phosphoenolpyruvat-Carboxykinase katalysiert. Phosphoenolpyruvat wird im Zuge der Gluconeogenese zu Glucose aufgebaut. Infolgedessen ermöglicht der Glyoxylatzyklus Mikroorganismen das Wachsen mit Acetat bzw. Acetyl-CoA, welches aus verschiedenen organischen Verbindungen (Alkane, Isoprene, Alkohole, Polyhydroxyalkanoat, Essigsäure, Triglyceride) generiert bzw. abgebaut worden ist.
Bei Pflanzen nutzt der Keimling den Stoffwechselweg, um Energie und insbesondere Kohlenhydrate (z. B. Saccharose) für das Zellenwachstum aus gespeicherten Triglyceriden (Speicherfette) zu generieren. Hierbei nutzt der Keimling spezielle Fettreservoirs, sogenannte Oleosome, um die Triglyceride in Fettsäuren und Glycerin zu hydrolysieren. Glycerin wird in Glycerinaldehyd-3-phosphat umgewandelt und kann dann weiter metabolisiert werden. Die Fettsäuren gelangen in die Glyoxisome und werden dort im Zuge der β-Oxidation zu Acetyl-CoA abgebaut. Acetyl-CoA fließt dann in den Glyoxylatzyklus ein. Das dort gebildete Succinat wird im Zuge der Gluconeogenese schließlich zu Glucose umgewandelt und kann anschließend zu Saccharose weiterprozessiert werden. Alternativ kann Succinat im Citratzyklus zur Energieerzeugung verwendet werden, bevor die Photosynthese des Keimlings beginnt. In Pflanzen kann der Glyoxylatzyklus auch für den indirekten Transport von Lipiden genutzt werden. Pflanzen können Lipide weder als Träger chemischer Energie noch als Baustoff transportieren. Durch den Glyoxylatzyklus werden diese in eine transportable, wasserlösliche Form gebracht (Saccharose) und dann am Zielort wieder in Lipide umgewandelt.
Da dem Menschen (und anderen Vertebraten) die beiden Enzyme Isocitratlyase und Malatsynthase fehlen, kann dieser gebildetes Acetyl-CoA entweder zu Fetten aufbauen oder im Citratzyklus veratmen. Infolgedessen kann ein Mensch bei einer Nulldiät aus seinen Fettreserven keine Kohlenhydrate generieren und muss diese (notgedrungen) über Aminosäuren beziehen. Deswegen werden bei dieser Diätform Muskeln abgebaut.
Alternative zum Glyoxylatzyklus
Manche auf Acetat wachsenden Mikroorganismen haben keine aktive Isocitratlyase bzw. sie fehlt ihnen. Es wurde aber gezeigt, dass sie alternative Stoffwechselwege nutzen, beispielsweise den Ethylmalonyl-CoA-Weg.[6] Dies ist beispielsweise der Fall für Rhodobacter sphaeroides, Methylobacterium extorquens und anderen Vertretern der Nichtschwefelpurpurbakterien und Alphaproteobacteria.[6] In dem linearen Stoffwechselweg sind für die Umsetzung von Glyoxylat und Acetyl-CoA zu Malat zwei Reaktionsschritte erforderlich.
In manchen Halobakterien, beispielsweise in Haloarcula marismortui, operiert der Methylaspartatzyklus.[7] Für die Umsetzung von Isocitrat zu Succinat sind insgesamt neun Reaktionsschritte benötigt. Dabei entsteht das namensgebende Methylaspartat, eine ungewöhnliche, nicht-proteinogene Aminosäure.
Literatur
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-444608-1, S. 225f.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 405f.
- Philipp Christen, Rolf Jaussi: Biochemie: Eine Einführung mit 40 Lerneinheiten. Springer Verlag, Berlin 2004, ISBN 3-540-21164-0, S. 327f.
- Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1800-5, S. 553f.
- Michael T. Madigan, John M. Martinko, Jack Parker, Thomas D. Brock: Mikrobiologie. Spektrum Akademischer Verlag, 2003, ISBN 3-8274-0566-1, S. 700.
Einzelnachweise
- S. A. Ensign: Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation. In: Mol Microbiol. 61(2), 2006, S. 274–276. PMID 16856935.
- H. L. Kornberg, H. A. Krebs (1957): Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle. In: Nature.179 (4568), 1957, S. 988–991. PMID 13430766; doi:10.1038/179988a0.
- H. L. Kornberg, H. Beevers: The glyoxylate cycle as a stage in the conversion of fat to carbohydrate in castor beans. In: Biochim Biophys Acta. 26(3), 1957, S. 531–537. PMID 13499412.
- J. H. Hurley u. a.: Structure of a bacterial enzyme regulated by phosphorylation, isocitrate dehydrogenase. In: PNAS. 86(22), 1989, S. 8635–8639. PMID 2682654; PDF (freier Volltextzugriff, engl.).
- David Nelson, Michael Cox: Lehninger Biochemie. 4., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-68637-8, S. 846.
- T. J. Erb, G. Fuchs, B. E. Alber: (2S)-Methylsuccinyl-CoA dehydrogenase closes the ethylmalonyl-CoA pathway for acetyl-CoA assimilation. In: Mol Microbiol. 73(6), 2009, S. 992–1008. PMID 19703103; doi:10.1111/j.1365-2958.2009.06837.x.
- M. Khomyakova, Ö. Bükmez, L. K. Thomas, T. J. Erb, I. A. Berg: A methylaspartate cycle in haloarchaea. In: Science. 331(6015), 2011, S. 334–337. PMID 21252347, doi:10.1126/science.1196544.