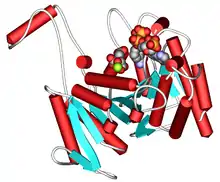
Isocitrat-Dehydrogenase
Isocitrat-Dehydrogenase (IDH) ist der Name für Enzyme und Enzymkomplexe, die die oxidative Abspaltung von Kohlenstoffdioxid von Isocitrat katalysieren, wobei α-Ketoglutarat entsteht. Diese Reaktion ist Teil des Citratzyklus und daher zentral im Stoffwechsel aller Lebewesen. Die Umkehrreaktion, die nur in manchen Mikroorganismen vorkommt, benutzt das Enzym Isocitrat-Lyase.
Die katalysierte Reaktion:
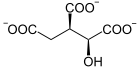 + NAD(P)+
+ NAD(P)+ 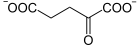 + CO2 + NAD(P)H + H+
+ CO2 + NAD(P)H + H+
Von Isocitrat wird CO2 abgespalten und Ketoglutarat bildet sich.
Strukturell bestehen IDH aus abwechselnden α-Layern und β-Sheets in einer Sandwich-Anordnung. Es gibt zwei verschiedene Enzymgruppen, je nachdem ob NAD+ (EC 1.1.1.41) oder NADP+ (EC 1.1.1.42) Kofaktor ist. Beide haben Mg2+ oder Mn2+ als Metallion. Homologe der ersten Gruppe bestehen aus drei Untereinheiten (Heterotetramer ααβγ) und sind im Mitochondrium lokalisiert, während die zweite Gruppe Homodimere sind, mit je einer Isoform im Mitochondrium und im Cytosol.[1] IDH kommen in allen Lebewesen vor. Beim Menschen sind die drei IDH-Isoformen in fünf Genen codiert, deren Defekte zu erblichen Stoffwechselstörungen führen können:
| Gen | Protein | Aminosäuren | UniProt | OMIM | Kommentar |
|---|---|---|---|---|---|
| IDH1 | IDH(NADP), zytoplasmisch | 414 | O75874 | 147700 | Gliome |
| IDH2 | IDH(NADP), mitochondriell | 413 | P48735 | 147650 | Gliome, 2-Hydroxyglutarazidurie[2] |
| IDH3A | IDH(NAD), mitochondriell, Untereinheit alpha | 339 | P50213 | 601149 | |
| IDH3B | IDH(NAD), mitochondriell, Untereinheit beta | 351 | O43837 | 604526 | Retinitis pigmentosa[3] |
| IDH3G | IDH(NAD), mitochondriell, Untereinheit gamma | 354 | P51553 | 147700 |
Reaktionsmechanismus
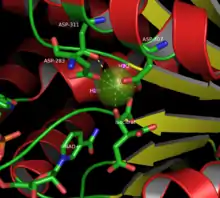
Die im ersten Schritt erfolgende Oxidation des Isocitrats 1 liefert neben NADH die 2-Oxocarbonsäure Oxalsuccinat 2, welche als zweizähniger Ligand über die Ketogruppe und die dazu alpha-ständige Carboxygruppe das Metallion (Mn2+ oder Mg2+) komplexiert. Dadurch bedingt wird die Carbonylfunktion polarisiert, was die Neigung der betaständigen Carboxygruppe zur Decarboxylierung immens erhöht, so dass sich im nun folgenden Decarboxylierungsschritt die über die Komplexbildung stabilisierte Enolform des 2-Oxoglutarats 3 bildet. Nach Protonierung wird das 2-Oxoglutarat(α-Ketoglutarat) 4 freigesetzt. Die mitochondriale NAD+-abhängige Isocitrat-Dehydrogenase kann im Gegensatz zur NADP+-abhängigen kein Oxalsuccinat als Substrat binden, um 2-Oxoglutarat zu bilden.
Wie jede Dehydrogenase ist auch die Isocitrat-Dehydrogenase durch ATP bzw. ADP regulierbar. Das ATP bewirkt eine indirekte Hemmung, das ADP eine indirekte Aktivierung der Dehydrogenase, da sie auf die Kinase-Untereinheit einwirken. ATP stimuliert die Kinase-Untereinheit, diese phosphoryliert die Untereinheit I der Isocitrat-Dehydrogenase, was deren Inaktivierung nach sich zieht. Entsprechend wirkt ADP als Antagonist und führt zu einer indirekten Aktivierung der Isocitrat-Dehydrogenase. Diesen Regulierungsprozess durch Phosphorylierung und Dephosphorylierung bezeichnet man als Interkonversion.
Literatur
- P. T. Tan, A. H. Wei: The epigenomics revolution in myelodysplasia: a clinico-pathological perspective. In: Pathology, Band 43, Nummer 6, Oktober 2011, S. 536–546, doi:10.1097/PAT.0b013e32834a4061. PMID 21881538. (Review).
- L. Dang, S. Jin, S. M. Su: IDH mutations in glioma and acute myeloid leukemia. In: Trends in Molecular Medicine, Band 16, Nummer 9, September 2010, S. 387–397, doi:10.1016/j.molmed.2010.07.002. PMID 20692206. (Review).
- M. Rossetto, P. Ciccarino u. a.: Metabolism of glioma and IDH1/IDH2 mutations. In: Revue neurologique, Band 167, Nummer 10, Oktober 2011, S. 699–703, doi:10.1016/j.neurol.2011.08.002. PMID 21885076. (Review).
- A. Nekrutenko, D. M. Hillis u. a.: Cytosolic isocitrate dehydrogenase in humans, mice, and voles and phylogenetic analysis of the enzyme family. In: Molecular biology and evolution, Band 15, Nummer 12, Dezember 1998, S. 1674–1684, PMID 9866202.
Weblinks
- Isocitrate dehydrogenase. Proteopedia
Einzelnachweise
- InterPro: IPR004434 Isocitrate dehydrogenase NAD-dependent (englisch)
- 2-Hydroxyglutarazidurie. Orphanet
- D. T. Hartong, M. Dange u. a.: Insights from retinitis pigmentosa into the roles of isocitrate dehydrogenases in the Krebs cycle. In: Nature genetics. Band 40, Nummer 10, Oktober 2008, S. 1230–1234, doi:10.1038/ng.223. PMID 18806796. PMC 2596605 (freier Volltext).