Oxidative Decarboxylierung
Eine oxidative Decarboxylierung ist eine chemische Reaktion, bei der die Carboxygruppe (–COOH) einer Carbonsäure als Kohlendioxid (CO2) abgespalten und das restliche Molekül oxidiert wird. Auf diese Weise entsteht das weitaus meiste Kohlendioxid, das Lebewesen ausatmen oder auf andere Weise abgeben. Bei der Zellatmung finden drei verschiedene oxidative Decarboxylierungen statt. Die Substrate sind Pyruvat, das aus der Glykolyse stammt, sowie Isocitrat und α-Ketoglutarat als Metaboliten im Citratzyklus. Die Oxidation erfolgt hier, indem zwei Wasserstoffatome auf Nicotinamidadenindinukleotid (NAD+) übertragen werden. Der Wasserstoff wird der Atmungskette zugeführt und dort letztlich zur Reduktion von Sauerstoff verwendet.
Beteiligte Enzyme und Coenzyme
Die oxidative Decarboxylierung von Pyruvat und α-Ketoglutarat wird von großen Multienzymkomplexen katalysiert, die aus vielen Kopien von drei Enzymen bestehen: einer Decarboxylase, einer Oxidoreduktase und einer Dehydrogenase. Als Coenzyme werden Thiaminpyrophosphat, Coenzym A und NAD+, als prosthetische Gruppen FAD und Liponsäure benötigt. Die enzymatische Umsetzung von Pyruvat zu Acetyl-CoA wird durch den Pyruvat-Dehydrogenase-Komplex katalysiert. α-Ketoglutarat wird im α-Ketoglutarat-Dehydrogenase-Komplex zu Succinyl-CoA umgesetzt. Mit Ausnahme der jeweiligen Dehydrogenase, die die Substratspezifität (für Pyruvat oder α-Ketoglutarat) bedingt, sind die beiden Enzymkomplexe einander sehr ähnlich, was auf einen gemeinsamen evolutionären Ursprung hindeutet. Dagegen wird die oxidative Decarboxylierung von Isocitrat von einem einzelnen Enzym katalysiert, der Isocitrat-Dehydrogenase.[1]
Ablauf der oxidativen Decarboxylierung von Pyruvat
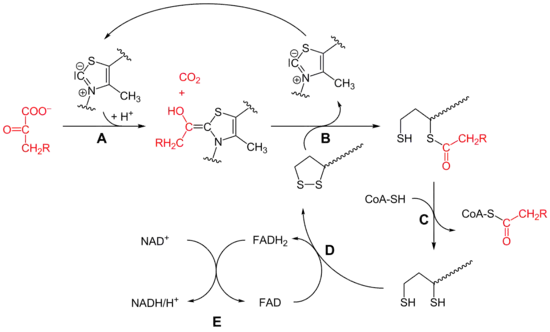
Der Ablauf der oxidativen Decarboxylierung ist am Beispiel von Pyruvat dargestellt (vgl. Schema im Bild, R=H):
- Das Pyruvat lagert sich an Thiaminpyrophosphat (TPP), einem Derivat des Vitamin B1, an. Dann wird die Säuregruppe des Pyruvats als CO2 abgespalten, so dass Hydroxyethyl-TPP entsteht (Schritt A im Schema). Dies wird von der Pyruvat-Dehydrogenase-Komponente (E1) katalysiert.
- Die Hydroxyethyl-Gruppe wird auf Liponamid übertragen. Es entsteht ein Thioester, das Acetyl-Dihydroliponamid, als Oxidationsmittel dient also die Disulfidgruppe. Das TPP wird dabei regeneriert (Schritt B). Auch diese Reaktion wird von der Pyruvat-Dehydrogenase-Komponente katalysiert.
- Die Acetylgruppe wird auf Coenzym A übertragen, es entsteht Acetyl-CoA. Katalysiert wird dieser Schritt durch die Dihydrolipoyl-Transacetylase (E2). Dies ist chemisch gesehen eine Umesterung (Schritt C).
- Das Liponamid wird durch eine Dihydrolipoyl-Dehydrogenase (E3) regeneriert, indem das Dihydroliponamid mit enzymgebundenem FAD zu Liponamid oxidiert wird (Schritt D). FAD ist aber nicht kovalent enzymgebunden.[2]
- Schließlich wird FAD durch Reduktion von NAD+ zu NADH durch dieselbe Dehydrogenase regeneriert (Schritt E). Hierbei ist das Elektronentransferpotential von FADH2 auf NAD+ erhöht, da es mit dem Enzym assoziiert ist.[3]
Die Bilanz der oxidativen Decarboxylierung für Pyruvat lautet:
Beispiele aus der Organischen Chemie
In der organischen Chemie generell bezeichnet oxidative Decarboxylierung eine Reaktion, bei der einer Carbonsäure unter Oxidation der Kohlenstoffkette Kohlenstoffdioxid abgespalten wird. Dies kann beispielsweise durch Erhitzen oder durch Oxidation mit Bleitetraacetat geschehen (Kochi-Reaktion).[4] In der Hunsdiecker-Reaktion erfolgt die oxidative Decarboxylierung über Silbersalze.[4]
Literatur
- Jeremy M. Berg, Lubert Stryer und John L. Tymoczko: Biochemie. Spektrum Akademischer Verlag; 6. Auflage 2007; ISBN 3827418003; S. 533–538.
- Joachim Rassow, Karin Hauser, Roland Netzker und Rainer Deutzmann: Biochemie. Thieme Verlag Stuttgart; 2. Auflage 2008; ISBN 978-3-13-125352-1; S. 104–109.
Weblinks
Einzelnachweise
- Albert L. Lehninger, David L. Nelson, Michael M. Cox: Prinzipien der Biochemie. 2. Aufl., Spektrum, Heidelberg/Berlin/Oxford 1994, S. 522–525 und 530f.
- Rassow et al. Biochemie, S. 105.
- Berg et al. Biochemie; S. 538.
- Hans Peter Latscha, Uli Kazmaier und Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II; 5. Auflage. Springer Verlag, Berlin 2002; ISBN 3-540-42941-7; S. 257.