Protonengradient
Ein Protonengradient ist ein räumlicher oder zeitlicher Unterschied in der Konzentration von Protonen. Es ist der Konzentrationsunterschied an Protonen, genauer an hydratisierten H+-Ionen (H3O+ oder Oxonium), je Streckeneinheit oder Zeiteinheit an einem bestimmten Punkt im Raum. Da der pH-Wert als Logarithmus der H+-Konzentration definiert ist, werden Protonengradient und pH-Gradient synonym gebraucht.
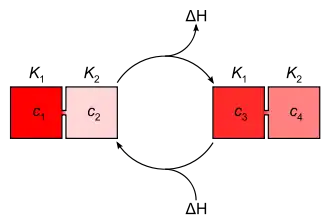
Protonengradienten können über lange (z. B. zwischen Gewässern unterschiedlichen pH-Werts)[1] oder über kurze Abstände (z. B. an Biomembranen)[2] ausgedehnt sein. Ein sehr abrupter Konzentrationswechsel wird als diskontinuierlicher Gradient bezeichnet.
Eigenschaften
Jedem Konzentrationsgefälle entspricht ein Energiepotential ΔH, das sich aus der Differenz der Lösungs-Enthalpien bzw. der Steilheit eines Proton-Konzentrationsgefälles und im Falle von Protonengradienten auch aus der Neutralisationsenergie ergibt. Beim Konzentrationsausgleich zwischen den Bereichen unterschiedlichen pH-Werts wird Energie frei (exotherme Reaktion), die durch energetische Kopplung genutzt werden kann.
Biochemie
An den Membranen von lebenden Zellen können pH-Gradienten gemessen werden. Nach der Chemiosmotischen Theorie folgt aus einem Protonengradienten ein elektrochemisches Membranpotenzial, das durch chemiosmotische Kopplung genutzt wird.
Protonengradienten werden in der biochemischen Laborpraxis unter anderem bei der SDS-PAGE zur Konzentrierung von Proteinen in einem Polyacrylamidgel, bei der isoelektrischen Fokussierung,[3][4] bei der Zentrifugation,[5] in der Ionenaustauschchromatographie[6][7] und in der Affinitätschromatographie verwendet.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Elsevier Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5
- David L. Nelson, Michael Cox: Lehninger Biochemie. 3. Auflage. Springer, Berlin u. a. O. 2001, ISBN 3-540-41813-X.
- Gerhard Gottschalk: Bacterial Metabolism. 2. Auflage. Springer, New York u. a. O. 1988. ISBN 3-540-96153-4.
Einzelnachweise
- John A. Baross, Sarah E. Hoffman: Submarine hydrothermal vents and associated gradient environments as sites for the origin and evolution of life. In: Origins of Life and Evolution of the Biosphere. 15, 1985, S. 327, doi:10.1007/BF01808177.
- M. R. Gunner, M. Amin, X. Zhu, J. Lu: Molecular mechanisms for generating transmembrane proton gradients. In: Biochimica et Biophysica Acta. Band 1827, Nummer 8–9, 2013 Aug-Sep, ISSN 0006-3002, S. 892–913, doi:10.1016/j.bbabio.2013.03.001, PMID 23507617, PMC 3714358 (freier Volltext).
- Gerhard Richter: Praktische Biochemie: Grundlagen und Techniken. Georg Thieme Verlag, 2003. ISBN 9783131323811. S. 90.
- Pier Giorgio Righetti: Immobilized pH Gradients: Theory and Methodology: Theory and Methodology. Laboratory Techniques in Biochemistry and Molecular Biology. Elsevier, 1990. ISBN 9780080858890.
- W. Borchard, A. Straatmann: Analytical Ultracentrifugation VI. Band 119 von Progress in Colloid and Polymer Science. Springer, 2003. ISBN 9783540446729. S. 13.
- Shuichi Yamamoto, Kazahiro Nakanishi, Ryuichi Matsuno: Ion-Exchange Chromatography of Proteins. In: Chromatographic Science Series. CRC Press, 1988. ISBN 9780824779030. S. 284.
- Robert K. Scopes: Protein Purification: Principles and Practice. In: Springer Advanced Texts in Chemistry. Springer Science & Business Media, 1994. ISBN 9780387940724. S. 154, 155.