ALC-0315
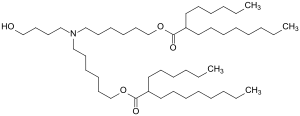
ALC-0315 – [(4-Hydroxybutyl)azandiyl]bis(hexan-6,1-diyl)bis(2-hexyldecanoat) – ist ein pharmazeutischer Hilfsstoff und Transfektionsreagenz. Es bildet die Hauptkomponente des Lipidgemisches im SARS-CoV-2-Impfstoff BNT162b2 (0,43 mg pro Dosis)[2] aus der Kooperation der Firmen BioNTech und Pfizer.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | ALC-0315 | |||||||||
| Andere Namen |
[(4-Hydroxybutyl)azandiyl]bis(hexan-6,1-diyl)bis(2-hexyldecanoat) | |||||||||
| Summenformel | C48H95NO5 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 766,29 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Bei ALC-0315 handelt es sich um ein bei physiologischem pH-Wert kationisches synthetisches Lipid, das zusammen mit anderen Lipiden, wie z. B. Lecithinen, Cholesterin oder synthetischen Amphiphilen, Lipid-Nanoteilchen (LNPs, englisch lipid nanoparticles) bildet. Diese Nanopartikel fördern die Zellaufnahme von therapeutisch wirksamen Nukleinsäuren, wie Oligonukleotiden oder messenger-RNA sowohl in vitro als auch in vivo.[3][4]
Synthese
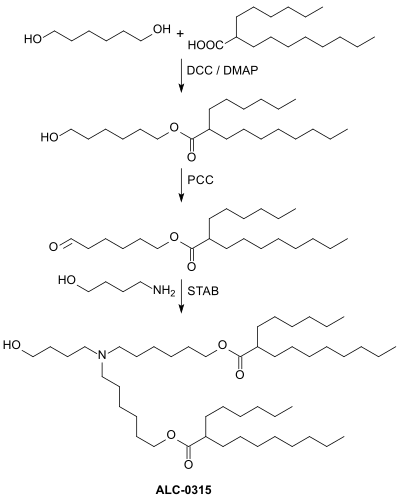
Die Herstellung der Substanz ALC-0315 erfolgt in einer mehrstufigen Synthese, ausgehend von 1,6-Hexandiol und der verzweigten Carbonsäure 2-Hexyldecansäure (Isopalmitinsäure), die durch Oxidation des in einer Guerbet-Kondensation von 1-Octanol zugänglichen 2-Hexyldecanols erhalten werden kann.[5]
Der Monoester der 2-Hexyldecansäure wird in einer Steglich-Veresterung mit Dicyclohexylcarbodiimid (DCC) und 4-(Dimethylamino)pyridin (DMAP) als Katalysator dargestellt. Anschließend wird die freie Hydroxygruppe des Monoesters mit Pyridiniumchlorochromat (PCC) zum Aldehyd oxidiert und die Aldehydgruppe in einer reduktiven Aminierung unter Verwendung des Reduktionsmittels Natriumtriacetoxyborhydrid (STAB) mit 4-Amino-1-butanol (aus 2-Buten-1,4-diol durch aminierende Hydrierung[6]) zum Endprodukt umgesetzt.
Eigenschaften
Die in der Synthese als farbloses Öl anfallende Substanz ALC-0315 ist durch ihre zwei langkettigen Carbonsäureesterstrukturen ein sehr hydrophobes Molekül, das mit anderen hydrophoben Molekülen in wässriger Phase unter geeigneten Bedingungen zu Nanopartikeln aggregiert. Die Nanopartikel können durch Zugabe von Membranlipiden wie dem neutralen Lecithin Distearoylphosphatidylcholin DSPC, dem membranverstärkenden Sterol Cholesterin und dem neutralen synthetischen Amphiphilen ALC-0159 stabilisiert werden. Daher werden diese Lipide auch als Helferlipide bezeichnet. Als tertiäres Amin ist ALC-0315 bei pH 7 durch Protonierung positiv geladen und zeigt starke elektrostatische Wechselwirkung mit Ribonukleinsäure, die unter physiologischen Bedingungen negative Ladung besitzt. Mit einer Säurekonstante pKa von 6,09 liegt ALC-0315 in der Nähe des als optimal bezeichneten Bereichs von 6,6–6,8 für die Immunogenität nach intramuskulärer Injektion.[7] Die basische und bei physiologischen pH-Werten positiv geladene Aminogruppe befindet sich nach der Aggregation auf der Außenseite der Nanopartikel und kann Nukleinsäuren binden, die bei diesen pH-Werten aufgrund der Phosphatgruppen viele negative Ladungen aufweisen.
Mit seinen beiden Esterfunktionen im Molekül kann für ALC-0315 eine gute Bioabbaubarkeit angenommen werden, da auch das primäre Hydrolyseprodukt – die verzweigte Carbonsäure 2-Hexyldecansäure – als leicht bioabbaubar charakterisiert ist.[8]
Anwendungen
ALC-0315 ist die Hauptkomponente der nanopartikelbildenden Lipide, die freie mRNA gegen enzymatischen Abbau durch Nukleasen im Cytoplasma schützen und als Transportvehikel für RNA über die Zellmembran in das Zellinnere fungieren. Erst im Zellinneren kann mRNA ihre Wirkung – die Übertragung der genetischen Information für die Proteinsynthese (Translation) – entfalten.
Die Nebenkomponente ALC-0159 mit ihrem hydrophilen mPEG-Molekülteil ist grenzflächenaktiv, reichert sich in der Grenzfläche Lipidpartikel/Wasser an und hemmt so Aggregation (Verklumpung) und Koaleszenz (Verschmelzung) der Nanoteilchen. Die elektrostatische Anziehung zwischen positiv geladenen Lipidtröpfchen und negativ geladenen Nukleinsäuren ist die Triebkraft für die „Beladung“ der Partikel mit RNA. Aufgrund der starken Wechselwirkungen zwischen den nanopartikelbildenden funktionellen Lipiden und der Ribonukleinsäuren erscheint es wahrscheinlich, dass mRNA sowohl in das Innere der Partikel aufgenommen und auch an der positiv geladenen Oberfläche adsorbiert wird.[4]
Eine Kenngröße für die Effizienz der Nanopartikel als Transportvehikel für RNA ist das so genannte N/P-Verhältnis (engl. N/P ratio), im konkreten Fall das Molverhältnis von positiv geladenem Lipid N (N=Stickstoff) zum negativ geladenen Phosphat P in der RNA. Das N/P-Verhältnis lässt sich einfach und präzise ermitteln und ist unabhängig von der Größe der RNA.
Die auf ALC-0315 basierenden LNPs sind stabile, wirksame und gut verträgliche Wirkstoffträger für therapeutische mRNA.
Weblinks
- REG 174 INFORMATION FOR UK HEALTHCARE PROFESSIONALS
- Theo Dingermann: Produkteigenschaften: Mehr Details zum Biontech-Impfstoff. In: Pharmazeutische Zeitung. 8. Dezember 2020 (pharmazeutische-zeitung.de).
- Klaus Langer: Nanotechnologie der Covid-19-Vakzinen in Pharmazeutische Zeitung vom 11. April 2021
Literatur
- Andreas M. Reichmuth, Matthias A. Oberli, Ana Jaklenec, Robert Langer, Daniel Blankschtein: mRNA vaccine delivery using lipid nanoparticles. In: Ther. Deliv. 7(5), S. 319–334 (2016), doi:10.4155/tde-2016-0006.
- Piotr S. Kowalski, Arnab Rudra, Lei Miao, Daniel G. Anderson: Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. In: Mol. Ther. 27(4), S. 710–728 (2019), doi:10.1016/j.ymthe.2019.02.012.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Linde Schoenmaker et al.: mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. In: International Journal of Pharmaceutics. Band 601, 15. Mai 2021, S. 120586, doi:10.1016/j.ijpharm.2021.120586.
- Ugur Sahin, Katalin Karikó, Özlem Türeci: mRNA-based therapeutics – developing a new class of drugs. In: Nat. Rev. Drug Discov. Band 13, Nr. 10, 2014, S. 759–780, doi:10.1038/nrd4278.
- A.K. Blakney, P.F. McKay, B.I. Yus, Y. Aldon, R.J. Shattock: Inside out: Optimization of lipid nanoparticle formulations for exterior complexation and in vivo delivery of saRNA. In: Gene Ther. Band 26, 2019, S. 363–372, doi:10.1038/s41434-019-0095-2.
- Patent US4011273: Method for the production of Guerbet alcohols utilizing insoluble lead catalysts. Angemeldet am 4. August 1975, veröffentlicht am 8. März 1977, Anmelder: Henkel Inc., Erfinder: P.G. Abend, P. Leenders.
- Patent DE19602049A1: Verfahren zur Herstellung von 4-Aminobutanol. Angemeldet am 20. Januar 1996, veröffentlicht am 24. Juli 1997, Anmelder: Hüls AG, Erfinder: M. Stein, W. Kleine Homann, L. Heinrich.
- K.J. Hassett, K.E. Benenato, E. Jacquinet, L.A. Brito et al.: Optimization of Lipid Nanoparticles for Intramuscular Administration of mRNA Vaccines. In: Mol. Ther. Nucleic Acids. Band 15, 2019, S. 1–11, doi:10.1016/j.omtn.2019.01.013.
- ISOCARB 16. In: Safety Data Sheet. Sasol, 20. April 2020, abgerufen am 12. Dezember 2020.