5′-Cap-Struktur
Die 5′-Cap-Struktur (von englisch cap ‚Kappe‘) ist ein kappenähnlicher Aufsatz am 5′-Ende von mRNA-Molekülen, der im Zellkern von eukaryotischen Zellen angefügt wird. Die 5′-Kappe schützt nicht nur eine RNA vor Abbau, sondern ist des Weiteren auch für den Export einer mRNA aus dem Kern in das Zytoplasma wichtig sowie für die Translation der mRNA durch Ribosomen.
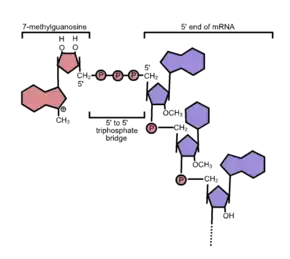
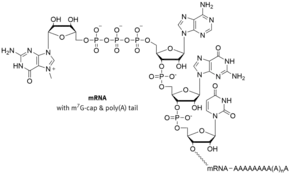
Häufig handelt es sich bei der 5′-Cap-Struktur um ein modifiziertes Guanin-Nukleotid, das über eine seltene 5′-5′-Phosphodiesterbindung an das Kopfende der RNA geknüpft wird. Diese englisch Capping genannte chemische Reaktion findet schon während der Transkription eines Gens statt, sobald eine RNA-Polymerase die ersten Nukleotide einer mRNA verknüpft hat. Im Unterschied zum (kotranskriptionellen) Capping des 5′-Endes ist die Polyadenylierung des 3′-Endes einer mRNA – der Tailing (von englisch tail ‚Schwanz‘) genannte Anbau eines Poly(A)-Schwanzes – eine posttranskriptionelle Modifikation, die erst nach Trennung von mRNA und RNA-Polymerase durchgeführt wird.
Capping wird außer bei mRNA auch bei vielen nichtcodierenden RNAs gefunden. Alternativ zur Cap-Struktur werden von manchen RNA-Viren zur Einleitung der Translation IRES oder Cap-independent Translation Elements verwendet.
Cap-Strukturen
Polymerase II
Bei mRNAs, die durch die RNA-Polymerase II transkribiert werden, findet sich die klassische m7G-Cap. Hier wird (nach Hydrolyse des terminalen γ-Phosphates durch die Triphosphatase) durch das so genannte Capping-Enzym ein GMP-Rest (von GTP) in Form einer 5′-5′-Triphosphat-Bindung auf das 5′-Ende der RNA übertragen und anschließend an Position 7 des Guanins mithilfe der mRNA-cap-Methyltransferase unter Verbrauch von S-Adenosylmethionin (SAM), ein universeller Methylgruppendonor, methyliert, es resultiert: 5′-5′ m7GpppN. Zusätzlich treten weitere Methylierungen der ersten Basen der mRNA in Position 2′ auf, man spricht dann von Cap1 (nur die erste Base methyliert) oder Cap2 (die ersten beiden Basen methyliert).
Weiterhin findet man z. B. in Trypanosomen weitaus kompliziertere Cap-Strukturen, bei denen nicht nur das erste Nukleotid modifiziert ist, sondern auch darauf folgende (z. B. Trypanosoma brucei Cap-4).
Polymerase III
Transkripte der RNA-Polymerase III erhalten keine solchen 5′-Cap Strukturen, bei einigen wenigen RNAs findet sich aber eine Monomethylierung an einem γ-Phosphatrest (z. B. U6 snRNA).
Viren
Manche Viren zeigen eine Eigenart im Biosyntheseweg der Cap-Struktur: GTP wird zunächst methyliert und erst anschließend auf die RNA übertragen.
Funktion
Wie auch der Poly(A)-Schwanz am 3′-Ende von mRNAs spielt die Cap-Struktur eine wichtige Rolle beim Stabilisieren der mRNAs. Ohne diese Struktur werden die mRNAs im Cytoplasma schnell von 5′ nach 3′ durch Exonukleasen abgebaut.
Auch beim Ausschleusen der RNA aus dem Zellkern durch die Kernporen in das Cytoplasma (RNA-Export) spielt die Cap-Struktur eine wichtige Rolle. Sie wird noch während der Transkription vom Cap-Binding-Komplex gebunden, der im Zusammenwirken mit anderen Faktoren einen effektiven Transport sichert.
Von entscheidender Wichtigkeit ist die Cap-Struktur auch bei der Initiation der Translation. Sowohl gebunden durch CBC (während der ersten Runde der Translation) als auch durch eIF4E (während aller weiterer Runden) sorgt sie dafür, dass das Ribosom rekrutiert wird und mit der Initialisierung beginnt. Dabei kommt es zu einem Ringschluss der RNA (closed loop model of translation), bei dem das 5′-Ende mit dem Poly-A-Schwanz interagiert (über eIF4E, eIF4G und das cytoplasmatische Poly-A-Bindeprotein PABPC).
Da einige Viren ausschließlich im Cytoplasma replizieren, erhalten sie von der zellulären Maschinerie keine Cap-Struktur. Um die Nachteile auszugleichen, die dies mit sich bringt, stehlen sie eine Cap von zellulären mRNAs, man spricht von Cap-snatching. Eine mRNA des Wirtsorganismus wird dabei nahe dem 5′-Ende gespalten (welches ja die Cap-Struktur trägt) und als sogenannter capped-leader dazu benutzt die virale Translation zu initiieren.
Die Tatsache, dass virale Polymerasen kein m7G-Cap produzieren, ermöglicht eine spezifische Unterscheidung von "fremder" und "körpereigener" RNA – eine RNA, die lediglich ein ungecaptes Triphosphat am 5′-Ende trägt, kann als Hinweis auf eine Infektion gelten. In der Tat gibt es im angeborenen Immunsystem (dessen grundlegende Aufgabe die Unterscheidung von "Fremd" und "Selbst" ist) mit RIG-I einen intrazellulären Rezeptor, der genau diese Struktur als PAMP erkennt und in der Folge eine antivirale Immunantwort auslöst.[1] Die mRNA von Impfstoffen wie Tozinameran, mRNA-1273 oder CVnCoV ist zum Schutz vor frühzeitigem Abbau mit einer 5′-Cap ausgestattet.
Literatur
- Rolf Knippers: Molekulare Genetik. 8. neubearbeitete Auflage. Georg Thieme Verlag, Stuttgart u. a. 2001, ISBN 3-13-477008-3
- reactome: mRNA capping -- doi:10.3180/REACT_1470.1
Einzelnachweise
- Hornung et al.: 5′-Triphosphate RNA Is the Ligand for RIG-I, In: Science, 10 November 2006:Vol. 314 no. 5801 pp. 994-997 doi:10.1126/science.1132505. Originalpublikation in Science über die Erkennung von ungecapter RNA