Nukleosid-modifizierte mRNA
Nukleosid-modifizierte Messenger-RNA (modRNA) ist eine synthetische, chemisch modifizierte Boten-Ribonukleinsäure (mRNA), in der einzelne Nukleoside durch andere natürliche modifizierte Nukleoside oder durch synthetische Nukleosid-Analoga ersetzt sind.[2] modRNA wird experimentell oder therapeutisch eingesetzt, um in bestimmten Zellen die Produktion eines gewünschten Proteins zu induzieren. Ein wesentliches Element ist die Ersetzung des Nukleosids Uridin durch Pseudouridin, was zuerst von Katalin Karikó und ihrem Team entwickelt und 2008 veröffentlicht wurde.[3]
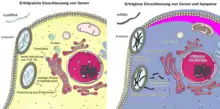
Ein wichtiger Anwendungsbereich ist die Herstellung von Impfstoffen gegen SARS-CoV-2.
Voraussetzungen
In einer Zelle entsteht mRNA dadurch, dass ein Ribonukleinsäure (RNA)-Strang nach einer Desoxyribonukleinsäure (DNA)-Vorlage synthetisiert wird, wobei der codogene Strangabschnitt als Matrize dient. Dieser Vorgang wird als Transkription bezeichnet. Die mRNA wird dann an Ribosomen abgelesen und dient dabei ihrerseits als Bauplan für die Synthese von Proteinen, indem sie deren Aminosäuresequenz vorgibt. Den zuletzt beschriebenen Vorgang der Proteinbiosynthese bezeichnet man als Translation.
Prinzip und Nutzen der Nukleosidmodifikation
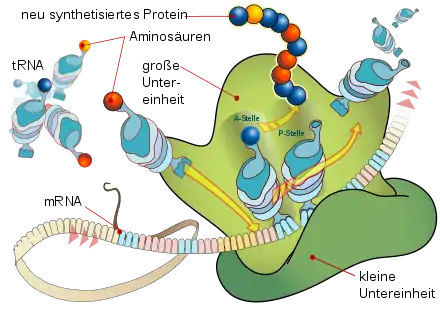
Wenn man Zellen veranlassen will, Proteine zu synthetisieren, die sie normalerweise nicht herstellen, kann man modRNA einsetzen, in deren Nukleotidsequenz die Aminosäuresequenz dieser Proteine codiert ist. Die in vitro synthetisierte mRNA muss dann in den Organismus eingebracht, zum Beispiel injiziert, in die Zielzellen aufgenommen und dort abgelesen werden. Auf die Weise erfolgt also eine Translation ohne vorherige Transkription. Man schmuggelt sozusagen in die Zellen einen Bauplan für fremde Proteine ein. Um dieses Ziel zu erreichen, muss man aber Systeme umgehen, die im menschlichen Organismus dazu da sind, das Eindringen und die Translation fremder mRNA zu verhindern. Zum einen gibt es Enzyme (Ribonukleasen), die „normale“, also nicht modifizierte mRNA abbauen. Zum andern gibt es auch intrazelluläre Barrieren gegen fremde mRNA. Wenn Einzelstrang-RNA (ssRNA) über die Zellmembran in Endosomen aufgenommen wird, wird sie von den Toll-like-Rezeptoren 7 und 8, die zum angeborenen Immunsystem gehören, erkannt. Dies führt letztlich dazu, dass die Proteinsynthese in der Zelle abgeschaltet wird, dass Interferone und Zytokine ausgeschüttet werden und es über die Aktivierung der Transkriptionsfaktoren TNF-alpha und AP-1 zum programmierten Zelltod (Apoptose) kommen kann. Dies kann man umgehen, indem man das System zur in-vitro-Produktion der mRNA so modifiziert, dass statt des physiologischen Nukleosids Uridin das ähnliche (auch natürlich vorkommende) Pseudouridin (Ψ) oder N1-Methylpseudouridin (m1Ψ) oder statt Cytosin das 5-Methyl-Cytosin eingebaut werden[4][5]. N1-Methyl-Pseudouridin und 5-Methyl-Cytosin kommen natürlicherweise nicht vor. Wenn eine mRNA ein oder zwei dieser abgeänderten Nukleoside enthält, führt das zu einer Änderung der Sekundärstruktur, was auf der einen Seite verhindert, dass sie vom angeborenen Immunsystem erkannt wird, zum anderen aber dennoch eine effektive Translation zu einem Protein erlaubt. Durch die Modifizierung wird also die Entzündungsreaktion deutlich verringert.[6]
Veränderung der Nukleotidsequenz („Designerproteine“)
Außer durch die Verwendung modifizierter Nukleoside kann man modRNA auch verändern, indem man die Nukleotidsequenz im Vergleich zu natürlich vorkommender, „originaler“ mRNA so variiert, dass ein etwas anderes Protein entsteht. Dies geschah zum Beispiel bei den unten aufgeführten SARS-CoV-2-Impfstoffen Tozinameran und mRNA-1273, um die Stabilität des Proteins in einer bestimmten Konformation zu erhöhen.[7][8] Für diese Veränderung der Nukleotidsequenz und damit des Proteins wurde in der Literatur der Ausdruck „Mutation“ verwendet. Eine „Mutation“ im eigentlichen biologischen Sinne, nämlich eine dauerhafte Veränderung des Erbgutes,[9] findet hier aber nicht statt.
Bedeutung untranslatierter Regionen
Eine normale mRNA beginnt und endet mit Abschnitten, die nicht für Aminosäuren des eigentlichen Proteins codieren. Diese Sequenzen am 3′- und 5′-Ende eines mRNA-Strangs werden als untranslatierte Regionen (UTRs) bezeichnet. Die beiden UTRs an ihren Strangenden sind wesentlich für die Stabilität einer mRNA und ebenso einer modRNA wie auch für die Effizienz der Translation, also für die Menge des produzierten Proteins. Durch die Auswahl geeigneter UTRs bei der Synthese einer modRNA kann man die Produktion des Zielproteins in den Zielzellen optimieren.[10]
Hindernisse, Verwendung von Nanopartikeln
Wenn man modRNA in bestimmte Zielzellen einschleusen will, steht man vor verschiedenen Schwierigkeiten. Zum einen muss man die modRNA vor Ribonukleasen schützen. Das kann zum Beispiel dadurch geschehen, dass man sie in Lipidnanopartikel (Solid lipid nanoparticles) einpackt. Eine solche „Verpackung“ kann auch dazu beitragen, dass die modRNA in die Zielzellen aufgenommen wird. Dies ist zum Beispiel nützlich beim Einsatz in Impfstoffen, da Nanopartikel von dendritischen Zellen und Makrophagen aufgenommen werden, die beide eine wichtige Rolle in der Aktivierung des Immunsystems spielen[11].
Weiterhin kann es wünschenswert sein, dass die angewendete modRNA spezifisch in bestimmte Körperzellen eingebracht wird. Dies ist zum Beispiel der Fall, wenn man Herzmuskelzellen zur Vermehrung anregen will. Dann kann die verpackte modRNA zum Beispiel direkt intraarteriell in die Koronararterien injiziert werden.
Risiken
Wenn die modRNA nicht in die Zielzellen, sondern in andere Zellen gelangt, können unerwünschte Effekte auftreten. Wenn zum Beispiel das codierte Protein eigentlich Herzmuskelzellen zur Zellvermehrung anregen soll, aber fälschlicherweise in anderen Zellen produziert wird, könnten so Wucherungen entstehen. Allerdings wird ein solcher negativer Effekt zeitlich dadurch limitiert, dass die modRNA trotz ihrer im Vergleich zu normaler mRNA erhöhten Stabilität letztlich doch abgebaut wird, ebenfalls die von ihr codierten Proteine[12].
Dass von modRNA Veränderungen am Genom der Zellen, also Mutationen, ausgelöst werden ist nicht plausibel, da die Erbinformation als DNA (nicht als RNA) im Zellkern vorliegt, und modRNA nicht in den Zellkern gelangt. Insofern sind auch mögliche Folgen von Mutationen wie z. B. Krebsentstehung nicht zu erwarten.
Einsatzgebiete
Das aktuell wichtigste Einsatzgebiet von modRNA ist die Produktion von Impfstoffen gegen SARS-CoV-2.[13] Die Vakzine, die von der Firmen-Kooperation Biontech/Pfizer/Fosun (Tozinameran)[14][15] und Moderna (mRNA-1273)[16][17] wie auch von anderen Unternehmen[18] als Schutz vor einer COVID-19-Erkrankung entwickelt wurden, wenden modRNA-Technologien an. Die Impfstoffe der Firmen Biontech/Pfizer/Fosun und Moderna sind in einigen Staaten wie den USA oder den Mitgliedsstaaten der Europäischen Union zur Nutzung zugelassen und werden eingesetzt oder sollen bald eingesetzt werden. Der Impfstoff Zorecimeran des Herstellers Curevac verwendet dagegen unmodifizierte RNA.
Weitere Möglichkeiten einer Verwendung von modRNA sind die Regeneration von geschädigtem Herzmuskelgewebe[19][20] und die Krebstherapie.[21]
Literatur
- Kenneth R. Chien, Lior Zangi, Kathy O. Lui: Synthetic Chemically Modified mRNA (modRNA): Toward a New Technology Platform for Cardiovascular Biology and Medicine. In: Cold Spring Harbor Perspectives in Medicine. Band 5, Nr. 1, 1. Januar 2015, ISSN 2157-1422, S. a014035, doi:10.1101/cshperspect.a014035, PMID 25301935, PMC 4292072 (freier Volltext) – (Online [abgerufen am 28. November 2020]).
Einzelnachweise
- Ajit Magadum, Keerat Kaur, Lior Zangi: mRNA-Based Protein Replacement Therapy for the Heart. In: Molecular Therapy. Band 27, Nr. 4, 10. April 2019, ISSN 1525-0016, S. 785–793, doi:10.1016/j.ymthe.2018.11.018, PMID 30611663, PMC 6453506 (freier Volltext).
- Kenneth R. Chien, Lior Zangi, Kathy O. Lui: Synthetic Chemically Modified mRNA (modRNA): Toward a New Technology Platform for Cardiovascular Biology and Medicine. In: Cold Spring Harbor Perspectives in Medicine. Band 5, Nr. 1, 1. Januar 2015, ISSN 2157-1422, S. a014035, doi:10.1101/cshperspect.a014035, PMID 25301935, PMC 4292072 (freier Volltext) – (Online [abgerufen am 28. November 2020]).
- Katalin Karikó, Hiromi Muramatsu, Frank A Welsh, János Ludwig, Hiroki Kato, Shizuo Akira, Drew Weissman: Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. In: Mol Ther. 16 (11), 2008, S. 1833–1840, doi:10.1038/mt.2008.200 (nih.gov [PDF; 833 kB]).
- Nishat Sultana, Ajit Magadum, Yoav Hadas, Jason Kondrat, Neha Singh: Optimizing Cardiac Delivery of Modified mRNA. In: Molecular Therapy. Band 25, Nr. 6, 7. Juni 2017, ISSN 1525-0016, S. 1306–1315, doi:10.1016/j.ymthe.2017.03.016, PMID 28389322, PMC 5474881 (freier Volltext).
- Katalin Karikó, Michael Buckstein, Houping Ni, Drew Weissman: Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA. In: Immunity. Band 23, Nr. 2, August 2005, ISSN 1074-7613, S. 165–175, doi:10.1016/j.immuni.2005.06.008.
- K Karikó, M Buckstein, H Ni, D Weissman: Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA.. In: Immunity. 23, Nr. 2, August 2005, S. 165–75. doi:10.1016/j.immuni.2005.06.008. PMID 16111635.
- Edward E. Walsh, Robert W. Frenck, Ann R. Falsey, Nicholas Kitchin, Judith Absalon: Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. In: New England Journal of Medicine. Band 383, Nr. 25, 17. Dezember 2020, ISSN 0028-4793, S. 2439–2450, doi:10.1056/NEJMoa2027906, PMID 33053279, PMC 7583697 (freier Volltext).
- Lisa A. Jackson, Evan J. Anderson, Nadine G. Rouphael, Paul C. Roberts, Mamodikoe Makhene: An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. In: New England Journal of Medicine. Band 383, Nr. 20, 12. November 2020, ISSN 0028-4793, S. 1920–1931, doi:10.1056/NEJMoa2022483, PMID 32663912, PMC 7377258 (freier Volltext).
- Alfred Nordheim/Rolf Knippers: Molekulare Genetik. 11. Auflage. Stuttgart, ISBN 978-3-13-242637-5.
- Alexandra G. Orlandini von Niessen, Marco A. Poleganov, Corina Rechner, Arianne Plaschke, Lena M. Kranz: Improving mRNA-Based Therapeutic Gene Delivery by Expression-Augmenting 3′ UTRs Identified by Cellular Library Screening. In: Molecular Therapy. Band 27, Nr. 4, 10. April 2019, ISSN 1525-0016, S. 824–836, doi:10.1016/j.ymthe.2018.12.011, PMID 30638957, PMC 6453560 (freier Volltext).
- Nanoparticle vaccines. In: Vaccine. Band 32, Nr. 3, 9. Januar 2014, ISSN 0264-410X, S. 327–337, doi:10.1016/j.vaccine.2013.11.069.
- Keerat Kaur, Lior Zangi: Modified mRNA as a Therapeutic Tool for the Heart. In: Cardiovascular Drugs and Therapy. Band 34, Nr. 6, 1. Dezember 2020, ISSN 1573-7241, S. 871–880, doi:10.1007/s10557-020-07051-4, PMID 32822006, PMC 7441140 (freier Volltext).
- Christina Hohmann-Jeddi: Hoffnungsträger BNT162b2: Wie funktionieren mRNA-Impfstoffe? In: Pharmazeutische Zeitung. 10. November 2020, abgerufen am 28. November 2020.
- n-tv NACHRICHTEN: Paul-Ehrlich-Institut gibt Corona-Impfstoff frei. Abgerufen am 25. Dezember 2020.
- Annette B. Vogel, Isis Kanevsky, Ye Che, Kena A. Swanson, Alexander Muik: A prefusion SARS-CoV-2 spike RNA vaccine is highly immunogenic and prevents lung infection in non-human primates. In: bioRxiv. 8. September 2020, S. 2020.09.08.280818, doi:10.1101/2020.09.08.280818.
- COVID-19 Vaccine Moderna. (PDF) EMA - European Medicines Agency, abgerufen am 9. Januar 2021 (englisch).
- Moderna's Pipeline. In: modernatx.com. Moderna, abgerufen am 28. November 2020 (englisch).
- Florian Krammer: SARS-CoV-2 vaccines in development. In: Nature. Band 586, Nr. 7830, Oktober 2020, ISSN 1476-4687, S. 516–527, doi:10.1038/s41586-020-2798-3.
- Keerat Kaur, Lior Zangi: Modified mRNA as a Therapeutic Tool for the Heart. In: Cardiovascular Drugs and Therapy. Band 34, Nr. 6, 1. Dezember 2020, ISSN 1573-7241, S. 871–880, doi:10.1007/s10557-020-07051-4, PMID 32822006, PMC 7441140 (freier Volltext).
- Lior Zangi, Kathy O. Lui, Alexander von Gise, Qing Ma, Wataru Ebina: Modified mRNA directs the fate of heart progenitor cells and induces vascular regeneration after myocardial infarction. In: Nature Biotechnology. Band 31, Nr. 10, Oktober 2013, ISSN 1546-1696, S. 898–907, doi:10.1038/nbt.2682, PMID 24013197, PMC 4058317 (freier Volltext).
- Ugur Sahin, Özlem Türeci: Personalized vaccines for cancer immunotherapy. In: Science. Band 359, Nr. 6382, 23. März 2018, ISSN 0036-8075, S. 1355–1360, doi:10.1126/science.aar7112.