Maul-und-Klauenseuche-Virus
Das Maul-und-Klauenseuche-Virus (englisch Foot-and-mouth disease virus, abgekürzt FMDV, im Deutschen auch MKSV) ist eine hoch kontagiöse Virusspezies aus der Familie der Picornaviridae, bildet zusammen mit dem Equinen Rhinitis-B-Virus die Gattung Aphthovirus und zeigt eine hohe Mutationsrate. Das FMDV ist der Erreger der Maul- und Klauenseuche bei Paarhufern, insbesondere beim Hausrind.
| Maul-und-Klauenseuche-Virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Foot-and-mouth disease virus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| FMDV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Eigenschaften
Morphologie
Die Virusteilchen (Virionen) des FMDV sind im Durchmesser 23 bis 27 nm groß und besitzen eine für Picornaviren ungewöhnlich glatte Oberfläche. Das mit 3,3 nm sehr dünnwandige Kapsid ist aus Kapsomeren bestehend aus den vier Kapsidproteinen aufgebaut, von denen die Kapsidproteine 1A, 1B und 1D die Oberfläche bilden und außen liegen, hingegen das Protein 1C das Innere des Kapsids auskleidet. Die Kapsidproteine des FMDV gehören mit einer Größe von 208 bis 220 Aminosäuren zu den kleinsten der Picornaviren. An den Ecken des Kapsids, an denen eine fünfstrahlige Symmetrie vorliegt (Pentamer), ist auch das 1C von außen zugänglich. Das Kapsidprotein 1D besitzt eine nach außen gerichtete Domäne von 17 bis 23 Aminosäuren Länge, die sogenannte G-H-Schleife, mit der das Virus seine Zielzelle erkennt und über Membranrezeptoren der Integrin-Familie die Zelle infiziert. Die G-H-Schleife trägt an ihrem Ende das konservierte Integrin-Erkennungsmotiv RGD und bindet insbesondere an αVβ6 Integrin[3].
Für die serologischen Eigenschaften des FMDV ist überwiegend das Kapsidprotein 1A verantwortlich, an das auch neutralisierende Antikörper binden. Zwei Determinanten befinden sich in der G-H-Schleife des 1D. Bei einigen Isolaten findet man sehr viel leere, d. h. RNA-freie und damit nicht infektiöse Kapside (75-S-Komponente), die jedoch die gleichen serologischen Eigenschaften wie die kompletten Virionen (140-S-Komponente) besitzen. Vermutlich spielen sie bei der Ablenkung des Immunsystems eine gewisse Rolle.
Genom
Das Genom des FMDV ist etwa 8450 nt groß und codiert für ein Polyprotein von 2332 Aminosäuren Länge. Die virale (+)ssRNA kann direkt als mRNA abgelesen werden und ist ohne weitere Zwischenschritte zur Vermehrung fähig. Vor dem Startcodon des einzigen offenen Leserahmens (ORF) befindet sich eine nichtcodierende Region (5’-NCR), die mit ca. 1200 bis 1500 nt fast doppelt so lang ist wie bei anderen Picornaviren. Die Größe erklärt sich u. a. aus einem je nach Isolat 100–400 nt langen Poly-Cytosin-Trakt (poly-C) im vorderen Drittel der 5'-NCR, die mehrere Pseudoknoten als Sekundärstruktur ausbildet. An die 5'-NCR sind drei verschiedene genomische Virusproteine (VPg) kovalent gebunden.
Der Leserahmen des FMDV beginnt wie bei allen Spezies der Gattungen Aphthovirus und Cardiovirus nicht mit den Kapsidproteinen, sondern mit einem sogenannten Leader-Protein (L-Protein), das eine Protease-Funktion besitzt. Die Translation des ORF beginnt beim FMDV an zwei alternativen Startcodons, wodurch zwei unterschiedlich lange L-Proteine gebildet werden (Lab und Lb). Initiiert wird die Translation wie bei allen Picornaviren durch eine IRES. Das Lb-Protein ist nun in der Lage, durch Spaltung eine zelluläre Protease zu aktivieren, die den Abbau eines zellulären Proteins (p220) einleitet, das wiederum Teil des zellulären Translationsinitiationskomplexes eIF-4F ist.[4] Dadurch wird die von den zellulären mRNAs genutzte Translation mittels einer 5'-Cap-Struktur verhindert und die gesamte zelluläre Proteinsynthese blockiert; lediglich das Virus, das aufgrund seiner IRES den Faktor eIF-4F nicht benötigt, kann nun seine Proteine synthetisieren. Man spricht hier auch von einem sogenannten „virus-host shutoff“ (Abschalten der Wirtszelle durch das Virus). Neben dem Lb-Protein ist auch die C3-Protease des FMDV in der Lage, zelluläre Initiationsfaktoren zu inaktivieren.[5]
Biologische Eigenschaften
Wirtsspektrum
Eine natürliche Infektion mit dem FMDV ist bei zahlreichen Paarhufern und anderen Säugetieren beschrieben[6][7], so vorwiegend bei Hornträgern (Bovidae mit den wichtigen Vertretern Büffel, Bisons, Antilopen, Gazellen, Rinder, Schafe und Ziegen), aber auch bei Hirschen (Cervidae), Nabelschweinen (Tayassuidae), Schweinen (Suidae), Igeln (Erinaceidae), Kamelen (Camelidae), Giraffenartigen (Giraffidae), Langschwanzmäusen (Muridae), Elefanten (Elephantidae), Bären (Ursidae) und Tapiren (Tapiridae). Anhand von genetischen Untersuchungen des aus Wildtieren isolierten FMDV kann seine Verbreitung durch große Tierwanderungen vor allem in Afrika gezeigt werden. Das FMDV lässt auch Rückschlüsse auf die Wanderungsrouten der Herden zu.[8] Unter experimentellen Bedingungen ist das FMDV auch auf Hunde, Katzen, Kaninchen und Ratten übertragbar. In der Forschung ist die künstliche Infektion von Meerschweinchen und neugeborenen Mäusen von Bedeutung. Das Virus kann sehr gut in Zelllinien aus Hamsternieren (BHK-21: baby hamster kidney cells) gezüchtet werden; auch zur Herstellung des Impfstoffes gegen FMDV-Typen wird diese Zelllinie verwendet.
Stabilität
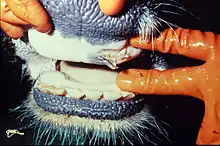
Aufgrund der Kapsidbildung über nur wenige polare Aminosäuregruppen ist das FMDV sehr empfindlich gegenüber Säuren und wird bereits bei pH-Werten unter 6,8 inaktiviert. Die bei der normalen Fleischreifung (pH < 6,0) und bei Milchprodukten aus saurer Milch auftretende Säuerung inaktiviert das Virus ebenso vollständig wie die normale Magensäure. Daher ist eine Übertragung des Virus über den Magen-Darm-Trakt ausgeschlossen. Eine Verschleppung des Virus in Produkten, die keiner Säuerung unterliegen (Knochenmark, Fett, Speck, Blut und Gefrierfleisch) ist jedoch möglich. Das Virus wird durch tiefe Temperaturen und hohe Kochsalzkonzentration nicht inaktiviert. In trockenem Milieu ist das FMDV über längere Zeit sehr stabil. Besonders angetrockneter Speichel ermöglicht die Verbreitung durch den Wind über Entfernungen von mehr als 10 km, wenn trockene klimatische Bedingungen gegeben sind.
Subtypen und Verbreitung
Das FMDV ist außer in Neuseeland, Australien und Nordamerika weltweit verbreitet. In weiten Teilen Asiens und Südamerikas sowie den meisten afrikanischen Ländern ist das Virus endemisch. In Europa kommt es aufgrund seuchenrechtlichen Eingreifens und prophylaktischer Impfungen nur noch bei sporadischen Ausbrüchen vor. Das FMDV besitzt eine hohe antigenetische Variabilität und es wurde eine Vielzahl unterschiedlicher Serotypen, Varianten und Stämme isoliert. Diese unterscheiden sich in ihren serologischen und immunologischen Eigenschaften. Die ersten beiden Typen – und damit die sogenannte Pluralität des Virus – wurden von Vallée und Carré 1922 charakterisiert[9][10] und nach dem Ort des Isolates als O (Département Oise) und A (Ardennen) bezeichnet. In Deutschland wurde 1926 ein dritter Typ (C) entdeckt[11] und 1952 konnten drei weitere Typen in Afrika („Southern African Territories“ SAT) isoliert werden.[12] Der bislang letzte beschriebene Typ wurde 1954 in Asien isoliert (Asia1)[13]. Alle Typen außer dem FMDV-C neigen zur Variabilität und Ausbildung weiterer Subtypen, die neben einem Typenantigen noch ein weiteres stammspezifisches Antigen aufweisen. Während alle Typen auch geographisch unterschiedlich verteilt sind, ist der Typ FMDV-O in allen FMDV-Gebieten anzutreffen.
- Spezies Maul-und-Klauenseuche-Virus (FMDV)
- Typ Maul-und-Klauenseuche-Virus A (FMDV-A), 32 Subtypen
- Typ Maul-und-Klauenseuche-Virus Asia 1 (FMDV-Asia1), 3 Subtypen
- Typ Maul-und-Klauenseuche-Virus C (FMDV-C)
- Typ Maul-und-Klauenseuche-Virus O (FMDV-O), 11 Subtypen
- Typ Maul-und-Klauenseuche-Virus SAT 1 (FMDV-SAT1), 7 Subtypen
- Typ Maul-und-Klauenseuche-Virus SAT 2 (FMDV-SAT2), 3 Subtypen
- Typ Maul-und-Klauenseuche-Virus SAT 3 (FMDV-SAT3), 4 Subtypen
Einzelnachweise
- ICTV Master Species List 2018b v1 MSL #34, März 2019
- ICTV: ICTV Taxonomy history: Enterovirus C, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Abhay Kotecha, Quan Wang, Xianchi Dong, Serban L. Ilca, Marina Ondiviela: Rules of engagement between αvβ6 integrin and foot-and-mouth disease virus. In: Nature Communications. Band 8, Nr. 1, August 2017, ISSN 2041-1723, S. 15408, doi:10.1038/ncomms15408, PMID 28534487, PMC 5457520 (freier Volltext) – (nature.com [abgerufen am 30. April 2020]).
- M. E. Piccone, S. Sira, M. Zellner, M. J. Grubman: Expression in Escherichia coli and purification of biologically active L proteinase of foot-and-mouth disease virus. Virus Res. (1995) 35(3): S. 263–275 PMID 7785315
- G. J. Belsham, G. M. McInerney, N. Ross-Smith: Foot-and-mouth disease virus 3C protease induces cleavage of translation initiation factors eIF4A and eIF4G within infected cells. J Virology (2000) 74(1): S. 272–280 PMID 10590115
- K. E. Federer: Susceptibility of the agouti (Dasyprocta aguti) to foot-and-mouth disease virus. Zentralbl Veterinarmed B (1969) 16(9): S. 847–854 PMID 4320315
- G. R. Thomson 2001, siehe Literaturliste
- W. Vosloo, A. D. Bastos, A. Michel, G. R. Thomson: Tracing movement of African buffalo in southern Africa. Rev Sci Tech. (2001) 20(2): S. 630–639 PMID 11548532
- H. Vallée und H. Carré: Sur límmunité anti-aphteuse. Revue générale de médecine vétérinaire (Toulouse) 1922: 31, S. 313–317
- H. Vallée und H. Carré: Sur la pluralite du virus aphteux. Comptes rendus hebdomadaires des séances de l'Académie des Sciences, Paris (1922) 174, S. 1498–1500
- O. Waldmann und K. Trautwein: Experimentelle Untersuchungen fiber die Pluralitat des Maul- und Klauenseuche Virus. Berliner tierärztliche Wochenschrift (1926) 42: S. 569–571
- J. B. Brooksby: Vesicular stomatitis and foot-and-mouth disease: analysis of mixed infection in cattle. J Hyg, London (1952) 50(3): S. 394–404 PMID 12990797
- C. J. Bradish, W. M. Henderson, J. B. Brooksby: Electrophoretic studies of ox serum. 2. The sera of cattle infected with the virus of foot-and-mouth disease. Biochem J. (1954) 56(2): S. 335–341 PMID 13140197
Literatur
- G. Stanway, F. Brown et al.: Genus Aphthovirus. In: C.M. Fauquet, M.A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London, San Diego, 2005, S. 768f.
- S. Mordow, D. Falke: Molekulare Virologie. Spektrum Akad. Verlag, Heidelberg, Berlin 1997.
- Heinrich Liebermann: Lehrbuch der veterinärmedizinischen Virologie. Stuttgart 1992.
- G. R. Thomson, R. G. Bengis, C. C. Brown: Picornavirus Infections. In: E. S. Williams und I. K. Baker (eds.): Infectious diseases of wild animals. Iowa State University Press, Ames, Iowa, 3. Auflage 2001, S. 119–130.