Adoptiver Zelltransfer
Der adoptive Zelltransfer bezeichnet den Transfer von Zellen in einen Organismus.
Eigenschaften
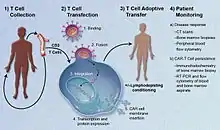
Durch Behandlung von Zellen ex vivo mit einem Vektor, Immunogen oder Arzneistoff können Wirkungen erzielt werden, die in vivo nicht immer erreicht werden. Beispielsweise kann ein zur Behandlung verwendeter Wirkstoff vorzeitig im Organismus (z. B. durch die Leber) abgebaut oder ausgeschieden werden oder der Wirkstoff entfaltet erst im Körper eine Toxizität. Der Zelltransfer besteht aus einer Entnahme von Zellen (ob autolog oder nicht autolog), deren Behandlung ex vivo und deren Transfer, meistens durch Injektion oder Infusion, in einen Organismus. Durch den Transfer bzw. bei autologen Zellen durch den Rücktransfer erhält der Organismus Zellen mit neuen Funktionen, woher die Bezeichnung adoptiv stammt.
In der Immunologie werden meistens autologe Immunzellen (PBMC, daraus vor allem T-Lymphozyten, Zytokin-induzierte Killerzellen[1] und dendritische Zellen)[2][3] durch Dichtegradientenzentrifugation isoliert und anschließend in Zellkultur behandelt. Teilweise erfolgt eine Zelldepletion unerwünschter Zelltypen. Diese Behandlung der Zellen kann bei Impfstoffen stimulierend (u. a. mit Interleukin-2, GM-CSF, IL-12, IL-21) oder bei Hyposensibilisierungen tolerogen (z. B. mit Anti-CD3-Rezeptor-Antikörpern wie Muromonab-CD3, Otelixizumab, Teplizumab und Visilizumab) sein.[4][5][6][7][8]
Anwendungen
Der adoptive Zelltransfer wird unter anderem in der Gentherapie, bei der Stammzelltherapie oder in der Immuntherapie verwendet.[9][10][11] Sipuleucel-T ist ein zugelassener adoptiver Zelltransfer.
Im Rahmen der Krebsimmuntherapie werden Immunzellen ex vivo gegen Tumorzellen sensibilisiert.[12][13][14][15] Bei einer klinischen Studie mit einem adoptiven Zelltransfer transgener T-Zellen konnte bei Patienten mit B-Zell-Lymphomen eine Remissionsquote von 88 % erreicht werden.[16]
Die Impfung mit Tumorantigen-beladenen Dendritischen Zellen ist ebenfalls Inhalt derzeitiger Forschung und klinischer Studien. Hierbei werden autologe Dendritische Zellen ex vivo mit Antigenen beladen, welche entweder direkt aus dem individuellen Tumor des Patienten stammen oder welche zur standardisierten Behandlung verwendet werden (MelanA, survivin). Die Beladung der Dendritischen Zellen kann unter anderem mittels RNA-Transfektion, DNA-Transfer oder der Inkubation mit Tumorlysat erfolgen.[17] Weiterhin werden Tumorzellen mit Genen von Zytokinen transfiziert, die nach Injektion bevorzugt an andere Tumorzellen des gleichen Typs binden und dort über das von ihnen sezernierte Zytokin die Immunreaktion hervorrufen oder verstärken.[18]
Eine weitere Methode, die zum adoptiven Zelltransfer gerechnet werden kann und sich in experimentellen Stadium mit Tieren befindet, wurde 2015 zum ersten Mal vorgestellt. Dabei wurden auf ein Silizium-Gitter mit extrem feiner Struktur Immunsystemzellen des betroffenen Tiers eingesetzt. Diese Zellen wurden mit abgeschwächten Erregern in vitro (außerhalb des Organismus) aktiviert. Das Gitter wurde dann an das Tier implantiert und könnte dort einige Monate verbleiben. Die Methode wurde bisher nicht an Menschen getestet.[19]
Einzelnachweise
- C. Hontscha, Y. Borck, H. Zhou, D. Messmer, I. G. Schmidt-Wolf: Clinical trials on CIK cells: first report of the international registry on CIK cells (IRCC). In: Journal of Cancer Research and Clinical Oncology. Band 137, Nummer 2, Februar 2011, S. 305–310, doi:10.1007/s00432-010-0887-7. PMID 20407789.
- C. Berger, C. J. Turtle, M. C. Jensen, S. R. Riddell: Adoptive transfer of virus-specific and tumor-specific T cell immunity. In: Current Opinion in Immunology. Band 21, Nummer 2, April 2009, S. 224–232, doi:10.1016/j.coi.2009.02.010. PMID 19304470. PMC 2720155 (freier Volltext).
- G. Vassalli: Dendritic Cell-Based Approaches for Therapeutic Immune Regulation in Solid-Organ Transplantation. In: Journal of transplantation. Band 2013, 2013, S. 761429, doi:10.1155/2013/761429. PMID 24307940. PMC 3824554 (freier Volltext).
- Gattinoni L, Powell DJ, Rosenberg SA, Restifo NP: Adoptive immunotherapy for cancer: building on success. In: Nature Reviews Immunology. 6, Nr. 5, Mai 2006, S. 383–93. doi:10.1038/nri1842. PMID 16622476. PMC 1473162 (freier Volltext).
- June CH: Adoptive T cell therapy for cancer in the clinic. In: The Journal of Clinical Investigation. 117, Nr. 6, Juni 2007, S. 1466–76. doi:10.1172/JCI32446. PMID 17549249. PMC 1878537 (freier Volltext).
- Schmitt TM, Ragnarsson GB, Greenberg PD: T Cell Receptor Gene Therapy for Cancer. In: Human Gene Therapy. 20, Nr. 11, Oktober 2009, S. 1240–8. doi:10.1089/hum.2009.146. PMID 19702439. PMC 2829456 (freier Volltext).
- Riley JL, June CH, Blazar BR: Human T Regulatory Cells as Therapeutic Agents: Take a Billion or So of These and Call Me in the Morning. In: Immunity. 30, Nr. 5, Mai 2009, S. 656–65. doi:10.1016/j.immuni.2009.04.006. PMID 19464988. PMC 2742482 (freier Volltext).
- M. Michael, A. Shimoni, A. Nagler: Regulatory T cells in allogeneic stem cell transplantation. In: Clinical & developmental immunology. Band 2013, 2013, S. 608951, doi:10.1155/2013/608951. PMID 23737813. PMC 3662184 (freier Volltext).
- Johnson LA, Morgan RA, Dudley ME, et al.: Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. In: Blood. 114, Nr. 3, Juli 2009, S. 535–46. doi:10.1182/blood-2009-03-211714. PMID 19451549. PMC 2929689 (freier Volltext).
- Morgan RA, Dudley ME, Wunderlich JR, et al.: Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes. In: Science. 314, Nr. 5796, Oktober 2006, S. 126–9. doi:10.1126/science.1129003. PMID 16946036. PMC 2267026 (freier Volltext).
- Kalos M, Levine BL, Porter DL, et al.: T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia. In: Science Translational Medicine. 3, Nr. 95, August 2011, S. 95ra73. doi:10.1126/scitranslmed.3002842. PMID 21832238.
- A. Kunert, T. Straetemans, C. Govers, C. Lamers, R. Mathijssen, S. Sleijfer, R. Debets: TCR-Engineered T Cells Meet New Challenges to Treat Solid Tumors: Choice of Antigen, T Cell Fitness, and Sensitization of Tumor Milieu. In: Frontiers in immunology. Band 4, 2013, S. 363, doi:10.3389/fimmu.2013.00363. PMID 24265631. PMC 3821161 (freier Volltext).
- Besser MJ, Shapira-Frommer R, Treves AJ, et al. (May 2010). „Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients“ Clin. Cancer Res 16 (9) 2646–2655. doi:10.1158/1078-0432.CCR-10-0041 PMID 20406835
- Dudley ME, Wunderlich JR, Robbins PF, et al.: Cancer Regression and Autoimmunity in Patients After Clonal Repopulation with Antitumor Lymphocytes. In: Science. 298, Nr. 5594, Oktober 2002, S. 850–4. doi:10.1126/science.1076514. PMID 12242449. PMC 1764179 (freier Volltext).
- Dudley ME, Wunderlich JR, Yang JC, et al.: Adoptive Cell Transfer Therapy Following Non-Myeloablative but Lymphodepleting Chemotherapy for the Treatment of Patients With Refractory Metastatic Melanoma. In: Journal of Clinical Oncology. 23, Nr. 10, April 2005, S. 2346–57. doi:10.1200/JCO.2005.00.240. PMID 15800326. PMC 1475951 (freier Volltext).
- M. L. Davila, I. Riviere, X. Wang, S. Bartido, J. Park, K. Curran, S. S. Chung, J. Stefanski, O. Borquez-Ojeda, M. Olszewska, J. Qu, T. Wasielewska, Q. He, M. Fink, H. Shinglot, M. Youssif, M. Satter, Y. Wang, J. Hosey, H. Quintanilla, E. Halton, Y. Bernal, D. C. Bouhassira, M. E. Arcila, M. Gonen, G. J. Roboz, P. Maslak, D. Douer, M. G. Frattini, S. Giralt, M. Sadelain, R. Brentjens: Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. In: Science Translational Medicine. Band 6, Nummer 224, Februar 2014, S. 224ra25, doi:10.1126/scitranslmed.3008226. PMID 24553386.
- Sébastien Anguille, Evelien L Smits, Eva Lion, Viggo F van Tendeloo, Zwi N Berneman: Clinical use of dendritic cells for cancer therapy. In: The Lancet Oncology. 15, 2014, S. e257, doi:10.1016/S1470-2045(13)70585-0.
- Eleonora Dondossola, Andrey S. Dobroff, Serena Marchiò, Marina Cardó-Vila, Hitomi Hosoya, Steven K. Libutti, Angelo Corti, Richard L. Sidman, Wadih Arap, Renata Pasqualini: Self-targeting of TNF-releasing cancer cells in preclinical models of primary and metastatic tumors. In: Proceedings of the National Academy of Sciences., S. 201525697, doi:10.1073/pnas.1525697113.
- Ioanna Zerva, Chara Simitzi u. a.: Implantable vaccine development using in vitro antigen-pulsed macrophages absorbed on laser micro-structured Si scaffolds. In: Vaccine. 33, 2015, S. 3142, doi:10.1016/j.vaccine.2015.04.017.