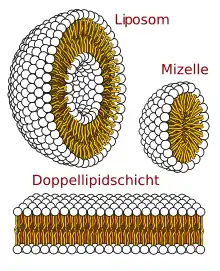
Liposom
Ein Liposom (von altgriechisch λίπος lípos „Fett“ und σῶμα sṓma „Körper, Leib“, Plural: Liposomen) ist ein Bläschen (Vesikel), das eine wässrige Phase einschließt und dessen Membranhülle aus einer Doppelschicht von Molekülen (Doppellipidschicht) besteht. Diese Moleküle sind amphiphil, das heißt, sie weisen sowohl einen unpolaren (lipophilen, fettliebenden), als auch einen polaren (hydrophilen, wasserliebenden) Teil auf. Meist handelt es sich bei den membranbildenden Molekülen um Substanzen aus der Stoffklasse der Lipide, wie zum Beispiel Phospholipide und Fettsäuren. Liposomen dienen als Modell für die Untersuchung der biophysikalischen Eigenschaften von Biomembranen und finden darüber hinaus im kosmetischen, sowie vor allem im medizinischen Bereich (Drug Targeting) Anwendung.[1] Liposomen sind von Mizellen, welche nur über eine einfache Lipidschicht verfügen, zu unterscheiden.
Entdeckung
Entdeckt und beschrieben wurden Liposomen erstmals 1964 von einer Arbeitsgruppe am Babraham Institute rund um den britischen Hämatologen Alec Douglas Bangham.[2] Die Bezeichnung „Liposom“ ist auf Gerald Weissmann zurückzuführen, welcher ebenfalls maßgeblich an der Entdeckung und Erforschung von Liposomen beteiligt war.[3] Die im Jahre 1964 von Alec Douglas Bangham und R.W. Horne im Journal of Molecular Biology veröffentlichte Publikation „Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope“ gilt als jene Publikation, in welcher Liposomen (damals noch als “multilamellar smectic mesophases” bezeichnet) erstmals erwähnt wurden.[4]
Aufbau und Eigenschaften
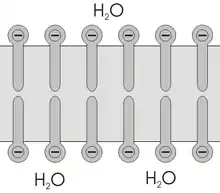
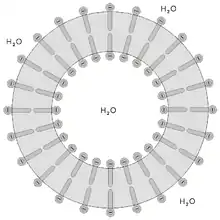
Die membranbildenden Moleküle eines Liposoms verfügen über einen hydrophilen/lipophoben, sowie über einen hydrophoben/lipophilen Teil. Bei der Bildung der Doppelschicht des Liposoms ordnen sich diese amphiphilen Moleküle entsprechend diesen Eigenschaften an. Die hydrophoben Teile der Moleküle sind zueinander gerichtet, so dass sie geringen Kontakt zur wässrigen Phase haben, wohingegen die hydrophilen Teile der Moleküle zur wässrigen Phase innerhalb und außerhalb des Liposoms gerichtet sind. Die Bildung einer energetisch günstigen sphärischen Form mit möglichst geringer Oberfläche liegt diesem Verhalten zugrunde (Hydrophober Effekt). Die Moleküle der Membran halten durch nicht-kovalente Interaktion zusammen. Daraus resultiert eine fluide Membran, deren aliphatisches, lipophiles Inneres empfänglich für die Aufnahme einer Vielzahl von lipophilen Substanzen ist.
Größe und Form von Liposomen sind grundlegend abhängig von der chemischen Zusammensetzung der Lipidmembran, der physikalisch-chemischen Eigenschaften der wässrigen Phase (z. B. Ionenstärke, pH-Wert, Osmolalität) in welcher sie vorliegen bzw. welche sie einschließt und dem Präparationsverfahren (siehe Herstellung). Liposomen können einschichtig (eine Doppelschicht, unilamellar) oder mehrschichtig (mehrere konzentrische Doppelschichten, multilamellar) sein und einen mittleren Durchmesser von 25 nm bis hin zu 100 µm haben. Über diese zwei Parameter, Größe (mittlerer Durchmesser) und Lamellarität lassen sich Liposomen grob in vier Kategorien einteilen.
Multilamellar vesicles (MLV) bestehen im Allgemeinen aus mehreren konzentrischen Lipiddoppelschichten. Ihr mittlerer Durchmesser liegt zwischen 100 nm und 1000 nm. Small unilamellar vesicles (SUV) sind unilamellar und haben einen mittleren Durchmesser zwischen 20 nm und 100 nm, wohingegen large unilamellar vesicles (LUV) und giant unilamellar vesicles (GUV) einen Durchmesser zwischen 100 nm und 1000 nm bzw. zwischen 1 µm und 200 µm aufweisen.[5] Die größeren Liposomen sind daher im sichtbaren Licht mit einem Lichtmikroskop zu erkennen.
Die Membran eines Liposoms kann aus verschiedenen Lipiden zusammengesetzt sein. Je nach angestrebtem pharmakodynamischem Wirkprofil, pharmakokinetischem Verhalten, chemischen und physikalischen Eigenschaften wie Größe, Größenverteilung, Lamellarität, Fluidität, Permeabilität, Zetapotential, Phasenübergangstemperatur der Membran u.v.m. kann zur Präparation von Liposomen für medizinische sowie kosmetische Applikationen aus einem breiten Spektrum vielfältiger Lipide aus den Stoffklassen der Phospholipide und Sterole gewählt werden. Die Lipide aus diesen zwei Stoffklassen sind in erster Linie strukturgebende Komponenten des Liposoms. Darüber hinaus kommen auch Lipopolysaccharide (z. B. Lipid A als Adjuvans), Fettsäuren und andere lipophile Substanzen wie z. B. Tocopherole (als Antioxidans) und Squalene als Membrankomponenten zum Einsatz.
Die erste Entwicklungsstufe zu lebenden Zellen in der Ursuppe waren vermutlich liposomenartige Strukturen, die sich spontan aus amphiphilen Lipiden (zum Beispiel aus Phosphatidylcholin Lecithin) in einem wässerigen Medium ausgebildet haben.
Anwendungen
Durch die liposomale Formulierung von Arzneistoffen ist es durch Einschlussimmobilisierung möglich, empfindliche Arzneistoffe nach der Applikation vor einer möglichen Metabolisierung zu schützen. In ähnlicher Weise werden Niosome verwendet. Zudem kann durch Einschluss von Arzneistoffen in Liposomen die Plasmahalbwertszeit erhöht werden. Liposomen als Drug Delivery System können den Transport von Arzneistoffen an jene Stellen im Organismus, an denen sie benötigt werden, verbessern. Dadurch können Nebenwirkungen des liposomal formulierten Arzneistoffes verringert und, da niedrigere Dosen verabreicht werden können, die Effizienz und die therapeutische Breite erhöht werden. Eine liposomale Formulierung steht aufgrund der Eigenschaften des Liposoms den meisten Arzneistoffen offen. Hydrophile Arzneistoffe werden umschlossen und befinden sich im hydrophilen Inneren des Liposoms. Lipophile Arzneistoffe werden in die Membran eingebettet und amphiphile Arzneistoffe an der Grenzfläche zwischen dem Membraninneren und der wässrigen Phase. Liposomale Formulierungen von Arzneistoffen wie Biopharmazeutika, zu denen unter anderem Impfstoffe[6] wie auch siRNA und miRNA für Anwendungen in der therapeutischen RNA-Interferenz[7] zählen, aber auch von nicht-biologischen synthetischen Arzneistoffen bringen pharmakologische und ökonomische Vorteile.
Virosomen, also Liposomen, welche in ihrer Lipidmembran virale Hüllenproteine tragen, dienen zugleich als System für einen zielgerichteten und selektiven Transport und als Adjuvans.[8] Virosomen, die nach Endozytose durch die Endosomenmembran in Zellen aufgenommen werden, haben zudem die Eigenschaft, sowohl eine humorale Immunantwort als auch eine zelluläre Immunantwort auslösen zu können.[9]
In manchen pharmazeutischen Produkten müssen die Liposomen auch durch eine oberflächliche Polymerschicht (typischerweise aus Polyethylenglykol) geschützt werden, um eine Verschmelzung mit einer zufälligen, beliebigen Zellmembran zu vermeiden (meist in der Leber), bevor der Wirkstoff an seinem Bestimmungsort angekommen ist. Auf dem Weg zu ihrem Bestimmungsort können die in ein Liposom eingeschlossenen Wirkstoffe durch die Lipiddoppelschicht gegen die zerstörende Wirkung von Enzymen und vor vorzeitiger Ausscheidung aus dem Körper geschützt werden. Mit Hilfe von Fremdmolekülen (wie Antikörpern), die an das Äußere der Liposomen angeheftet werden, kann man außerdem versuchen, den Bestimmungsort des Wirkstoffs durch Bindung an einen spezifischen Rezeptor genau festzulegen (Drug Targeting). Aufgrund ihrer zellmembranähnlichen chemischen Beschaffenheit können Liposomen vermutlich leicht mit der Zellmembran oder, nach einer Pinocytose oder Endocytose, mit der Endosomen- und Lysosomenmembran verschmelzen und dann ihren Inhalt in das Zellinnere entlassen.
In der Biotechnologie werden Liposome gelegentlich verwendet, um Fremdmaterial, zum Beispiel Plasmide, in eine Zelle einzuschleusen. Dieser Vorgang ist als liposomale Transfektion oder als Lipofektion bekannt, jedoch bis heute nur sehr unvollkommen verstanden und auch weitaus weniger effektiv als eine Transduktion mittels eines viralen Vektors.
Alternativ zu Liposomen werden auch Polymersomen eingesetzt.
Auch essentielle Nährstoffe und Nahrungsergänzungsmittel, vor allem solche mit einem normalerweise langsamen, regulierten oder nur teilweisen Aufnahmemechanismus, wie beispielsweise Vitamin C, können in Liposomen eingeschlossen besser in den Blutstrom gelangen.[10] Für einige funktionale Naturstoffe wie Curcumin, deren Bioverfügbarkeit aufgrund ihrer Hydrophobizität gering ist, wurde eine signifikante Steigerung der Bioverfügbarkeit durch Liposomen nachgewiesen.[11] Eine Humanstudie[12], die den Effekt von oral verabreichtem Vitamin C in umschlossener sowie unumschlossener Form im Vergleich zur intravenösen Gabe verglich, kam zu dem Schluss, dass (1) die im Blut zirkulierende Konzentration des liposomalen Vitamin Cs größer war als die lediglich oral verabreichte, uneingeschlossene Variante. Allerdings war die im Blut nachgewiesene Menge weiterhin geringer als nach einer intravenösen Gabe. (2) Der als Marker für Oxidativen Stress festgelegte gemessene Ischemische–Reperfusions-Wert war zwischen allen Verabreichungsformen ähnlich gesenkt.
Herstellung
Multilamellare Liposomen (MLV) entstehen spontan durch Lösen von Lipiden in wässriger Phase. Unilamellare Liposomen (SUV/LUV) lassen sich durch verschiedene Methoden erzeugen.
Liposomale Fertigarzneimittel
Bis 2008 wurden 11 Arzneimittel in liposomaler Verabreichungsform zugelassen.[13]
| Beispiele für liposomale Fertigarzneimittel[13][14] | ||||
|---|---|---|---|---|
| Wirkstoff | Handelsname | Pharmazeutischer Unternehmer | Art der Liposomen | Anwendungsgebiet(e) |
| Amphotericin B | Abelcet („weltweit“) | Cephalon, Teva | Lipidlamellen | Systemische Pilzinfektionen |
| AmBisome (div. europäische Länder, TR, CDN, USA) | Gilead Sciences, Astellas | Konventionelle Liposomen | ||
| Cytarabin | DepoCyte (EU, CH) | Pacira Limited | Multivesikuläre Liposomen | Maligne lymphomatöse Meningeosis |
| Daunorubicin | DaunoXome (GB, DE, DK) | Gilead Sciences | HIV-assoziiertes Kaposi-Sarkom | |
| Doxorubicin | Myocet („weltweit“) | Teva | Konventionelle Liposomen | Metastasierender Brustkrebs |
| Doxil (USA) / Caelyx („weltweit“ außer USA) | Janssen-Cilag | PEG-ylierte Liposomen | Brustkrebs, Eierstockkrebs, HIV-assoziiertes Kaposi-Sarkom, Multiples Myelom | |
| Morphin | DepoDur (USA) | SkyePharma, Endo | Multivesikuläre Liposomen | Postoperative Analgesie |
| Hepatitis-A-Impfstoff | Epaxal / HAVpur | Berna Biotech, Novartis | Virosomen | Hepatitis A |
| Influenza-Impfstoff | Inflexal V / Influvac | Berna Biotech, Novartis | Virosomen | Influenza |
| Paclitaxel | Lipusu (CN) | Luye Pharma | Konventionelle Liposomen | Eierstockkrebs |
| Perflutren | Definity (USA) | Lantheus | Ultraschallkontrast | |
| Verteporfin | Visudyne (EU, CH, J, USA) | Novartis | Feuchte altersbezogene Makuladegeneration, pathologische Myopie | |
Die Bedeutung liposomaler Arzneiformulierungen für das Drug Targeting insbesondere in Indikationen wie etwa Krebserkrankungen oder Infektionen bei cystischer Fibrose wird sichtbar in einer deutlichen Anzahl entsprechender Formulierungen unter den Orphan-Arzneimitteln.[15]
Siehe auch
- Seifenblase – ebenfalls ein kugelförmiges Gebilde mit einer Hülle aus amphiphilen Molekülen, bei denen jedoch der hydrophile Teil nach innen zeigt
Literatur
- R. R. C. New (Hrsg.): Liposomes a practical approach. IRL Press at Oxford University Press, Oxford 1990, ISBN 0-19-963077-1.
- Dietrich Arndt, Iduna Fichtner: Liposomen : Darstellung – Eigenschaften – Anwendung. (= Fortschritte der Onkologie. Band 13). Akademie-Verlag, Berlin 1986, ISBN 3-05-500148-6.
- Volker Weissig (Hrsg.): Liposomes: Methods and Protocols. Volume 1: Pharmaceutical nanocarriers. (= Methods in Molecular Biology. Band 605). Humana Press, New York 2010, ISBN 978-1-60327-360-2.
- Volker Weissig (Hrsg.): Liposomes: Methods and Protocols. Volume 2: Biological Membrane Models. (= Methods in Molecular Biology. Band 606). Humana Press, New York 2010, ISBN 978-1-60761-446-3.
- Shelley D. Minteer (Hrsg.): Enzyme Stabilization and Immobilization : Methods and Protocols. (= Methods in Molecular Biology. Band 679). Humana Press, Totowa NJ 2011, ISBN 978-1-60761-895-9.
Weblinks
Einzelnachweise
- V. P. Torchilin: Drug targeting. In: European Journal of Pharmaceutical Sciences. 11, Supplement 2, 2000, S. S81–S91.
- David W. Deamer: From “Banghasomes” to liposomes: A memoir of Alec Bangham, 1921–2010. In: FASEB Journal. Band 24, Nr. 5, 2010, S. 1308–1310, doi:10.1096/fj.10-0503.
- Grazia Sessa, Gerald Weissmann: Phospholipid spherules (liposomes) as a model for biological membranes. In: Journal of Lipid Research. Band 9, Nr. 3, 1968, S. 310–318.
- A. D. Bangham, R. W. Horne: Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope. In: Journal of Molecular Biology. Band 8, Heft 5, 1964, S. 660–668.
- Emeline Rideau, Rumiana Dimova, Petra Schwille, Frederik R. Wurm, Katharina Landfester: Liposomes and polymersomes: a comparative review towards cell mimicking. In: Chemical Society Reviews. Band 47, Nr. 23, 2018, ISSN 0306-0012, S. 8572–8610, doi:10.1039/C8CS00162F.
- Günther Strobl: Schlüsselrolle für österreichische Firma Polymun Scientific bei Covid-Vakzin, derstandard.at vom 12. November 2020, abgerufen am 12. November 2020.
- Ala Daka, Dan Peer: RNAi-based nanomedicines for targeted personalized therapy. In: Advanced Drug Delivery Reviews. Band 64, Heft 13, Oktober 2012, S. 1508–1521.
- Yasufumi Kaneda: Virosomes: evolution of the liposome as a targeted drug delivery system. In: Advanced Drug Delivery Reviews. Band 43, Nr. 2–3, 30. September 2000, S. 197–205, doi:10.1016/S0169-409X(00)00069-7.
- A. Wagner, G. Stiegler, K. Vorauer-Uhl, H. Katinger, H. Quendler, A. Hinz, W. Weissenhorn: One Step Membrane Incorporation of Viral Antigens as a Vaccine Candidate Against HIV. In: Journal of Liposome Research. Band 17, 2007, S. 139–154.
- J. C. Kraft, J. P. Freeling, Z. Wang, R. J. Ho: Emerging research and clinical development trends of liposome and lipid nanoparticle drug delivery systems. In: J Pharm Sci. Band 103, Nr. 1, 2014, S. 29–52.
- J. Shaikh, D. D. Ankola, V. Beniwal, D. Singh, M. N. Kumar: Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer. In: Eur J Pharm Sci. Nr. 37, 2009, S. 223–230.
- Janelle L. Davis, Hunter L. Paris, Joseph W. Beals, Scott E. Binns, Gregory R. Giordano, Rebecca L. Scalzo, Melani M. Schweder, Emek Blair, Christopher Bell: Liposomal-encapsulated Ascorbic Acid: Influence on Vitamin C Bioavailability and Capacity to Protect Against Ischemia–Reperfusion Injury. In: Nutr Metab Insights. Nr. 9, 20. Juni 2016, S. 25–30.
- L. Zhang, F. X. Gu, J. M. Chan, A. Z. Wang, R. S. Langer, O. C. Farokhzad: Nanoparticles in Medicine: Therapeutic Applications and Developments. In: Clinical Pharmacology and Therapeutics. Vol. 83, Nr. 5, 2008, S. 761–769, doi:10.1038/sj.clpt.6100400, PMID 17957183.
- R. Schubert: Liposomen. In: U. Weidenauer, K. Mäder (Hrsg.): Innovative Arzneiformen. Wissenschaftliche Verlagsgesellschaft, Oktober 2009, S. 162.
- Rare disease (orphan) designations, abgerufen am 4. Februar 2013.