Fingolimod
Fingolimod (Handelsname Gilenya; Hersteller Novartis) ist ein Arzneistoff aus der Gruppe der Immunsuppressiva, der in der Behandlung der Multiplen Sklerose (MS) eingesetzt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
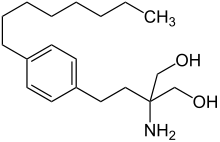 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Fingolimod | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C19H33NO2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L04AA27 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 307,47 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
7,82 (konjugierte Säure)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Der Arzneistoff ist eine synthetische Nachbildung des natürlichen Wirkstoffs Myriocin. Myriocin stammt aus dem Pilz Isaria sinclairii. Fingolimod wirkt als Sphingosin-1-phosphat-Analogon. Es hält eine wichtige Untergruppe der weißen Blutkörperchen, die Lymphozyten, in den Lymphknoten zurück und senkt so die Zahl von Lymphozyten, die in das Zentralnervensystem einwandern und dort Nervenbahnen von Patienten mit MS schädigen könnten.
Anwendungsgebiete (Indikationen)
Multiple Sklerose (MS)
Fingolimod ist in der Europäischen Union (EU) zur Behandlung von Patienten mit hochaktiver, schubförmig-remittierender MS als Alternativtherapie nach einer Behandlung mit Interferon-Beta oder bei Patienten mit einer rasch fortschreitenden, schweren MS zugelassen. In der Schweiz ist der Arzneistoff zur Behandlung von Patienten mit schubförmig remittierender MS zur Senkung der Schubhäufigkeit und zur Verzögerung des Fortschreitens der Behinderung zugelassen.
Im November 2018 erhielt Novartis die Zulassung für Therapie von Kindern und Jugendlichen mit Multipler Sklerose.[6][7]
In der abgeschlossenen Phase-II-Studie wurden 281 MS-Patienten behandelt. Nach sechs Monaten konnte eine Verringerung der aktiven Herde in der Kernspintomografie von bis zu 80 % (Median; im Mittel bis zu 60 %) sowie eine Reduktion der Schubrate von ca. 50 % im Vergleich zu Placebo festgestellt werden.[8] In einer 18-monatigen offenen Anschlussstudie konnte gezeigt werden, dass die festgestellten positiven Effekte über diesen Zeitraum anhielten.[9]
In Entwicklungsphase III wurde seit 2006 bei Patienten mit einer schubförmig remittierender Verlaufsform untersucht, ob die in der Phase II beobachteten Wirkungen über längere Zeit stabil bleiben und ob eine Behandlung mit Fingolimod die Entwicklung der mit der MS verbundenen Behinderung verlangsamen kann. Diese Studien wiesen eine Wirksamkeit hinsichtlich Schubrate und Fortschreiten der Behinderung nach.[10][11]
Bis Ende 2014 wurde Fingolimod erfolglos als Behandlungsoption für Patienten mit primär-progredienter Multipler Sklerose untersucht.[12]
Nierentransplantation
Novartis testete Fingolimod auch in Kombination mit Ciclosporin zur Unterdrückung der Abstoßungsreaktion nach Nierentransplantation. In der klinischen Prüfung der Phase III zeigten sich jedoch Nebenwirkungen (Makula-Ödeme) besonders bei Diabetikern mit Prädisposition zu diabetischer Retinopathie. Zusätzlich trat eine leichte Funktionseinschränkung der frisch transplantierten Nieren auf. Da die Unterdrückung der Abstoßungsreaktion mit Fingolimod nicht besser war als die in der Kontrollgruppe mit Mycophenolatmofetil, wurde die Entwicklung von Fingolimod für die Transplantationsmedizin eingestellt.
Unerwünschte Wirkungen (Nebenwirkungen)
Fingolimod senkt die Anzahl der weißen Blutkörperchen. Diese Wirkung ist für die Behandlung der MS erwünscht. Weiße Blutkörperchen sind jedoch auch zur Abwehr von Infektionen erforderlich. Eine Behandlung mit Fingolimod könnte zu einer höheren Anfälligkeit für Infektionen führen. Bereits bestehende Infektionen könnten sich verschlechtern. 2008 wurden zwei Fälle von schwerwiegenden Infektionen unter Fingolimod bekannt. Ein MS-Patient starb an Windpocken, während ein zweiter Patient eine lebensbedrohliche Herpes-Enzephalitis entwickelte.[13] In beiden Fällen gab es allerdings Begleitumstände, die den Verlauf der Infektionen möglicherweise ungünstig beeinflusst haben: Der erste Patient wurde zeitgleich mit hohen Glucocorticoid-Dosen behandelt, während die antivirale Behandlung des zweiten Patienten nur mit Verzug begonnen wurde.
Die FDA warnte bereits in 2013 vor dem erhöhten Risiko der Entwicklung einer progressiven multifokalen Leukenzephalopathie (PML) unter Fingolimod.[14] Im Januar 2016 machte der Hersteller Novartis in einem Rote-Hand-Brief (RHB) auf das PML-Risiko aufmerksam.[15]
In einem RHB vom September 2019 machte Novartis darauf aufmerksam, dass aufgrund des Risikos für angeborene Fehlbildungen bei Föten Fingolimod kontraindiziert ist während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Verhütungsmethode anwenden.[16]
Eine Übersicht über die RHB der vergangenen Jahre findet sich auf der WebSite der Arzneimittelkommission der deutschen Ärzteschaft.[17]
Auch kardiale Nebenwirkungen werden beschrieben: Bei dauerhafter Behandlung kann es zu einem moderaten Anstieg des Blutdrucks kommen. Nach der ersten Einnahme von Fingolimod kann ein deutlicher Abfall der Herzfrequenz (Bradykardie) und Abnahme der atrioventrikulären Erregungsleitung beobachtet werden. Diese Wirkung bildet sich normalerweise nach einigen Stunden zurück und tritt bei kontinuierlicher Einnahme des Arzneistoffs nicht erneut auf. Nachdem einzelne Fälle von schweren Herz-Kreislauf-Störungen bekannt geworden waren, wurde im Januar 2012 als Maßnahme eine entsprechende Therapieüberwachung empfohlen: bei allen Patienten ist innerhalb der ersten 6 Stunden nach Therapiebeginn laufend Herzfrequenz, Blutdruck und EKG zu kontrollieren, gegebenenfalls muss die Überwachung auch darüber hinaus weitergeführt werden.[18] Nach einer Nutzen-Risiko-Bewertung seitens der Europäischen Arzneimittelagentur (EMA) soll Fingolimod ferner möglichst nicht gleichzeitig mit Medikamenten verabreicht werden, die die Herzfrequenz verlangsamen und möglichst nicht bei Patienten mit bestimmten Herzerkrankungen angewendet werden.[19][20] Im Januar 2013 verschickte der Hersteller Novartis erneut in einem (Rote-Hand-Brief) eine überarbeitete Empfehlung, wann die Überwachung analog zur Erstgabe von Fingolimod wiederholt werden sollte.[21]
Im November 2013 informierte der Hersteller Novartis in einem Rote-Hand-Brief über zwei Fälle eines hämophagozytischen Syndroms (HPS) mit Todesfolge bei mit Fingolimod behandelten Patienten.[22]
Bei einigen Patienten wurden Schwellungen im zentralen Sehbereich des Augenhintergrunds beobachtet (Makulaödem). Ein Makulaödem kann Sehstörungen auslösen.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Im Gegensatz zu vielen bisher verfügbaren immunsuppressiven Medikamenten werden durch Fingolimod die Immunzellen nicht abgetötet oder an der Vermehrung gehindert. Stattdessen hemmt Fingolimod die Wanderung von Lymphozyten aus den lymphoiden Organen ins Blut und senkt so die Zahl entzündungsfördernder Lymphozyten, die im Zentralnervensystem schädigend wirken könnten.
Fingolimod wird nach Einnahme durch das Enzym Sphingosin-Kinase-2 zu FTY720-Phosphat (FTY720-P) umgebaut, das dann an die auf Zelloberflächen vorhandenen Sphingosin-1-phosphat-(S1P)-Rezeptoren S1P1, S1P3, S1P4, und S1P5 binden kann.[23] Wesentlich für den Wirkmechanismus von FTY720-P ist vor allem der S1P1-Rezeptor auf T- und B-Lymphozyten. S1P1-Rezeptoren werden von FTY720-P 'internalisiert', das heißt, aus der Zellmembran ins Innere der Zelle verlagert und abgebaut.[24][25] Dieser Abbau ist für die Hemmung der S1P1-abhängigen Auswanderung der Lymphozyten aus den Lymphknoten ins Blut[24] und die infolgedessen verminderte Einwanderung entzündungsfördernder Zellen in periphere Organe und ins Zentralnervensystem verantwortlich.[24][25][26]
Frühe Nutzenbewertung
Seit 2011 müssen sich – in Deutschland – neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Dies gilt auch für Fingolimod. Eine Beschlussfassung hinsichtlich des „Zusatznutzen“ von Fingolimod durch den G-BA fand Ende März 2012 statt.[27] Laut G-BA wurde dem Wirkstoff Fingolimod Anhaltspunkte für einen geringen Zusatznutzen durch eine statistisch signifikante Reduktion grippeähnlicher Symptome bei Patienten mit einem fortschreitenden schweren schubförmig remittierenden Verlauf bestätigt. Die Geltungsdauer des Beschlusses wurde allerdings aufgrund eines erhöhten Risikoprofils sowie des schwachen Nutzenbelegs auf drei Jahre befristet.[28][29] In einer neuen Nutzenbewertung kommt das IQWiG im März 2016 zum Ergebnis: kein Anhaltspunkt für Zusatznutzen im neuen Anwendungsgebiet. Der Gemeinsame Bundesausschuss (G-BA) aber fasst den abschließenden Beschluss über das Ausmaß des Zusatznutzens.[30]
Geschichtliches
Anfang der 1990er-Jahre entdeckte ein japanisches Forscherteam der Universität Kyōto die immunsuppressive Wirkung von Myriocin. Myriocin wurde chemisch zu FTY720 (Fingolimod) verändert und so eine bessere Verträglichkeit erzielt. 1997 lizenzierte das japanische Unternehmen Yoshitomi Fingolimod an Novartis aus.[13] Der Arzneistoff wurde zunächst in Kombination mit Cyclosporin zur Unterdrückung der Abstoßungsreaktion nach Nierentransplantation klinisch getestet; später wurde die Entwicklung von Fingolimod für die Transplantationsmedizin jedoch eingestellt.
Die Erstzulassungen des Wirkstoffs für MS erfolgten 2010 in Russland[31] und den USA.[32] 2011 wurde Fingolimod auch in der Schweiz und in der EU zugelassen.
Handelsnamen
Der Handelsname von Fingolimod ist Gilenya. Novartis hatte zuvor den Namen Gilenia bekanntgegeben, änderte ihn aber später auf die heutige Form ab.
Weblinks
- Gilenya: Produktinformation, Beurteilungsbericht und post-authorisation-Maßnahmen auf der Seite der Europäischen Arzneimittelagentur. (englisch, teilweise deutsch)
- Gilenya® (Fingolimod) (PDF; 289 kB) Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), 5. Juli 2011.
- Einträge im NIH-Studienregister
- Rote-Hand-Briefe seit Januar 2012 zu Gilenya® (Fingolimod)
Einzelnachweise
- Externe Identifikatoren von bzw. Datenbank-Links zu Fingolimod Hydrochlorid: CAS-Nummer: 162359-56-0, EG-Nummer: 680-631-1, ECHA-InfoCard: 100.205.740, PubChem: 107969, ChemSpider: 97086, Wikidata: Q27132395.
- Sanghee Kim, Hyeseung Lee, Minhee Lee, Taeho Lee: Efficient Synthesis of the Immunosuppressive Agent FTY720. In: Synthesis, 2006, S. 753–755. doi:10.1055/s-2006-926342.
- Eintrag zu Fingolimod. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- FDA-Memorandum Fingolimod. S. 11; fda.gov (PDF; 4,5 MB)
- Datenblatt Fingolimod hydrochloride bei Sigma-Aldrich, abgerufen am 20. November 2021 (PDF).
- Novartis erhält Empfehlung zur EU-Zulassung von Therapie zur Behandlung von Kindern und Jugendlichen mit Multipler Sklerose (MS), PM Novartis vom 25. September 2018, abgerufen am 20. März 2019
- Novartis announces EU approval of Gilenya® for children and adolescents with MS, making it the first and only oral disease-modifying treatment for these patients in Europe, PM Novartis vom 29. November 2018, abgerufen am 20. März 2019
- L. Kappos, J. Antel u. a.: Oral fingolimod (FTY720) for relapsing multiple sclerosis. In: The New England Journal of Medicine, Band 355, Nummer 11, September 2006, S. 1124–1140; doi:10.1056/NEJMoa052643. PMID 16971719.
- P. O’Connor, G. Comi u. a.: Oral fingolimod (FTY720) in multiple sclerosis: two-year results of a phase II extension study. In: Neurology, Band 72, Nummer 1, Januar 2009, S. 73–79; doi:10.1212/01.wnl.0000338569.32367.3d. PMID 19122034.
- J. A. Cohen, F. Barkhof u. a.: Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. In: The New England Journal of Medicine, Band 362, Nummer 5, Februar 2010, S. 402–415; doi:10.1056/NEJMoa0907839. PMID 20089954.
- L. Kappos, E. W. Radue u. a.: A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. In: The New England Journal of Medicine, Band 362, Nummer 5, Februar 2010, S. 387–401; doi:10.1056/NEJMoa0909494. PMID 20089952.
- Primär progrediente Multiple Sklerose: Fingolimod enttäuscht in Phase III Studie. DMSG, 1. Dezember 2014.
- K. Garber: Infections cast cloud over Novartis’ MS therapy. In: Nature Biotechnol. 26, 2008, S. 844–845. PMID 18688218.
- FDA Drug Safety Communication.
- Fingolimod (Gilenya®): Risiken im Zusammenhang mit den Auswirkungen auf das Immunsystem (PDF; 941 kB) WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), abgerufen am 30. Oktober 2019
- Fingolimod (Gilenya®): Neue Kontraindikation bei Anwendung während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Verhütungsmethode anwenden (PDF; 770 kB) WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), abgerufen am 30. Oktober 2019
- AKdA, Suche nach RHB´s auf der Website der AKdA
- Rote-Hand-Brief zur strengeren kardiovaskulären Überwachung. (PDF; 674 kB), 26. Januar 2012, abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- European Medicines Agency gives new advice to better manage risk of adverse effects on the heart with Gilenya. abgerufen von WebSite der EMA (englisch).
- Rote-Hand-Brief mit Aktualisierungen zur kardiovaskulären Überwachung (PDF; 2,2 MB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Rote Hand Brief von Novartis im Januar 2013. (PDF; 120 kB) Abgerufen am 8. Januar 2013.
- Rote Hand Brief von Novartis im November 2013. (PDF; 535 kB) Abgerufen am 15. November 2013.
- V. Brinkmann, M. D. Davies, C. E. Heise u. a.: The immune modulator FTY720 targets sphingosine 1-phosphate receptors. In: J Biol Chem. 277, 2002, S. 21453–21457. PMID 11967257
- M. Matloubian, C. Lo, G. Cinnamon u. a.: Lymphocyte egress from thymus and peripheral lymphoid organs is sphingosine 1-phosphate receptor-1 dependent. In: Nature. 427, 2004, S. 355–360. PMID 14737169.
- V. Brinkmann, J. G. Cyster, T. Hla: FTY720: Sphingosine 1-phosphate receptor-1 in the control of lymphocyte egress and endothelial barrier function. In: Am J Transplant. 4, 2004, S. 1019–1025. PMID 15196057
- V. Brinkmann: Sphingosine 1-phosphate receptors in health and disease: Mechanistic insights from gene deletion studies and reverse pharmacology. In: Pharm Ther. 115, 2007, S. 84–105. PMID 17561264
- Wirkstoff: Fingolimod. G-BA, Informationsarchiv – Frühe Nutzenbewertung (§ 35a SGB V); abgerufen am 29. März 2012.
- Frühe Nutzenbewertung: G-BA trifft sechs weitere Entscheidungen. G-BA, Pressemitteilung, 29. März 2012.
- BMG: Bekanntmachung eines Beschlusses (PDF; 2,1 MB), Veröffentlichung im Bundesanzeiger (BAnz AT 04.05.2012 B3).
- Fingolimod bei Multipler Sklerose: kein Anhaltspunkt für Zusatznutzen im neuen Anwendungsgebiet. PM des IQWiG vom 1. März 2016; abgerufen am 1. März 2016.
- Novartis announces Russian regulatory approval for Gilenya. (PDF; 119 kB) Novartis AG. hugin.info, Pressemitteilung, 10. September 2010; abgerufen am 29. September 2010.
- Novartis erhält die Zulassung der FDA für Gilenya. (PDF; 40 kB) Novartis AG. hugin.info, Pressemitteilung, 22. September 2010; abgerufen am 29. September 2010.