Beta-Interferon
Beta-Interferon (auch: Interferon beta oder IFN-β genannt) ist ein Glykoprotein aus der Familie der Interferone. Interferone sind Botenstoffe, die natürlich im Körper vorkommen. Sie gehören zur Familie der Zytokine und wirken antiviral, antiproliferativ, antitumoral und immunmodulierend.[1][2][3]
| Beta-Interferon | ||
|---|---|---|
|
Vorhandene Strukturdaten: 1AU1 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 20,1 kDa / 166 AS | |
| Bezeichner | ||
| Gen-Name | IFNB1 | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | L03AB07, L03AB08 | |
| DrugBank | DB00060 | |
| Wirkstoffklasse | Interferone | |
Interferone werden in drei Hauptgruppen eingeteilt: Alpha-Interferon, Beta-Interferon und Gamma-Interferon. Interferon beta wird physiologisch, also z. B. im menschlichen Körper von verschiedenen Zelltypen, z. B. Fibroblasten und Makrophagen, produziert und sezerniert.[1]
Rekombinante, also biotechnologisch hergestellte, humane Beta-Interferone werden als Medikamente der ersten Wahl zur Basistherapie der schubförmigen Multiplen Sklerose (MS) eingesetzt.[4][5][6][7]
Chemische Klassifikation
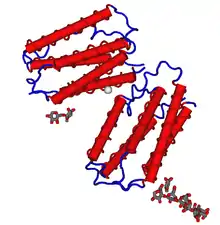
Humanes, physiologisch gebildetes Beta-Interferon besteht aus 166 Aminosäuren und besitzt eine komplexe Seitenkette aus Kohlenhydraten, die über ein Stickstoffatom mit dem Aminosäurengerüst an Position 80 (Asparagin) verbunden ist.
| Die Aminosäurensequenz von natürlichem, menschlichen Interferon beta ist: |
MSYNLLGFLQ RSSNFQCQKL LWQLNGRLEY CLKDRMNFDI PEEIKQLQQF
QKEDAALTIY EMLQNIFAIF RQDSSSTGWN ETIVENLLAN VYHQINHLKT
VLEEKLEKED FTRGKLMSSL HLKRYYGRIL HYLKAKEYSH CAWTIVRVEI
LRNFYFINRL TGYLRN |
Die Cysteinreste in den Positionen 31 und 141 (unterstrichen dargestellt) sind über eine Disulfidbrücke miteinander verbunden. In Position 17 enthält die Aminosäurenkette ein weiteres Cystein (rot dargestellt). Die molare Masse des Proteinanteils beträgt rechnerisch rund 20 kDa,[8] das glykosylierte Molekül verfügt über eine Molmasse von 22,5 kDa.[9] Interferon-beta ist ein Typ-I-Interferon, das an die gleichen Rezeptoren (IFNAR) auf der Zelloberfläche bindet wie Interferon-alpha. Auch seine Wirkung entspricht in etwa der des Interferon-alpha. Es wird vor allem von virusinfizierten Fibroblasten und Makrophagen, wahrscheinlich aber auch von anderen Zelltypen gebildet.
Rekombinante Varianten
Man unterscheidet Interferon beta-1a und Interferon beta-1b. Gemäß den Empfehlungen des Interferon Nomenclature Committe[10] tragen solche Varianten, die von Untereinheiten des menschlichen IFN-beta-Gens produziert werden, im Namen hinter beta einen Bindestrich und eine Nummer, z. B. Interferon beta-1. Weiterhin wird die Zahl durch einen Buchstaben spezifiziert, der die Peptidsequenz an bestimmten Positionen der Kette beschreibt.
Interferon beta-1a wird mithilfe von Säugetierzellen (Ovarialzellen des chinesischen Hamsters: CHO-Zellen) produziert, während zur Herstellung von Interferon beta-1b genetisch modifizierte Bakterien (Escherichia coli) verwendet werden. Der Proteinanteil von Interferon beta-1a ist identisch mit dem des humanen, physiologisch gebildeten Beta-Interferons, das Glycosylierungsmuster ist sehr ähnlich. Dagegen ist Interferon beta-1b nicht glycosyliert und unterscheidet sich auch im Proteinanteil strukturell vom natürlichen humanen Beta-Interferon. In Position 17 enthält die Aminosäurenkette anstelle von Cystein die strukturell nahezu identische, aber schwefelfreie Aminosäure Serin, so dass keine falschen Disulfidbrücken ausgebildet werden können. Die N-terminale Aminosäure Methionin ist abhydrolisiert.
| Rekombinante Variante | Hergestellt aus | Aminosäurensequenz | Glycosylierung | Relative Molmasse | CAS-Nr. | DrugBank |
| Interferon beta-1a | CHO-K1 | Position 1 = Met, Position 17 = Cys | Ja | Circa 22,5 kD | 0145258-61-3 | DB00060 |
| Interferon beta-1b | E. coli | Position 1 entfällt, Position 17 = Ser | Nein | Circa 19,9 kD | 0090598-63-3 | DB00068 |
Interferon beta-Proteinmischungen werden als Interferon beta-n1, Interferon beta-n2 etc. bezeichnet.
Wirkungsmechanismus
Die Wirkung der Beta-Interferone wird in erster Linie durch ihre immunmodulatorischen Eigenschaften erklärt: Die Bindung an den Rezeptor stößt intrazellulär eine Reaktionskaskade an, die in die Expression zahlreicher Interferon-abhängig induzierter Proteine mündet. Diese Proteine gelten als Mediatoren der Beta-Interferonwirkung, z. B. der Verstärkung der Suppressoraktivität peripherer Lymphozyten. Nach heutigen Erkenntnissen handelt es sich bei der MS um eine T-Lymphozyten vermittelte Autoimmunkrankheit: Aktivierte T-Lymphozyten, die gegen verschiedene Antigene des Nervenscheideproteins Myelin gerichtet sind, überwinden die Blut-Hirn-Schranke und dringen in das zentrale Nervensystem ein. Dadurch wird eine Entzündungskaskade aktiviert, die letztendlich zum Auftreten der typischen Erkrankungsmerkmale der MS führt.
Therapeutische Verwendung
Rekombinantes Interferon beta wird als Medikament der ersten Wahl zur Basistherapie der schubförmigen Multiplen Sklerose (MS) eingesetzt. Es verlangsamt das Fortschreiten der Erkrankung, vermindert die Frequenz der Schübe und vermindert deren Schweregrad.[4][5][6][7] Studienergebnisse legen nahe, sie möglichst früh im Krankheitsverlauf einzusetzen. Die Erfahrung in der Behandlung hat gezeigt, dass es umso schwieriger ist, den Verlauf der MS zu beeinflussen, je weiter fortgeschritten die Erkrankung ist.[4][11]
Rebif, Avonex und Betaferon sind zusätzlich auch zugelassen für Patienten mit einem so genannten klinisch isolierten MS-typischen-Syndrom (CIS). Das sind Patienten nach einem einmaligen demyelinisierenden Ereignis mit entzündlichem Prozess, wenn dieses demyelinisierende Ereignis eine intravenöse Kortikosteroidtherapie rechtfertigt, alternative Diagnosen ausgeschlossen wurden und ein hohes Risiko für die Entwicklung einer klinisch sicheren Multiplen Sklerose besteht.[4]
Mit Beta-Interferonen kamen erstmals Arzneistoffe auf den Markt, für die zweifelsfrei nachgewiesen werden konnte, dass sie den klinischen Langzeitverlauf der schubförmigen MS günstig beeinflussen, die Frequenz und Schwere von Krankheitsschüben reduzieren und die Progression der Erkrankung verlangsamen.
Untersuchungen weisen darauf hin, dass der Nutzen der Behandlung einer Interferon beta-Therapie bei der MS von der Dosis und der Verabreichungshäufigkeit abhängt. Diese Beziehung konnte bei der Schubrate und dem Schweregrad der Schübe, dem verlangsamten Fortschreiten der Krankheit sowie besonders bei der Anzahl der Läsionen in Gehirn und Rückenmark gezeigt werden.[12][13]
Seit Herbst 2019 sind die Beta-Interferone (z. B. Betaferon[14], Rebif) auch zugelassen, wenn eine Schwangerschaft oder Kinderwunsch besteht. Wenn aus klinischer Sicht notwendig, muss die Therapie nicht wegen einer Schwangerschaft unterbrochen oder verschoben werden. Da keine gesundheitsschädlichen Auswirkungen für das Kind zu erwarten sind, ist Stillen uneingeschränkt unter Interferon beta möglich.[15][16]
Beta-Interferon ist ferner als Orphan-Arzneimittel ausgewiesen zur Behandlung des akuten Lungenversagens.[17]
Chemisch modifizierte Abkömmlinge sind PEGylierte Beta-Interferone (Peginterferon β). PEGylierung bedeutet eine Bindung des Wirkstoffes mit Polyethylenglycol (PEG), die eine deutlich langsamere Freisetzung des Wirkstoffes (Retardierung) ermöglicht. Diese Form der Modifizierung wird auch bei Alpha-Interferon angewandt (Peginterferon α).
Seit März 2020 wird Beta-Inferon, in Kombination mit Lopinavir und Ritonavir, gegen SARS-CoV-2 im Rahmen der „Solidarity“-Studie der Weltgesundheitsorganisation an Patienten getestet.[18]
Unerwünschte Wirkungen
Wie bei allen Interferonen sind die häufigsten Nebenwirkungen von Interferon beta grippeähnliche Symptome wie Muskelschmerzen, Fieber, Schüttelfrost, Asthenie und Kopfschmerzen. Diese treten zu Beginn der Behandlung sehr häufig auf, nehmen aber bei den meisten Patienten im Laufe der Therapie ab. Weitere sehr häufige oder häufige Nebenwirkungen sind (je nach Präparat): Leberprobleme (der Anstieg von Leberwerten im Blut wird während der Behandlung mit regelmäßigen Blutuntersuchungen überprüft),[19] Abnahme der weißen oder der roten Blutkörperchen, Depressionen, Schlafstörungen, Durchfall, Übelkeit, Erbrechen, Pruritus, Taubheitsgefühl und Kribbeln der Haut, erhöhte Körpertemperatur, Schmerzen in den Muskeln und Gelenken, Muskelsteifigkeit, Verwirrtheit, Ohrenschmerzen, Palpitationen, Tachykardie, Blutveränderungen die zu Müdigkeit oder verminderter Infektionsabwehr führen können, laufende Nase, erhöhter Blutdruck, sowie Veränderungen an der Injektionsstelle. Gelegentlich können Nierenprobleme, Epileptische Anfälle, Atemprobleme, Netzhautstörungen, Stimmungsschwankungen, Schilddrüsenfunktionsstörungen, Krampfanfälle, Haarausfall, Veränderungen der Monatsblutung, sowie schwere allergische Reaktionen auftreten.[20][21][22][23]
Zu den seltenen Nebenwirkungen zählen Fälle der thrombotisch-thrombozytopenischen Purpura und auch des nephrotischen Syndroms. Diese seltenen lebensbedrohlichen Erkrankungen können Wochen bis Jahre nach Behandlungsbeginn mit Beta-Interferon auftreten. Bei Auftreten dieser beiden Erkrankungen ist die Therapie sofort abzubrechen. Trotz dieser gemeldeten Fälle ergibt sich keine Änderung der positiven Nutzen-Risiko-Bewertung von Beta-Interferon-Präparaten, deren Sicherheitsprofil durch über mehr als 20 Jahre der breiten Anwendung bei der Multiplen Sklerose gut bekannt ist.[24]
Handelspräparate
- Interferon beta-1a: Avonex (EU, CH, USA, CND), Rebif (EU, CH, USA, CND), Plegridy
- Interferon beta-1b: Betaferon (EU, CH), Betaseron (USA, CND), Extavia (EU, CND), Uribeta (MX)
Beta-Interferone werden parenteral verabreicht. Sie liegen in Form fertiger Lösung für die subkutane (z. B. Rebif; Standarddosierung: 44 µg, dreimal pro Woche mittels Injektionshilfe RebiSmart) oder intramuskuläre Injektion (z. B. Avonex; 30 µg, einmal pro Woche) vor oder als Lyophilisate, die kurz vor der Anwendung durch Auflösen gebrauchsfertig gemacht und intramuskulär (z. B. Avonex; 30 µg, einmal pro Woche) oder subkutan verabreicht werden (z. B. Betaferon, Extavia; 250 µg, jeden zweiten Tag). Plegridy enthält eine pegylierte Form von Interferon beta-1a und muss nur alle zwei Wochen injiziert werden.
Auch wenn sich die Beta-Interferone gleichen, gibt es Unterschiede zwischen den einzelnen Präparaten z. B. in Bezug auf die Schnelligkeit des Wirkeintritts, der im MRT sichtbar ist: bei 3× wöchentlicher Gabe von Rebif zeigte sich bereits nach vier Wochen eine Reduktion der Kontrastmittel anreichernden Läsionen gegenüber Placebo.[25] Auch lassen sich eine signifikant stärkere Schubraten-reduktion ((Panitch H, Goodin D, Francis G et al. J Neurol Sci. 2005 Dec 15;239(1):67-74)) sowie weniger Grippe-ähnliche Nebenwirkungen beobachten.[26]
Literatur
- R.A. Rudick: Management of Multiple Sclerosis. In: N Engl J Med. 337, November 1997, S. 1604–1611. doi:10.1056/NEJM199711273372207.
Weblinks
- MS behandeln Beta-Interferon auf der WebSite der Deutschen Multiple Sklerose Gesellschaft (DMSG)
- Was tun? Therapieoptionen bei MS auf "Leben mit MS" der Firma Merck Serono GmbH
Einzelnachweise
- B. Wick, M. Schulz, W.C. Janzen: beta-Interferone: neue Hoffnungfür MS-Patienten. In: Pharmazeutische Zeitung. Nr. 28/2000, 2000.
- Rieckmann et al.: Rekombinante Beta-Interferone: Immunmodulatorische Therapie der schubförmigen Multiplen Sklerose. Deutsches Ärzteblatt 93, Ausgabe 46 vom 15. November 1996, Seite A-3022 Volltext
- Filippini et al.: Interferons in relapsing remitting multiple sclerosis: a systematic review. In: Lancet. Band 361, Nummer 9357, Februar 2003, S. 545–552, doi:10.1016/S0140-6736(03)12512-3. PMID 12598138. (Metaanalyse).
- Avonex® Fachinformation, Rote Liste, Fachinfo-Service, abgerufen im Februar 2014
- Betaferon® Fachinformation, Rote Liste, Fachinfo-Service, abgerufen im Februar 2014
- Extavia® Fachinformation, Rote Liste, Fachinfo-Service, abgerufen im Februar 2014
- Rebif® Fachinformation, Rote Liste, Fachinfo-Service, abgerufen im Februar 2014
- K. Hardtke et al. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 7.6, Konzentrierte Interferon-beta-1a-Lösung. Loseblattsammlung, 45. Lieferung 2013, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Europäisches Arzneibuch, Ausgabe 7, 6. Nachtrag, S. 7262
- J. Vilcek in Archives of Virology, Band 77, 1983, S. 283–285.
- Leray et al.: Evidence for a two-stage disability progression in multiple sclerosis. In: Brain. Band 133, Nummer 7, April 2010, S. 1900–1913, doi:10.1093/brain/awq076.
- S. Schwid, H. Panitch: Full results of the Evidence of Interferon Dose-Response-European North American Comparative Efficacy (EVIDENCE) study: A multicenter, randomized, assessor-blinded comparison of low-dose weekly versus high-dose, high-frequency interferon β-1a for relapsing multiple sclerosis. In: Clinical Therapeutics. Band 29, Nr. 9, 2007, S. 2031–2048, doi:10.1016/j.clinthera.2007.09.025.
- L. Kappos, A. Traboulsee, C. Constantinescu, J.-P. Erälinna, F. Forrestal, P. Jongen, J. Pollard, M. Sandberg-Wollheim, C. Sindic, B. Stubinski, B. Uitdehaag, D. Li: Long-term subcutaneous interferon beta-1a therapy in patients with relapsing-remitting MS. In: Neurology. Band 67, Nr. 6, 2006, S. 944–953, doi:10.1212/01.wnl.0000237994.95410.ce.
- Betaferon Zulassungsänderung zur Anwendung in der Schwangerschaft und Stillzeit. Abgerufen am 20. Januar 2020.
- CHMP empfiehlt Zulassungsänderung von Rebif® für den klinisch erforderlichen Einsatz während Schwangerschaft und Stillzeit, PM Merck vom 23. September 2019, abgerufen am 28. Oktober 2019
- Summary of Product Characteristics Zulassungstext der EMA am Beispiel von Rebif, abgerufen am 28. Oktober 2019
- Community register of orphan medicinal products, EU/3/07/505.
- Julia Koch: Irres Tempo. In: Der Spiegel. Nr. 14, 2020, S. 106 (online – 28. März 2020).
- Biogen: Gebrauchsinformation peginterferon beta-1a. Biogen, archiviert vom Original am 2. September 2018; abgerufen am 2. September 2018.
- Biogen: Gebrauchsinformation Avonex. Biogen, abgerufen am 2. September 2018.
- Merck: Rebif Gebrauchsinformation: Information für Anwender. Merck, abgerufen am 2. September 2018.
- Bayer: Betaferon Gebrauchsinformation: Information für Anwender. Bayer, abgerufen am 2. September 2018.
- Bayer Vital: Betaferon Gebrauchsinformation für Anwender. Bayer Vital, abgerufen am 2. September 2018.
- Ärztlicher Beirat der Deutschen MS Gesellschaft: Zipp F.,Hartung HP, Flachenecker P, Stellungnahme Medizin/Therapie Nr. 1, August 2014.
- De Stefano N et al.: Rapid benefits of a new formulation of subcutaneous interferon beta-1a in relapsing-remitting multiple sclerosis; In: Mult Scler. 2010; Band 7, Seiten 888-892; doi: 10.1177/1352458510362442
- Sandberg-Wollheim M et al.: Comparative tolerance of IFN beta-1a regimens in patients with relapsing multiple sclerosis. The EVIDENCE study. In: J Neurol. 2005; Band 252 (1), Seiten8-13; doi:10.1007/s00415-005-0589-2