Fampridin
Fampridin (Handelsname Fampyra®; Hersteller Biogen) ist ein Arzneistoff aus der Gruppe der reversiblen Kaliumkanal-Blocker, der als erstes Medikament bei allen Verlaufsformen der Multiplen Sklerose (MS) zur Verbesserung der Gehfähigkeit von erwachsenen MS-Patienten (EDSS 4–7) eingesetzt wird.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
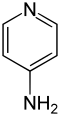 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fampridin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H6N2 | |||||||||||||||||||||
| Kurzbeschreibung |
beiger Feststoff mit unangenehmem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N07XX07 | |||||||||||||||||||||
| Wirkmechanismus |
Kaliumkanal-Blocker | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 94,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,26 g·cm−3 (25 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
274 °C[1] | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (83 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemisch ist der Stoff den Aminopyridinen zuzuordnen.
Verwendung als Arzneimittel
Anwendungsgebiete (Indikationen)
Wenn eine MS weiter fortgeschritten ist, können die Betroffenen eine Gehbehinderung entwickeln, die durch Krankengymnastik und bestimmte, z. B. krampflösende Medikamente behandelt werden kann. Hat die Gehbehinderung einen bestimmten Schweregrad, kommt eine Behandlung mit Fampridin infrage. Fampridin ist in Deutschland seit 2011 für Patienten zugelassen, die als Folge einer Multiplen Sklerose (MS) eine Gehbehinderung höheren Grades haben (Grad 4–7 auf der EDSS-Behinderungsskala).[4]
Art und Dauer der Anwendung
Die empfohlene Dosis beträgt je eine 10 mg Tablette zweimal täglich, im Abstand von 12 Stunden (eine Tablette morgens und eine Tablette abends). Fampyra darf nicht häufiger oder in höheren Dosen als empfohlen eingenommen werden.[4]
Gegenanzeigen (Kontraindikationen)
Zu den Gegenanzeigen zählen Überempfindlichkeit gegen Fampridin, Krampfleiden, chronisches Nierenversagen oder eine gleichzeitige Behandlung mit Hemmstoffen des organischen Kationentransporters 2 (OTC2), z. B. Cimetidin.[4]
Unerwünschte Wirkungen (Nebenwirkungen)
Fampridin ist ein Wirkstoff mit einer engen therapeutischen Breite. Zu den Nebenwirkungen gehören Parästhesien, Harnwegsinfekte, Schlaflosigkeit, Schwindel, Kopfschmerz, Übelkeit, Asthenie, Rückenschmerzen, Gleichgewichtsstörungen sowie in seltenen Fällen auch Krampfanfälle und Vorhofflimmern.[5][6]
Wirkungsmechanismus (Pharmakodynamik)
Fampridin ist ein Kaliumkanalblocker. Er wirkt auf geschädigte Nerven, wo er verhindert, dass Kaliumionen aus den Nervenzellen entweichen. Es wird angenommen, dass dadurch die elektrischen Impulse weiter an den Nerven entlang wandern können, um die Muskeln zu stimulieren. Dadurch wird das Gehen erleichtert.[7]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Die Fampyra Retardtablette bewirkt eine Verzögerung der Resorption von Fampridin, was sich durch einen langsameren Anstieg zu einer niedrigeren Spitzenkonzentration ohne Auswirkung auf die Resorptionsrate bemerkbar macht.[4]
AMNOG-Verhandlungen / Erstattungsfähigkeit
Der GKV-Spitzenverband und das Unternehmen Biogen Idec haben sich auf einen Erstattungsbetrag für Fampyra (Fampridin) geeinigt. Der verhandelte Erstattungsbetrag spiegelt den Interessensausgleich zwischen den gesetzlichen Krankenkassen und Biogen Idec wider. Mit ihm liegt erstmals ein Verhandlungsergebnis für ein neues Arzneimittel mit einer nicht-medikamentösen zweckmäßigen Vergleichstherapie vor. Für den verordnenden Arzt bedeutet dies im Falle von Fampridin, dass es sowohl in Kombination mit, als auch ohne Krankengymnastik verordnet werden kann und bei adäquatem Einsatz im zugelassenen Anwendungsgebiet erstattungsfähig ist.[8]
Studien
- Nach Abzug der Ansprechrate unter Placebo profitierten in den Zulassungsstudien etwa 30 % der mit Fampridin behandelten Patienten von einer verbesserten Gehfähigkeit: ca. 20 % der Patienten konnten eine bestimmte Gehstrecke 10 bis 20 % schneller zurücklegen und für ca. 10 % der Patienten verbesserte sich die Gehgeschwindigkeit um 20 % und mehr. Die Patienten in diesen Studien wurden maximal 14 Wochen mit Fampridin behandelt.[9][10]
- In einer Zwischenauswertung der laufenden ENABLE-Studie (Lebensqualität) zeigte sich eine signifikante Verbesserung der subjektiven Einschätzung der gesundheitsbezogenen Lebensqualität durch die Steigerung der Gehfähigkeit mit Fampridin.[11]
- Eine weitere Zwischenauswertung der laufenden ENABLE-Studie zeigte, dass der Effekt von Fampridin auf die Verbesserung der Gehfähigkeit und die damit verbundene gesundheitsbezogene Lebensqualität über 48 Wochen anhielt.[12]
Geschichtliches
Fampridin wurde erstmals 1902 durch den Karlsruher Chemiker Rudolf Camps synthetisiert.[13] Der internationale Freiname (INN) Fampridin wurde 1995 erteilt.[14] Abweichend davon wurde 2010 in den USA der Freiname Dalfampridine (USAN) eingeführt.[15]
2010 erhielt der Hersteller Acorda eine Zulassung für ein Fampridin-haltiges Retard-Arzneimittel zur unterstützenden Behandlung der Multiplen Sklerose.[16] Ein entsprechender Antrag für die EU wurde jedoch zunächst aufgrund eines ungenügenden Nutzen-Risiko-Verhältnisses Anfang 2011 abgewiesen.[17] Nach Widerspruch erhielt Acordas Lizenznehmer Biogen Mitte 2011 eine Zulassung unter der Auflage, weitere Studien durchzuführen.[18][19][20] Für die Schweiz erfolgte die Zulassung durch Swissmedic im August 2018.[21]
Verwendung außerhalb der Humanmedizin
- 4-Aminopyridin wird u. a. zur Herstellung von 4-Halogenpyridinen oder des Wirkstoffs Pinacidil verwendet. 4-(Dimethylamino)pyridin (DMAP), ein an der Aminogruppe dimethyliertes Derivat von Fampridin, ist ein in der präparativen Chemie häufig verwendeter Katalysator. Fampridin wird bei Haus- und Nutztieren in Kombination mit Yohimbin als Aufwachbeschleuniger nach einer Xylazin- und Ketamin-Narkose (»Hellabrunner Mischung«) eingesetzt.[25]
- 4-Aminopyridin wird unter dem Handelsnamen Avitrol als Vogelgift und -repellent verwendet. 4-Aminopyridin vertreibt Vögel, indem die Tiere, die den Giftköder aufgenommen haben, paralysiert werden und Notschreie ausstoßen, wonach der übrige Schwarm verhofft und vergrämt wird.[26]
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Fampridin
Einzelnachweise
- Eintrag zu 4-Aminopyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Datenblatt 4-Aminopyridin bei Sigma-Aldrich, abgerufen am 27. Januar 2020 (PDF).
- Eintrag zu Dalfampridine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Fampyra Fachinformation. Rote Liste, Fachinfo-Service; abgerufen am 27. Februar 2014.
- T. Pickett, R. Enns: Atypical presentation of 4-aminopyridine overdose. In: Ann Emer Med. 27, 1996, S. 382–385. PMID 8599505.
- N. Johnson, M. Morgan: An unusual case of 4-aminopyridine toxicity. In: J Emer Med. 30, 2006, S. 175–177. PMID 16567254.
- Zusammenfassung des EPAR für die Öffentlichkeit. (PDF) WebSite der europäischen Gesundheitsbehörde (EMA); abgerufen am 27. Februar 2014.
- AMNOG-Verhandlungen für MS-Therapeutikum erfolgreich beendet, Gemeinsame PM von GKV-Spitzenverband und Biogen Idec vom 1. März 2013, abgerufen am 27. Februar 2014.
- A. D. Goodman, T. R. Brown, L. B. Krupp u. a.: Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. In: The Lancet. 373, 2009, S. 732–738. PMID 19249634.
- A. D. Goodman, T. R. Brown, K. R. Edwards u. a.: A phase 3 trial of extended release oral dalfampridine in multiple sclerosis. In: Ann Neurol. 68, 2010, S. 494–502. PMID 20976768.
- Richard Macdonnell, Guy Nagels, Per Solberg Sorensen, David Laplaud, Carlo Pozzilli, Ana Silva, Richard Nicholas, Mathias Niedhammer, Julia Gaebler, Sonalee Agarwal and James Potts: Change in Quality of Life Outcomes with Prolonged-Release Fampridine Treatment: Interim Analysis of the ENABLE Study. In: Neurology. Band 80, Supp. 7, 2013, S. P03.218–P03.218 (neurology.org).
- R. Macdonell: Long-term prolonged-release fampridine treatment and health-related quality of life outcomes: 12-month analysis of the ENABLE study. In: ECTRIMS Online Library, 3. Okt 2013, 34145; abgerufen am 27. Februar 2014.
- R. Camps: Ueber einige Harnstoffe, Thioharnstoffe und Urethane des Pyridins. In: Arch Pharm. 240, 1902, S. 345–365. doi:10.1002/ardp.19022400505.
- Recommended International Nonproprietary Names for Pharmaceutical Substances. INN List 35. In: WHO Drug Information. Band 9, Nr. 3, 1995, S. 174 (who.int [PDF]).
- Raymond Lamore III, Elsen Jacob, Susan C. Jacob, Olga Hilas: Dalfampridine (Ampyra). In: Pharmacy and Therapeutics. Band 35, Nr. 12, 2010, S. 665–669, PMC 3008376 (freier Volltext).
- U. S. Food and Drug Administration (22. Januar 2010): FDA Approves Ampyra to Improve Walking in Adults with Multiple Sclerosis. Abgerufen am 26. Januar 2010.
- Refusal of the marketing authorisation for Fampyra (fampridine). (PDF; 51 kB) Europäische Arzneimittelagentur, 20. Januar 2011; abgerufen am 30. Januar 2011.
- Fampyra: EPAR – Summary for the public. Europäische Arzneimittelagentur (EMA); abgerufen am 1. Dezember 2011.
- „Neue Arzneimittel“ Fampyra® Zur Verbesserung der Gehfähigkeit von erwachsenen Patienten mit Multipler Sklerose (MS) mit Gehbehinderung (EDSS 4–7). (PDF; 318 kB) Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); abgerufen am 1. Dezember 2011.
- Biogen Idec erhält bedingte Marktzulassung für FAMPYRA® in der Europäischen Union zur Verbesserung der Gehfähigkeit erwachsener Multiple-Sklerose-Patienten. Businesswire, 25. Juli 2011; abgerufen am 26. Juli 2011.
- Ralf Behrens: Fampyra® (Fampridin): Kaliumkanalblocker fördert Gehleistung bei MS-Patienten. In: Ars Medici. Nr. 01/02, 24. Januar 2020, Kap. Neue Wirkstoffe und Fixkombinationen, S. 35–36.
- Michael Linnebank: Fampridin zur Verbesserung der Gehfähigkeit. In: Forte. Nr. 4, November 2012, ZDB-ID 2412672-X (multiplesklerose.ch [PDF]).
- © Copyright Swissmedic 2019: Fampyra®, Retardtabletten (Fampridinum). Abgerufen am 11. Dezember 2019.
- Bundesvereinigung Deutscher Apothekerverbände: Neues Rezeptur-Formularium. Rezepturhinweise: 3,4-Diaminopyridin und 4-Aminopyridin. Govi, Eschborn 2009.
- Wolfgang Löscher, Fritz Rupert Ungemach, Reinhard Kroker: Pharmakotherapie bei Haus- und Nutztieren. Thieme, Stuttgart 2006, ISBN 3-8304-4160-6, S. 101.
- EXTOXNET: Pesticide Information Profile.