Myelin-Oligodendrozyten-Glykoprotein
Das Myelin-Oligodendrozyten-Glykoprotein (MOG) ist ein Glykoprotein, dem eine wichtige Rolle im Prozess der Myelinisierung von Nerven im ZNS zugesprochen wird (siehe auch Axon und Erregungsleitung). Codiert wird das Protein beim Menschen durch das MOG-Gen.[1][2][3] Untersuchungen der molekularen Grundlagen der Myelinbildung sind für verschiedene neurologische Erkrankungen von Bedeutung, bei denen es zu einem Verlust der schützenden Myelinschicht kommt, wie bei der Multiplen Sklerose.
| Myelin-Oligodendrozyten-Glykoprotein | ||
|---|---|---|
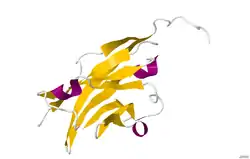
| ||
| Röntgenkristallstrukturanalyse von Myelin-Oligodendrozyten-Glykoprotein einer Ratte nach PDB 1PKO | ||
|
Vorhandene Strukturdaten: 1Q70 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 12,1 – 33,5 Kilodalton / 108 – 295 Aminosäuren (je nach Isoform) | |
| Isoformen | 13 | |
| Bezeichner | ||
| Gen-Namen | MOG BTN6; BTNL11; MOGIG2; NRCLP7 | |
| Externe IDs | ||
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4340 | 17441 |
| Ensembl | ENSG00000137345 | ENSMUSG00000076439 |
| UniProt | Q16653 | Q61885 |
| Refseq (mRNA) | NM_001008228 | NM_010814 |
| Refseq (Protein) | NP_001008229 | NP_034944 |
| Genlocus | Chr 6: 29.66 – 29.67 Mb | Chr 17: 37.01 – 37.02 Mb |
| PubMed-Suche | 4340 | 17441 |
Es wird vermutet, dass MOG eine Rolle als Adhäsionsmolekül spielt und dadurch der Myelinscheide strukturelle Integrität vermittelt. Es entsteht erst spät auf dem Oligodendrozyten.[4]
Molekulare Funktion
Die primäre molekulare Rolle von MOG ist bisher unbekannt, jedoch ist die wahrscheinlichste die einer Komplettierung und/oder Aufrechterhaltung der Myelinscheide.[3] Im Detail vermutet man, dass MOG als „Adhesionsmolekül“ auf der Myelinhülle eine Rolle spielt und der Hülle strukturelle Integrität vermittelt.[4]”
Die cDNA-codierende Region von MOG im Menschen ist zu einem hohen Grad homolog[5] zu Ratten, Mäusen und Rindern und daher hochkonserviert. Dies unterstreicht die Vermutung, dass MOG eine “biologisch wichtige Rolle” im Organismus spielt.[3]
Physiologie
Das MOG Gen, welches sich auf Chromosom 6p21.3-p22 befindet,[6] wurde 1995 sequenziert.[2]
Es handelt sich um ein Transmembranprotein, welches auf der Oberfläche von Oligodendrocyten und auf der äußersten Schicht der Myelinhülle exprimiert wird. „MOG ist ein in geringer Quantität vorkommendes Typ 1 Transmembranprotein,[7] welches sich nur im ZNS findet.“ „Eine einzelne Ig-Domäne erstreckt sich in den extrazellulären Raum“[7] und erlaubt den einfachen Zugriff von Autoantikörpern.[3][7] Das primäre nukleäre Transkript von MOG umfasst … 15,561 Nukleotide[3] „und besitzt im Menschen acht Exons, welche durch sieben Introns voneinander getrennt sind.“[3] Die Introns beinhalten „zahlreiche repetitive DNA-“[3] Sequenzen, unter welchen sich eine „14 Alu-Sequenz innerhalb von 3 Introns befindet.“[3] Die Länge der Introns variiert zwischen 242 und 6484 Basenpaaren.
Struktur
Aufgrund alternativen Splicings der humanen mRNA entstehen aus dem MOG-Gen mindestens neun Isoformen.[8]
Die Kristallstruktur des Myelin Oligodendrozyten Glykoproteins wurde anhand des Proteins aus der Wanderratte mittels Röntgenkristallstrukturanalyse mit einer Auflösung von 1,45 Angstrom ermittelt. Das Protein umfasst 139 Aminosäuren und gehört zur Immunglobulin-Superfamilie.[9]
Die DSSP-Sekundärstruktur (Define Secondary Structure of Proteins) des Proteins besteht zu 6 % aus Helices und zu 43 % aus β-Faltblatt: Drei kurzen helikalen Segmenten folgen zehn β-Faltblätter.[10] Die β-Faltblatt-Sequenzen liegen innerhalb zweier antiparalleler β-Faltblätter, welche eine Immunoglobulin-ähnliche β-Sandwich-Faltung bilden.[11] Mehrere Eigenschaften der Proteinstruktur des MOG deuten auf eine Rolle als „Adhesin zur Komplettierung und/oder Verdichtung der Myelinhülle.“ Beginnend in der Nähe des N-Terminus befindet sich ein Streifen elektronegativer Ladung, welcher sich über die halbe Länge des Moleküls hinzieht. In Lösung zeigt MOG die Tendenz zur Dimerisierung und der „shape complementary index“ ist hoch an der Dimerisierungs-Verbindungsstelle, was die Existenz eines „biologisch relevanten MOG-Dimers“ vermuten lässt.[12]
Synthese
MOG wird erst zu einem „relativ späten Zeitpunkt“ auf den Oligodendrozyten und der Myleinhülle gebildet.[4]
Erkrankungen
Das Interesse für MOG liegt vor allem in seiner Rolle im Zusammenhang mit demyelinisierenden Erkrankungen wie z. B. Adrenoleukodystrophie, Kindheits-Ataxie mit zentraler Mindermyelinisierung, Multipler Sklerose (MS) und durch Röteln induzierter geistiger Behinderung.[13]
MOG ist ein Target-Antigen, welches zu autoimmuner Demyelinisierung führt. Die meisten wissenschaftlichen Laboruntersuchungen zu MOG stehen im Zusammenhang mit MS. Diverse Studien zeigten einen Zusammenhang zwischen MOG-Antikörpern und der Pathogenese in MS.[4][14] Tiermodelle der MS EAE, zeigten (in verschiedenen Tierlinien), dass diese MOG-spezifische EAE der MS ähnelt oder sie fast gänzlich „kopiert“.[4] was durch die demyelinisierende Kapazität und die Topographie der Läsionen ersichtlich ist. Die Tiermodelle konnten aufzeigen, dass für die Demyelinisierung MOG-Antikörper verantwortlich sind. Diese Modelle wurden ausgiebig untersucht und MOG sind bisher die einzigen Antikörper, welche die Fähigkeit besitzen, die Demyelinisierung auszulösen.[4]
Multiple Sklerose
Die genauen pathogenen Prozesse der MS sind bisher unbekannt, jedoch existieren, basierend auf dem aktuellen Wissenstand, diverse Theorien: Die breiteste Anerkennung findet momentan die Theorie der Antikörpervermittelten Demyelinisierung, einer Attacke des Immunsystems auf den Körper, im Speziellen auf das Zentralnervensystem, welches schlussendlich zur Demyelinisierung führt. Dieser Theorie zufolge werden gezielt bestimmte Antigene des Körpers attackiert. Im Detail werden T- und B-Zellen als die zur Pathogenese führenden Zellen in der antikörpervermittelten Demyelinisierung der MS verantwortlich gemacht.[15] Unter den diversen möglicherweise in die Pathogenese involvierten Kandidaten liegt der wissenschaftliche Fokus bei den nachfolgend erwähnenten Studien meistens auf zwei Antigenen: Das eine ist das basische Myelinprotein (MBP), bei welchem in frühen Stadien der MS schon diverse gegen MBP gerichtete Antikörper nachgewiesen werden konnten.[14] Beim anderen handelt sich um das Myelin-Oligodendrozyten-Glykoprotein (MOG). Beide wurden als „Ziele der Immunantwort“ identifiziert.[15] Im Zusammenhang mit der „antikörpervermittelnden Demyelinisierungstheorie“ könnten diese Antikörper, welche während der Immunantwort entstehen, eine wichtige Rolle in der Entstehung von Multipler Sklerose spielen.[15]
Eine Studie[14] fand eine Korrelation zwischen MS-Rückfällen und anti-MOG und Anti-MBP-Antikörpern im Blutserum von Patienten mit einem „klinisch isolierten Syndrom“; diese Rückfälle führten bei genannten Patienten letztlich zur endgültigen klinischen Diagnose von MS. Für beide Antikörper seronegative Patienten erlitten nur bei 23 % aller Fälle nach 45,1 ± 13,7 Monaten einen Rückfall, wohingegen 83 % der Patienten, welche alleine für Anti-MOG-Antikörper positiv getestet worden waren, innerhalb 14,6 ± 9,6 Monaten einen Rückfall hatten. 21 von 22 Patienten, welche beide Antikörper im Blut aufwiesen hatten Rückfälle innerhalb eines Zeitraums von 7,5 ± 4,4 Monaten.[14]
Diese Resultate legen den Schluss nahe, dass das Vorkommen eines klinisch isolierten Syndroms durchwegs noch nicht zwingend zur „klinisch definitiven“ MS führen muss. Diese Resultate decken sich mit früheren Daten zur Krankheit. Zum Beispiel haben 30–40 Prozent der MS-Fälle einen relativ harmlosen Krankheitsverlauf, was mit den 38 Prozent an Patienten in dieser Studie, welche negativ für beide Antikörper waren, korreliert. Im frühen Verlauf der Krankheit scheint daher der „Antikörper-Status“ eine Möglichkeit zu bieten, Patienten mit einem voraussichtlich eher milden Krankheitsverlauf zu identifizieren.[14] Der Artikel legt außerdem Wert auf die Feststellung, dass diese Resultate nicht beweisen, dass die Antikörper zur Demyelinisierung führen. Vielmehr bieten sie einen nützlichen diagnostischen Indikator für den zukünftigen Krankheitsverlauf. Eine mögliche praktische Anwendung der Studie wäre eine billigere und einfachere Alternative zur momentan gängigen „Magnetic-Resonance-Imaging“-Strategie zur Bestimmung des Rückfallrisikos nach einem „klinisch isolierten Syndrom“.
Eine vergleichbare Studie[16] untersuchte die Veränderung des Risikos (in Abhängigkeit vom Antikörperstatus) nach einem vorangegangenen klinisch isolierten Syndrom eine klinisch definitive MS zu entwickeln. Untersucht wurden die genannten Anti-Myelin-Antikörper als möglicher Prädiktor für ein verändertes Risiko. Während generell bei 90 Prozent der Patienten mit einem klinisch isolierten Syndrom innerhalb von Monaten bis Jahren eine klinisch definitive MS diagnostiziert wurde, zeigten die Resultate der Studie auch, dass Patienten mit einem negativen Test für die Antikörper generell eine bessere Prognose im Bezug zum Zeitpunkt des Rückfalls aufwiesen (d. h. der Rückfall trat generell später auf). Patienten, welche positiv auf die Antikörper getestet wurden, konnten im Gegenzug aufgrund des Tests von einem möglichst frühen Therapiebeginn profitieren.[16] Innerhalb eines Zeitraums von 12 Monaten wurden 30 Patienten positive für die Antikörper getestet. 22 dieser Patienten entwickelten eine klinisch definitive MS. Von den Patienten, welche negativ für den Antikörper waren, entwickelte hingegen keiner innerhalb des genannten Zeitraums eine klinisch definitive MS.
Trotz dieser Ergebnisse kam eine andere Arbeit zu dem Schluss, die genannten Studien könnten nicht schlüssig aufzeigen, dass MOG tatsächlich einer der Hauptbeitragenden des Krankheitsverlaufs von MS darstellt.[17] MOG wurde die Fähigkeit nachgewiesen, in vitro und in experimentellen Tiermodellen zur Demyelinisierung zu führen. Ebenso ist es in Nervengewebsläsionen wie auch in Patienten mit diagnostizierter MS nachzuweisen. Dennoch ist die Signifikanz dieser Entdeckungen noch nicht eindeutig schlüssig. Zwei andere Studien konnten die Resultate aus den genannten Studien nur in einer Subgruppen-Analysen bestätigen und drei weitere Studien zum Thema kamen zu negativen Resultaten. Die genannte Arbeit bietet eine andere Interpretation der gefundenen Resultate: Sie besagt, dass die Anti-MOG-Antikörper-Korrelation zur Entwicklung von MS möglicherweise zumindest teilweise die Kreuzreaktivität zwischen MOG und dem nukleären Antigen des Epstein-Barr-Virus (EBNA) widerspiegelt.[4][17] Die Assoziation MOGs mit MS entstand durch dessen Syntheseort, welcher sich ausschließlich im Zentralnervensystem befindet. Der wahre Zusammenhang zwischen MS und MOG ist dennoch nicht ganz aufgeklärt, unter anderem aufgrund dieses fehlenden Beweises zum Zusammenhangs zwischen biologisch aktiven Anti-MOG-Antikörpern[4] und der Demyelinisierung, die schlussendlich zu MS führt. Zu guter Letzt, während Anti-MOG-Antikörper zur Bestimmung des Ausmaßes der Gewebeschädigung während der MS gemessen werden können, könnten sie, abgesehen von biologisch aktiven Antikörpern, auch einfach ein Begleitphänomen der ZNS-Gewebedegeneration darstellen.[4]
Weblinks
Einzelnachweise
- Pham-Dinh D, Della Gaspera B, Kerlero de Rosbo N, Dautigny A: Structure of the human myelin/oligodendrocyte glycoprotein gene and multiple alternative spliced isoforms. In: Genomics. 29, Nr. 2, September 1995, S. 345–52. doi:10.1006/geno.1995.9995. PMID 8666381.
- Pham-Dinh D, Jones EP, Pitiot G, Della Gaspera B, Daubas P, Mallet J, Le Paslier D, Fischer Lindahl K, Dautigny A: Physical mapping of the human and mouse MOG gene at the distal end of the MHC class Ib region. In: Immunogenetics. 42, Nr. 5, 1995, S. 386–91. PMID 7590972.
- Roth MP, Malfroy L, Offer C, Sevin J, Enault G, Borot N, Pontarotti P, Coppin H: The human myelin oligodendrocyte glycoprotein (MOG) gene: complete nucleotide sequence and structural characterization. In: Genomics. 28, Nr. 2, Juli 1995, S. 241–50. doi:10.1006/geno.1995.1137. PMID 8530032.
- Berger, T., Innsbruck Medical University Dept. of Neurology interviewed by S. Gillooly, Nov. 24, 2008.
- Danielle Pham‐Dinh, Bernadette Allinquant, Merle Ruberg, Bruno Della Gaspera, Jean‐Louis Nussbaum, André Dautigny: Characterization and Expression of the cDNA Coding for the Human Myelin/Oligodendrocyte Glycoprotein. In: John Wiley & Sons (Hrsg.): Journal of Neurochemistry. Volume 63, Issue 6, Dezember 1994, S. 2353–2356, doi:10.1046/j.1471-4159.1994.63062353.x (englisch).
- Pham-Dinh D, Mattei MG, Nussbaum JL, Roussel G, Pontarotti P, Roeckel N, Mather IH, Artzt K, Lindahl KF, Dautigny A: Myelin/oligodendrocyte glycoprotein is a member of a subset of the immunoglobulin superfamily encoded within the major histocompatibility complex. In: Proc. Natl. Acad. Sci. U.S.A.. 90, Nr. 17, September 1993, S. 7990–4. doi:10.1073/pnas.90.17.7990. PMID 8367453.
- Berger T, Reindl M: Multiple sclerosis: disease biomarkers as indicated by pathophysiology. In: J. Neurol. Sci.. 259, Nr. 1-2, August 2007, S. 21–6. doi:10.1016/j.jns.2006.05.070. PMID 17367811.
- Boyle LH, Traherne JA, Plotnek G, Ward R, Trowsdale J: Splice variation in the cytoplasmic domains of myelin oligodendrocyte glycoprotein affects its cellular localisation and transport. In: J. Neurochem.. 102, Nr. 6, September 2007, S. 1853–1862. doi:10.1111/j.1471-4159.2007.04687.x. PMID 17573820.
- Breithaupt C, Schubart A, Zander H, et al.: Structural insights into the antigenicity of myelin oligodendrocyte glycoprotein. In: Proc. Natl. Acad. Sci. U.S.A.. 100, Nr. 16, August 2003, S. 9446–51. doi:10.1073/pnas.1133443100. PMID 12874380.
- Kabsch W, Sander C: Dictionary of protein secondary structure: pattern recognition of hydrogen-bonded and geometrical features. In: Biopolymers. 22, Nr. 12, Dezember 1983, S. 2577–637. doi:10.1002/bip.360221211. PMID 6667333.
- Murzin AG, Brenner SE, Hubbard T, Chothia C: SCOP: a structural classification of proteins database for the investigation of sequences and structures. In: J. Mol. Biol.. 247, Nr. 4, April 1995, S. 536–40. doi:10.1016/S0022-2836(05)80134-2. PMID 7723011.
- Clements CS, Reid HH, Beddoe T, et al.: The crystal structure of myelin oligodendrocyte glycoprotein, a key autoantigen in multiple sclerosis. In: Proc. Natl. Acad. Sci. U.S.A.. 100, Nr. 19, September 2003, S. 11059–64. doi:10.1073/pnas.1833158100. PMID 12960396.
- Cong H, Jiang Y, Tien P: Identification of the myelin oligodendrocyte glycoprotein as a cellular receptor for rubella virus. In: J. Virol.. 85, Nr. 21, November 2011, S. 11038–47. doi:10.1128/JVI.05398-11. PMID 21880773.
- Berger T, Rubner P, Schautzer F, Egg R, Ulmer H, Mayringer I, Dilitz E, Deisenhammer F, Reindl M: Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. In: N. Engl. J. Med.. 349, Nr. 2, Juli 2003, S. 139–45. doi:10.1056/NEJMoa022328. PMID 12853586.
- Tomassini V, De Giglio L, Reindl M, Russo P, Pestalozza I, Pantano P, Berger T, Pozzilli C: Anti-myelin antibodies predict the clinical outcome after a first episode suggestive of MS. In: Mult. Scler.. 13, Nr. 9, November 2007, S. 1086–1094. doi:10.1177/1352458507077622. PMID 17468447.
- Greeve I, Sellner J, Lauterburg T, Walker U, Rösler KM, Mattle HP: Anti-myelin antibodies in clinically isolated syndrome indicate the risk of multiple sclerosis in a Swiss cohort. In: Acta Neurol. Scand.. 116, Nr. 4, Oktober 2007, S. 207–10. doi:10.1111/j.1600-0404.2007.00872.x. PMID 17824895.
- Wang H, Munger KL, Reindl M, O'Reilly EJ, Levin LI, Berger T, Ascherio A: Myelin oligodendrocyte glycoprotein antibodies and multiple sclerosis in healthy young adults. In: Neurology. 71, Nr. 15, Oktober 2008, S. 1142–6. doi:10.1212/01.wnl.0000316195.52001.e1. PMID 18753473.