Glatirameracetat
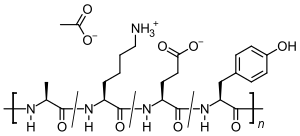
Glatirameracetat (GA) ist das Essigsäuresalz (Acetat) eines synthetisch hergestellten Polypeptids, das die vier natürlich vorkommenden Aminosäuren L-Alanin, L-Glutaminsäure, L-Lysin und L-Tyrosin in zufälliger Reihenfolge enthält. Die immunmodulatorisch wirksame Substanz wird als Arzneistoff zur Behandlung der schubförmigen Multiplen Sklerose (MS) eingesetzt. Der genaue Wirkmechanismus ist unbekannt. Da die Zusammensetzung von Glatiramer den Bestandteilen der Isolierung von Nervenzellen ähnelt, soll es die bei MS auftretenden Entzündungsreaktionen im Zentralnervensystem vermindern.
| Strukturformel | |||
|---|---|---|---|
 | |||
| Allgemeines | |||
| Name | Glatiramer | ||
| Andere Namen |
| ||
| CAS-Nummer |
| ||
| Monomere/Teilstrukturen | L-Alanin, L-Glutaminsäure, L-Lysin, L-Tyrosin | ||
| Molmassenabschätzung |
5.000 bis 9.000 Dalton | ||
| PubChem | 3081884 | ||
| Art des Polymers | |||
| ATC-Code |
L03AX13 | ||
| DrugBank | DB05259 | ||
| Arzneistoffangaben | |||
| Wirkstoffklasse | |||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Als Copaxone wurde eine Glatirameracetat-Injektionslösung erstmals 1996 in den USA von Teva in den Handel gebracht. Die Zulassung in der EU erfolgte 2001.
Klinische Angaben
Zugelassene Anwendungsgebiete
Glatirameracetat vermindert die Zahl der Schübe bei gehfähigen Patienten mit schubförmiger Multipler Sklerose. Es verhindert jedoch nicht das Fortschreiten einer Behinderung bei Patienten mit MS. Es ist ebenfalls nicht nachgewiesen, dass eine Behandlung mit Glatirameracetat die Dauer oder die Schwere eines Schubes reduziert.
In der EU ist Glatirameracetat zur Behandlung der schubförmigen Multiplen Sklerose zugelassen.[2]
- Reduktion der Schubfrequenz bei ohne Hilfe gehfähigen Patienten mit schubförmig remittierender Multipler Sklerose (MS). In klinischen Studien war dies gekennzeichnet durch mindestens zwei Schübe mit neurologischen Funktionsstörungen während der letzten zwei Jahre.
- Behandlung von Patienten mit einer klar definierten ersten klinischen Episode, die ein hohes Risiko haben, eine klinisch gesicherte Multiple Sklerose zu entwickeln. Diese zusätzliche Indikation – Behandlung der noch nicht gesicherten MS – wurde 2009 zugelassen.
Es besteht keine Zulassung für die primär oder sekundär fortschreitenden MS-Formen.
Die in begrenztem Umfang vorhandenen veröffentlichten Daten weisen darauf hin, dass das Sicherheitsprofil bei Jugendlichen von 12 bis 18 Jahren, die täglich 20 mg Glatirameracetat subkutan erhalten, mit dem von Erwachsenen vergleichbar ist.[2]
Art und Dauer der Anwendung
Glatirameracetat wird täglich oder dreimal wöchentlich, je nach Wirkstoffgehalt der Fertigspritzen subkutan, das heißt in die Unterhaut (Subcutis), injiziert. Die Behandlung der MS erfordert eine langfristige Anwendung.
Unerwünschte Wirkungen
Am häufigsten kommt es zu lokalen Hautreaktionen wie Rötung, Brennen, Juckreiz oder Verhärtung des entsprechenden Bereichs der Subkutis. Diese können durch Kühlung der Einstichstelle vor und nach der Injektion gemildert werden.
Selten kann aus ungeklärter Ursache eine Nebenwirkung auftreten, die als SPIR (Sofortige Postinjektionsreaktion) oder „Flush“ bezeichnet wird. Unmittelbar nach der Injektion kommt es dabei für kurze Zeit (ca. 5 bis 15 Minuten) zu Atemnot, Beklemmungen, Angstgefühlen, Schweißausbrüchen, Herzrasen sowie anschließend zu Schüttelfrost und Kopfschmerzen. Die Symptome klingen über den Zeitraum von zwölf Stunden nach und nach ab.
Anfänge
Im Jahr 1977 wurden am Weizmann-Institut erste offene Studien mit dem Wirkstoff am Menschen durchgeführt. Zunächst an vier Patienten mit weit fortgeschrittener Multipler Sklerose, gefolgt von vier Patienten mit einer schubförmig remittierenden MS und zwölf, die an einer chronisch-progredienten Erkrankung litten. Die Ergebnisse waren ermutigend genug, um eine randomisierte kontrollierte Studie in Angriff zu nehmen.[3]
Die Planung dieser Pilotstudie übernahm Murray B. Bornstein (1917–1995), von 1966 bis zu seiner Emeritierung 1988 Fakultätsmitglied des Albert Einstein College of Medicine in New York City. Der primäre Endpunkt der Studie war zu bestimmen, in welchem Ausmaß die Patienten schubfrei bleiben würden. Sekundäre Endpunkte waren die Frequenz der Exazerbationen und das Ausmaß des Behinderungsgrades nach Ablauf der Studie. 50 Patienten mit Schubförmig-remittierender MS wurden randomisiert, abgeschlossen werden konnte die Studie bei 48 Teilnehmern. Nachdem noch zu wenig Informationen über die Stabilität des Cop-1 zur Verfügung standen, erhielten die Patienten das Präparat in gefrorenem Zustand, ließen die Tagesration jeweils auftauen und injizierten sich diese selbst (nachdem sie entsprechend geschult worden waren) einmal täglich für zwei Jahre. Unter diesen Voraussetzungen erhielten 23 Patienten ein Placebo (Kochsalzlösung) und 25 Patienten Cop-1. Die Ergebnisse wurden 1987 im NEJM veröffentlicht.[4] In der Placebogruppe kam es zu 62 Exazerbationen, in der Verumgruppe zu 16. Während sich der Behinderungsgrad in der Placebogruppe um 1,2 Einheiten verschlechterte, verbesserte sich der Behinderungsgrad in der Verumgruppe um 0,5 Einheiten.
1996 führte der United States Adopted Name Council in Chicago die Bezeichnung Glatiramer ein, wobei die Anfangsbuchstaben der vier beteiligten Aminosäuren und die Endung „-mer“ (für Polymer stehend) zur Namensgebung für den internationalen Freinamen herangezogen wurden, um damit den Richtlinien der Organisation für einfache und verständliche Bezeichnungen zu entsprechen.
Klinische Wirksamkeit bei schubförmig-remittierender MS
In der Zulassungsstudie mit 251 Patienten über einen Behandlungszeitraum von zwei Jahren konnte eine Reduktion der Schubrate von ca. 30 % gegenüber Placebo nachgewiesen werden.
Eine Langzeitstudie, die aus der Zulassungsstudie hervorgegangen ist, hat gezeigt, dass die Schubrate über einen längeren Beobachtungszeitraum hinweg weiter kontinuierlich sinkt. Die im Moment aktuellen 15-Jahres-Daten der offen geführten prospektiven Untersuchung schreiben diese Entwicklung fort.[5][6] Dabei konnte die Schubrate von jährlich rund 1,2 Schüben vor Therapiebeginn um mehr als 80 Prozent auf circa 0,2 Schübe pro Jahr bei denjenigen Patienten reduziert werden, die über 15 Jahre GA erhalten hatten. Gleichzeitig wirkte sich die Therapie positiv auf die neurologische Behinderung aus: 57 Prozent der Patienten, die kontinuierlich mit GA behandelt worden waren, wiesen nach 15 Jahren einen stabilen oder verbesserten Wert auf der EDS-Skala auf. Diese Skala informiert über den Grad der Behinderung eines MS-Patienten. Mehr als 80 Prozent blieben unter einem EDS-Wert von 6, konnten also mindestens noch 100 Meter ohne Gehhilfe selbstständig gehen. Bei denjenigen Patienten, die die Behandlung vorzeitig abgebrochen hatten und 10 Jahre nach Therapiebeginn untersucht wurden, war in lediglich 28 Prozent der Fälle der Grad der Behinderung stabil geblieben oder hatte sich verbessert. Es ist anzumerken, dass die Teilnehmeranzahl im Nachbeobachtungszeitraum von ursprünglich 232 Personen, die mindestens einmal Glatirameracetat erhalten hatten, führten lediglich 100 Patienten die Behandlung nach fünfzehn Jahren noch fort. Von den 124 ausgestiegenen Patienten stellten sich 50 für die Nachuntersuchung der Studie nach 10 Jahren in der behandelnden Klinik wieder vor. Es ist anzunehmen, dass hauptsächlich die Personen die Studie verlassen haben, bei denen GA weniger gut gewirkt hat, damit sollte zumindest ein Teil der deutlich gesunkenen Schubrate zusammenhängen. Andererseits können auch Personen eine weitere Studienteilnahme verweigern, deren Beschwerdefreiheit es ihnen ermöglicht, ihre Diagnose zu verdrängen.
Die Ergebnisse einer Metaanalyse aus drei placebokontrollierten Doppelblindstudien bestätigen den positiven Effekt von GA auf die Schubrate.[7] Im Rahmen der klinischen Untersuchungen konnte bei denjenigen der insgesamt 540 Studienteilnehmer, die mit dem Präparat behandelt wurden, eine Verringerung der jährlichen Schubrate um 28 Prozent festgestellt werden im Vergleich zu denjenigen, die lediglich ein Scheinmedikament erhielten. Zudem wurde die Zeit bis zum ersten Schub durch die Behandlung mit GA verlängert (322 Tage gegenüber 219 Tage unter Placebo). Auch das Risiko, dass der Grad der Behinderung deutlich ansteigt, war unter GA geringer, wobei die Aussagekraft der Analyse aufgrund der relativ kurzen Dauer der untersuchten Studien (24, 35 bzw. 9 Monate) in diesem Punkt eingeschränkt ist.
In einer offen geführten Studie wurde der Therapieerfolg von GA und standardmäßig eingesetzten Beta-Interferonen bei Patienten mit schubförmiger MS rückwirkend miteinander verglichen.[8] Dazu wurden Daten von 308 Patienten ausgewertet, die aus einer Datenbank stammten, in der der zweijährige Behandlungsverlauf dokumentiert ist: Nach sechs Monaten Behandlung waren die Interferone und GA vergleichbar in ihrer Wirksamkeit, was die Verringerung der Schubzahl betrifft. Nach 12 und 24 Monaten bestanden zwischen den Interferon-Präparaten keine Unterschiede. Durch eine Behandlung mit GA konnte in dieser Zeitspanne die Anzahl der Schübe jedoch deutlich stärker reduziert werden als unter jedem der untersuchten Interferone. Darüber hinaus war die Abbruchrate unter GA niedriger. Zu dieser Untersuchung ist anzumerken, dass die Aussagefähigkeit der Ergebnisse – bedingt durch die Art des Studiendesigns – eingeschränkt ist.
In drei weiteren aktuellen Studien – REGARD, BEYOND und BECOME – wurden unterschiedliche Beta-Interferon-Präparate sowie GA miteinander verglichen. Im Verlauf der randomisierten Untersuchungen, in die insgesamt über 3000 Patienten mit schubförmig verlaufender MS involviert waren, konnte bei den Interferonen sowie bei GA eine ähnlich gute Wirksamkeit bezüglich der Zeit bis zum ersten Schub, der Schubraten sowie der Zahl aktiver Läsionen im ZNS festgestellt werden.
Klinische Wirksamkeit bei primär progressiver MS
Eine aktuelle, kontrollierte klinische Studie untersuchte die Wirksamkeit von GA auf die primär progressive MS, bei der keine Schübe auftreten, sondern die Symptome von Anfang an chronisch fortschreiten. Im Verlauf der Untersuchung ergab sich keine signifikante Wirksamkeit der Therapie auf die Progressionsrate der gesamten Studienpopulation. Allerdings war die Progressionsrate insgesamt geringer als erwartet, was die Aussagekraft der Studie beeinträchtigte. Die Ergebnisse einer retrospektiven Analyse zeigten demgegenüber einen deutlichen Behandlungseffekt auf die männliche Subpopulation der Studie, bei der die Progressionsrate in der ursprünglich erwarteten Höhe verlief.[9]
Neuroprotektive Wirkung
In einer MRT-basierenden Studie konnte auch die neuroprotektive Wirkung von GA gezeigt werden.[10] Die Anzahl der Läsionen, die von vernarbten Entzündungsherden zu irreversiblen axonalen Schäden – sog. „Black Holes“ – übergehen, konnte unter der Gabe von GA halbiert werden. Die schützende Wirkung von GA tritt allerdings erst nach einer Behandlungsdauer von etwa sechs Monaten ein.
Dass GA den Verlust an Nervengewebe hemmt, geht auch aus den Ergebnissen einer Studie von Omar Khan hervor.[11][12] Der behandelte 18 Patienten mit schubförmiger MS vom Beginn der Krankheit an sechs Jahre lang durchgehend mit GA. Weitere Patienten blieben zunächst unbehandelt. Regelmäßige Messungen des neuralen Markers N-Acetylaspartat (NAA) mittels Magnetresonanzspektroskopie (MRS) zeigten, dass bei den behandelten Patienten das Verhältnis von NAA und Kreatin signifikant zunahm. Dies wiederum lässt auf eine Erholung der Axonfunktion und einen Schutz vor axonaler Schädigung schließen. Bei den unbehandelten Patienten nahm das NAA/Kreatin-Verhältnis hingegen deutlich ab, das heißt, bei diesen Patienten wurde ein erheblicher Axonverlust festgestellt. Dies besserte sich nach Aufnahme der Therapie. Viele Patienten entwickeln Antikörper gegen Glatirameracetat; ihre klinische Bedeutung ist jedoch unbekannt.[13]
Wirkungsmechanismus
Wie Glatirameracetat in der Lage ist, den Verlauf der MS günstig zu beeinflussen, ist nicht sicher geklärt; die folgenden möglichen Wirkmechanismen werden aktuell diskutiert:
- Der chemische Aufbau von GA ist dem des basischen Myelinprotein (MBP) – insbesondere des Sequenzabschnittes 82 bis 100 –, einem Hauptbestandteil der Myelinschicht, sehr ähnlich. Durch zelluläre Fragmentierung in einzelne Epitope entstehen aus GA Peptide, die ebenfalls eine hohe Affinität zum MHC-Klasse-I- und MHC-Klasse-II-Komplex auf dendritischen Zellen haben. Im Gegensatz zu MBP sind es jedoch gegenüber dem zum MHC komplementären T-Zell-Rezeptor keine Agonisten, sondern Antagonisten.[14]
- Darüber hinaus bewirkt GA eine Verschiebung des Verhältnisses von TH1- zu TH2-Immunzellen (T-Helferzellen). Die aktivierten TH2-Zellen passieren die Blut-Hirn-Schranke und setzen im ZNS vermehrt antientzündlich wirkende Zytokine (Interleukin-4, IL-6 und Interleukin-10) frei. Gleichzeitig wird die Produktion entzündungsfördernder Zytokine wie IL-12 vermindert. Dies führt zur Unterdrückung der pathologischen Entzündungsprozesse in der MS-Läsion vor Ort. Zusätzlich wird die Bildung neurotropher Faktoren, z. B. des Brain Derived Neurotrophic Factor (BDNF), gefördert mit möglicherweise neuroprotektivem Effekt – der Axonverlust kann dadurch gehemmt und die zerstörte Myelinschicht wieder aufgebaut werden.[15][16]
- GA fördert die Entstehung von regulatorisch wirkenden CD8-Immunzellen, die bei unbehandelten MS-Patienten üblicherweise deutlich vermindert sind.
- GA fördert durch eine Aktivierung des Transkriptionsfaktors FOXP3 (forkhead box protein 3) die Umwandlung von konventionellen CD4+CD25-T-Zellen in CD4+CD25+ regulatorische T-Zellen.[17]
Eigenschaften
Glatiramer ist ein heterogenes Gemisch synthetischer Polypeptide. Diese bestehen aus vier natürlichen Aminosäuren Glutaminsäure, Lysin, Alanin und Tyrosin („GLAT“), welche in einem festen molaren Verhältnis von 0,14 zu 0,34 zu 0,43 zu 0,09 vorliegen. Die mittlere Molare Masse des Essigsäuresalzes Glatirameracetat (GA) liegt bei 5.000 bis 9.000 Dalton.[18]
Strukturformeln der im Peptid enthaltenen Aminosäuren und des Salzbildners Essigsäure (Acetat):
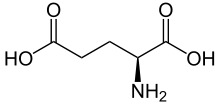 L-Glutaminsäure
L-Glutaminsäure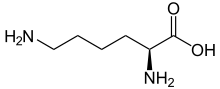 L-Lysin
L-Lysin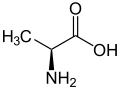 L-Alanin
L-Alanin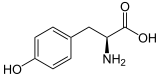 L-Tyrosin
L-Tyrosin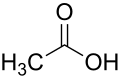
Da Glatirameracetat aus den vier enthaltenen Aminosäuren, die nur in einem bestimmten Verhältnis vorliegen, nach dem Zufallsprinzip polymerisiert wird, muss die Wirksamkeit jeder in den Handel gelangenden Charge zunächst im Tierversuch überprüft werden.[19]
Die Substanz zählt zu den non-biological complex drugs.
Sonstige Informationen
Geschichte
In den 1960er Jahren wurden am Weizmann-Institut in Israel von Michael Sela und Ruth Arnon mehrere Versuchsreihen durchgeführt, die klären sollten, welche minimalen chemischen Voraussetzungen ein Molekül besitzen müsse, um eine Immunreaktion des Organismus auszulösen, also zur Bildung von Antikörpern führen würde. Zusätzlich sollten dabei Aussagen gewonnen werden, wie es zur Spezifität der Immunreaktionen komme. Dazu wurde Gelatine mit kurzen Peptiden unterschiedlicher Zusammensetzung bestückt, wodurch die Immunogenität der Gelatine deutlich erhöht werden konnte, wenn Tyrosin, Tryptophan, Phenylalanin oder – hier in geringerem Ausmaß – Cystein hinzugefügt wurde, während eine kovalente Bindung von Peptiden, die Alanin, Lysin, Glutaminsäure, Serin und Prolin enthielten, nicht der Fall war[20] Später erkannten sie, dass für die immunogenen Eigenschaften alleine die Peptidanteile und nicht die Gelatine verantwortlich waren, und dass derart synthetisch hergestellte Moleküle ab 4000 Dalton potente Antigene darstellen.[3] Anschließend wurde auch ein Polypetid synthetisiert, das dem basischen Myelinprotein (MBP, engl. myelin basic protein) ähneln sollte, um damit eine experimentelle autoimmune Enzephalomyelitis (EAE) bei Versuchstieren auszulösen, also eine Auto-Immunreaktion gegen MBP.
Hergestellt wurden drei Polypeptide, die durch Copolymerisation gebildet und deshalb als Copolymere bezeichnet wurden.
Während durch keines der hergestellten Polypeptide eine EAE provoziert werden konnte, wurde stattdessen beobachtet und 1971 veröffentlicht, dass bei den in diesen Versuchsreihen verwendeten Hausmeerschweinchen eine EAE unterdrückt wurde.[21] Dabei zeigten alle drei Copolymere diesen Schutzeffekt, wenn sie unter Zuhilfenahme von Freund-Adjuvans, einem stark immunstimulierenden und reizenden Adjuvans, intradermal verabreicht wurden. Eine Wirkung bei intravenöser Injektion mit Kochsalzlösung zeigte nur Copolymer-1. Dieses einfachste der drei Copolymere wies auch die geringsten Nebenwirkungen auf.[3] Copolymer-1 bzw. abgekürzt Cop-1, das diesen Arbeitsnamen bis 1996 behielt, sollte für die weitere Entwicklung somit ausschlaggebend sein.
In der Folge konnte nachgewiesen werden, dass dieser Schutzeffekt sich nicht auf einzelne Tierfamilien[22][23] beschränkte und unabhängig von der Art des verwendeten Auslösers für eine EAE bestand.[3]
Wie Stanley Scheindlin angibt,[3] waren die Forscher nun überzeugt, anstatt eines pharmakologischen Arbeitsmittels ein potenzielles Medikament gefunden zu haben. So folgten nun weitere vorklinische Studien zur Sicherheit der Substanz, wobei Labortieren (Mäusen, Ratten, Kaninchen und Beagles) unterschiedliche Dosen für unterschiedlich lange Zeiträume verabreicht wurden.
Die kommerzielle Verwertung der Forschungserfolge und Zulassung unter dem Namen Copaxone erfolgte 1996 in den Vereinigten Staaten und im November 2001 für alle Mitgliedstaaten der Europäischen Union durch die Firmen TEVA und Sanofi-Aventis, sodass es beispielsweise in Österreich ab Januar 2002 erhältlich war. Auch der Name Copaxone nimmt mehrfach auf die Entwicklungsgeschichte der Substanz Bezug: ‚Cop‘ für Copolymer, ‚ax(on)‘ für Nerv(ensystem) und ‚one‘ für (Copolymer-)1.
Handelsnamen und Darreichungsformen
- Copaxone (Teva Pharma)
- Glatopa (Sandoz Inc., USA)[24]
- Glatiramyl (BGP Products GmbH, CH)
Lösung in Fertigspritzen zur subkutanen Injektion
Kosten
Die jährlichen Kosten im Jahr 2011 beliefen sich auf EUR 11.600 (Quelle: Kostenaufstellung der Oberösterreichischen Gebietskrankenkasse OÖGKK)
Weblinks
- Ausführliche Wissenschaftliche Erörterung des Wirkmechanismus von GLT (engl.)
- Stanley Scheindlin: Copolymer 1: An Off-Beat Drug Development Story (PDF). Über die Entwicklungsgeschichte von Copaxone. In: Molecular Interventions, 2014 (engl.)
- Barbara Peruche, Martin Schulz: Glatirameracetat zur Behandlung der Multiplen Sklerose, Pharmazeutische Zeitung, Ausgabe 34/2002.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fachinformation Copaxone, Stand: Februar 2009.
- S. Scheindlin: Copolymer 1: an off-beat drug development story. In: Molecular interventions. Band 4, Nummer 1, Februar 2004, S. 6–9, doi:10.1124/mi.4.1.6. PMID 14993470.
- M. B. Bornstein, A. Miller u. a.: A pilot trial of Cop 1 in exacerbating-remitting multiple sclerosis. In: The New England Journal of Medicine. Band 317, Nummer 7, August 1987, S. 408–414, doi:10.1056/NEJM198708133170703. PMID 3302705.
- C. C. Ford u. a.: A prospective open-label study of glatiramer acetate: over a decade of continuous use in multiple sclerosis. In: Multiple Sclerosis. 12, 2006, S. 309–320.
- C. C. Ford u. a.: Continuous Long-Term Immunomodulatory Therapy in Relapsing Multiple Sclerosis: Results from the 15-Year Analysis of the U.S. Prospective Open-label Study of Glatiramer Acetate. In: Multiple Sclerosis. 14, 2008, S. 41.
- F. M. Boneschi u. a.: Effects of glatiramer acetate on relapse rate and accumulated disability in multiple sclerosis: meta-analysis of three double-blind, randomized, placebo-controlled clinical trials. In: Multiple Sclerosis 9, 2003, S. 349–355.
- J. Haas u. a.: Twenty-four-month comparison of immunomodulatory treatments – a retrospective open label study in 308 RRMS patients treated with beta interferons or glatiramer acetate (Copaxone). In: European Journal of Neurology. 12, 2005, S. 425–431.
- J. S. Wolinsky u. a.: Glatiramer acetate in primary progressive multiple sclerosis: results of a multinational, multicenter, double-blind, placebo-controlled trial. In: Ann Neurol. 61, 2007, S. 14–24.
- M. Filippi u. a.: Glatiramer acetate reduces the proportion of new MS lesions evolving into „black holes“. In: Neurology. 57, 2001, S. 731–733.
- O. Khan u. a.: Axonal metabolic recovery and potential neuroprotective effect of glatiramer acetate in relapsing-remitting multiple sclerosis. In: Mult Scler. 11, 2005, S. 646–651.
- O. Khan u. a.: Long-term evaluation of neuronal metabolism in relapsing-remitting multiple sclerosis: combined results from two cohorts of glatiramer acetate treated patients examined prospectively with serial brain proton magnetic resonance spectroscopy (1H-MRS). In: Abstract presented at the 18th Meeting of the European Neurological Society ENS. 7. bis 11. Juni 2008, in Nizza
- Cohen BA, Oger J, Gagnon A, Giovannoni G. The implications of immunogenicity for protein-based multiple sclerosis therapies. J Neurol Sci. 2008; 275, 7–17, PMID 18822434
- R. Aharoni, D. Teitelbaum u. a.: Copolymer 1 acts against the immunodominant epitope 82-100 of myelin basic protein by T cell receptor antagonism in addition to major histocompatibility complex blocking. In: PNAS. Band 96, Nummer 2, Januar 1999, S. 634–639, PMID 9892685. PMC 15188 (freier Volltext).
- M. Ruggieri, C. Avolio u. a.: Glatiramer acetate in multiple sclerosis: a review. In: CNS Drug Reviews. Band 13, Nummer 2, 2007, S. 178–191, doi:10.1111/j.1527-3458.2007.00010.x. PMID 17627671. (Review).
- C. Farina, M. S. Weber u. a.: Glatiramer acetate in multiple sclerosis: update on potential mechanisms of action. In: The Lancet Neurology. Band 4, Nummer 9, September 2005, S. 567–575, doi:10.1016/S1474-4422(05)70167-8, PMID 16109363.
- J. Hong, N. Li u. a.: Induction of CD4+CD25+ regulatory T cells by copolymer-I through activation of transcription factor Foxp3. In: Proceedings of the National Academy of Sciences of the United States of America. Band 102, Nummer 18, Mai 2005, S. 6449–6454, doi:10.1073/pnas.0502187102. PMID 15851684, PMC 1088385 (freier Volltext).
- Prescribing-Information, copaxone.com (PDF, engl.).
- Glatirameracetat (Copaxone Trockensubstanz; Aventis); Pharmazeutische Zeitung, Ausgabe 51/2001.
- M. Sela, S. Fuchs, R. Arnon: Studies on the chemical basis of the antigenicity of proteins. 5. Synthesis, characterization and immunogenicity of some multichain and linear polypeptides containing tyrosine. In: The Biochemical journal. Band 85, Oktober 1962, S. 223–235, PMID 13992690. PMC 1243934 (freier Volltext).
- D. Teitelbaum, A. Meshorer u. a.: Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. In: European Journal of Immunology. Band 1, Nummer 4, August 1971, S. 242–248, doi:10.1002/eji.1830010406. PMID 5157960.
- D. Teitelbaum, C. Webb u. a.: Suppression by several synthetic polypeptides of experimental allergic encephalomyelitis induced in guinea pigs and rabbits with bovine and human basic encephalitogen. In: European Journal of Immunology. Band 3, Nummer 5, Mai 1973, S. 273–279, doi:10.1002/eji.1830030505. PMID 4128127.
- D. Teitelbaum, C. Webb u. a.: Suppression of experimental allergic encephalomyelitis in Rhesus monkeys by a synthetic basic copolymer. In: Clinical immunology and immunopathology. Band 3, Nummer 2, November 1974, S. 256–262, PMID 4141659.
- ANDA: 090218