Isoelektrische Fokussierung
Als Isoelektrische Fokussierung oder kurz IEF wird eine elektrophoretische Auftrennung von Proteinen in einem Gel (IEF-PAGE), in einer Kapillare oder in einem flüssigen Film[1] aufgrund ihres relativen Gehalts an sauren und basischen Aminosäureresten bezeichnet.
Prinzip
Je nach pH-Wert des umgebenden Mediums tragen die Aminosäuren eines Proteins unterschiedliche, positive oder negative Ladungen (siehe Artikel Ampholyte). Die Summe aller Ladungen eines Proteins ist bei einem bestimmten pH-Wert – seinem isoelektrischen Punkt (pI) – null. Gelangt ein Proteinmolekül im elektrischen Feld an eine Stelle des Mediums mit diesem pH-Wert, verschwindet dort seine elektrophoretische Beweglichkeit, so dass es dort liegen bleibt. Da sich alle Moleküle einer Proteinsorte an derselben Stelle des Mediums sammeln, spricht man von Fokussierung. Die Methode eignet sich besonders für Proteine, da deren Ladung pH-Wert abhängig ist. Ein Nachteil der Methode liegt darin, dass Proteine am isoelektrischen Punkt am wenigsten löslich sind und die Gefahr besteht, dass sie ausfallen.[2]
Durchführung
Bei der IEF-PAGE wird ein Proteingemisch in ein Trägergel eingebracht (meist Polyacrylamid), in dem zuvor ein pH-Gradient etabliert wurde. Die Etablierung dieses Gradienten erfolgt entweder elektrophoretisch mittels im elektrischen Feld frei beweglicher Trägerampholyte oder über immobilisierte (d. h. kovalent mit dem Trägergel verbundene) Ladungsträger.
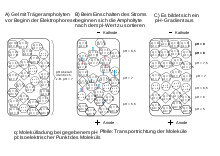
Anschließend wird an das Gel eine elektrische Spannung angelegt. Jedes Protein bewegt sich nun im elektrischen Feld auf Grund seiner Eigenladung so weit, bis der pH-Wert des Trägergels seinem pI entspricht. Ein Protein, welches aus dieser Gelregion wegdiffundiert, erhält durch die Veränderung des pH-Wertes wieder eine Nettoladung und bewegt sich erneut in den Bereich des Geles, dessen pH-Wert seinem pI entspricht. Das elektrische Feld konzentriert ('fokussiert') somit jedes einzelne Protein im Gel im pH-Bereich seines spezifischen pI.
Einsatz
Die Technik der isoelektrischen Fokussierung wird zur (analytischen) Bestimmung des pI von Proteinen sowie zur (präparativen) ladungsabhängigen Fraktionierung von Proteingemischen eingesetzt. Durch die Einführung immobilisierter pH-Gradienten (IPG) durch Immobiline, hat sich die Reproduzierbarkeit einzelner Fokussierungsläufe deutlich verbessert. Immobiline sind schwache Säuren oder Basen die einen definierten pK-Wert haben und sich kovalent mit der Gelmatrix verbinden. Diese Entwicklung war die Voraussetzung für die Optimierung leistungsfähiger Proteinanalyseverfahren wie der 2D-Gelelektrophorese. Die IEF dient hier der elektrophoretischen Proteinauftrennung in der ersten Dimension.[3][4]
Weblinks
- FischDB (Fischdatenbank) - enthält zahlreiche IEF-Analysen
Quellen
- Optimized continuous flow electrophoresis. Weber G, Bocek P.; Electrophoresis; 1996 Dec;17(12):1906-10, PMID 9034773.
- Robert Ebermann, Ibrahim Elmadfa: Lehrbuch Lebensmittelchemie und Ernährung. 2. Auflage. Springer Wien New York, ISBN 978-3-7091-0210-7, S. 60.
- The current state of two-dimensional electrophoresis with immobilized pH gradients.Görg A, Obermaier C, Boguth G, Harder A, Scheibe B, Wildgruber R, Weiss W. Electrophoresis. 2000 Apr;21(6):1037-53, PMID 10786879.
- High-resolution two-dimensional electrophoresis with isoelectric focusing in immobilized pH gradients. Westermeier R, Postel W, Weser J, Görg A.; J Biochem Biophys Methods. 1983 Dec;8(4):321-30, PMID 6663005.