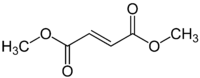
Fumarsäuredimethylester
Fumarsäuredimethylester, auch Dimethylfumarat, ist der Diester der Fumarsäure mit dem Alkohol Methanol. Dieser und andere Ester der Fumarsäure werden als Arzneistoffe zur Behandlung der Multiplen Sklerose[5] und der Psoriasis eingesetzt. Dimethylfumarat werden immunmodulatorische und antioxidative Eigenschaften zugeschrieben.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Fumarsäuredimethylester | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H8O4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines, geruchloses Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 144,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,03 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
193 °C[1] | |||||||||||||||||||||
| Löslichkeit |
wenig in Wasser (1,6 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,4062 (111 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
In einer nicht-medizinischen Verwendung wird Dimethylfumarat als Biozid zur Behandlung von Kleidung, Schuhen und Möbeln gegen Schimmelpilzbefall eingesetzt. Seit dem 1. Mai 2009 gilt in der gesamten EU allerdings ein Verwendungsverbot als Biozid wegen gehäufter Auslösung allergischer Reaktionen.[7][8]
Eigenschaften
Dimethylfumarat ist ein weißes, nahezu geruchloses, kristallines Pulver, das löslich in Aceton, wenig löslich in Ether, schwer löslich in Ethanol und praktisch unlöslich in Wasser (1,6 g·l−1 bei 20 °C) ist. Eine Suspension von 10 g des Esters in einem Liter Wasser zeigt mit einem pH-Wert von 4–6 schwach saure Eigenschaften.[1] In Wasser und im menschlichen Organismus hydrolysiert Fumarsäuredimethylester rasch zum Fumarsäuremonomethylester; die Halbwertszeit beträgt etwa 10 Minuten.[9][10]
Wirkmechanismus
Die immunmodulatorischen und antioxidativen Effekte von Dimethylfumarat scheinen durch Interaktion mit dem intrazellulären Thiol-System vermittelt zu werden. Nachgeschaltet kommt es zur Induktion des entzündungshemmenden Proteins HO-1 und zur Beeinflussung entzündungsfördernder Mediatoren wie Tumornekrosefaktor und Interleukin-8.[11] Zudem scheint Dimethylfumarat vor allem bei Nervenzellen[12] und Herzmuskelzellen[13] antioxidativ zu wirken.
Bei multipler Sklerose (MS) will man mit Dimethylfumarat den Nrf2-Signalweg aktivieren, um immunmodulatorisch und entzündungshemmend zu wirken. Zudem werden antioxidative Gene hochreguliert. Der „Nuclear Factor (Erythroid-Derived 2)-Related Factor 2“ (Nrf2) ist ein Transkriptionsfaktor, der bei Aktivierung zur Transkription von Genen führt, die unter anderem für antiinflammatorisch und antioxidativ wirksame Genprodukte kodieren. Der Nrf2-Signalweg ist das Hauptabwehrsystem in Zellen, womit diese auf Entzündungen und oxidativen Stress reagieren um deren schädliche Effekte abzuwenden. Bei MS scheint der Nrf2-Signalweg eine erhöhte Aktivität zu besitzen, die in aktiven MS-Läsionen auffällt. Jedoch kann das endogene Abwehrsystem oxidativen Stress in MS-Läsionen scheinbar nur ungenügend abwehren. Die Stärkung des Abwehrsystems durch Arzneimittel gilt daher als Ansatz einer MS-Therapie. Dimethylfumarat ist bisher der einzige in klinischen Studien geprüfte Wirkstoff gegen MS, für den man annimmt, dass er den Nrf2-Signalweg aktiviert,[14] obwohl – im Oktober 2014 – noch nicht alle Aspekte der Langzeitanwendung bekannt sind.
Medizinische Verwendung
Multiple Sklerose
Dimethylfumarat hat das Potenzial, einige chronisch-entzündliche immunvermittelte Krankheiten günstig zu beeinflussen. Deutschen Neurologen und Dermatologen fiel 2006 zufällig auf, dass zwei Patienten, die zugleich an Multipler Sklerose (MS) und Psoriasis litten, unter oraler Dimethylfumarat-Therapie für die Psoriasis einen deutlich stabileren Verlauf der MS zeigten.
Zwei klinische Phase-3-Studien (DEFINE- und CONFIRM-Studie) zeigten 2012, dass oral aufgenommenes Dimethylfumarat (als oral BG-12 bezeichnet) die Rückfallrate bei Multipler Sklerose deutlich reduzierte (53 % Schubratenreduktion vs. Placebo; 38 % Reduktion des Risikos einer Behinderungsprogession vs. Placebo)[15] und ebenso wirksam war wie Glatiramer.[16][17]
Dimethylfumarat ist unter dem Handelsnamen Tecfidera, Hersteller Biogen in den USA[18] und in Europa[19] zur oralen Behandlung der schubförmig remittierenden MS zugelassen.[20]
Die Europäische Arzneimittel-Agentur (EMA) resp. das CHMP stufte im November 2013 Tecfidera als „neuartige“ Arznei (new active substance) ein, wodurch das Fumarsäure-Medikament für zehn Jahre vor Nachahmer-Versionen geschützt ist.[21]
Biogen (damals noch Biogen Idec) erhielt 2014 für Tecfidera® den Galenus von Pergamon-Preis (Prix Galien) in der Kategorie Primary Care.[22]
Nebenwirkungen
Weltweit erhalten laut Herstellerangaben etwa 340.000 Patienten Tecfidera® (Stand Juli 2018).[23] Seit dessen Einführung empfiehlt das Krankheitsbezogene Kompetenznetz Multiple Sklerose (KKNMS) im ersten Behandlungsjahr die Bestimmung der Leukozyten- und Lymphozytenzahl im Blut alle sechs bis acht Wochen, um eine progressive multifokale Leukenzephalopathie (PML) zu vermeiden. Werden Leukopenien unter 3000/µl und Lymphopenien unter 500/µl festgestellt, ist die Medikation auszusetzen. Anlass der erneuten dringlichen Empfehlung ist der Tod einer MS-Patientin, die 4,5 Jahre lang Dimethylfumarat erhielt und sich eine 3,5 Jahre lang anhaltende Lymphopenie zuzog, ohne dass Risikofaktoren wie eine Vortherapie mit Natalizumab, Fingolimod, Immunsuppressiva oder eine HIV-Infektion vorlagen.[24][25][26]
Psoriasis
Eine Mischung aus Dimethylfumarat und Monoethylfumarat (Ethylhydrogenfumarat) wird in Deutschland seit den 1990er Jahren zur Behandlung der Psoriasis eingesetzt (Handelsname Fumaderm),[27] nachdem der Biochemiker Walter Schweckendiek 1959 erstmals Dimethylfumarat im Selbstversuch getestet hatte. Biologisch aktiv ist vermutlich der Fumarsäuremonomethylester. Die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) urteilte 2011 in ihrer S3-Leitlinie zur Therapie der Psoriasis vulgaris, Fumärsäureester seien zur Langzeittherapie geeignet, stellte aber fest, dass es zur Wirksamkeit und Sicherheit der Fumarsäureester-Therapie bisher mehr Beobachtungen als dokumentierte klinische Studien gibt. Angesichts der Tatsache, dass es sich bei der Schuppenflechte um eine Autoimmun-Erkrankung, also eine entzündliche, systemische Erkrankung handelt, spielt die systemische Behandlung eindeutig die größere Rolle. Eine kosmetische (topische) Behandlung kann für eine systemische Erkrankung keine zufriedenstellende Lösung sein. Fumarsäuredimethylester wirken immunmodulatorisch (antientzündlich) und sind die Antipsoriatika mit der längsten Erfahrung im Einsatz (nämlich seit 1959).[6] Dadurch, dass die Entzündung zurückgeht, gehen auch die Schuppen zurück.
Die Substanz zeigt zwar wenig unerwünschte Wechselwirkungen mit anderen Medikamenten, die Leitlinie empfiehlt aber, zusammen mit Fumarsäureestern keine anderen Basistherapeutika einzusetzen, und rät zu besonderer Vorsicht bei gleichzeitiger Behandlung mit Präparaten, welche die Nierenfunktion beeinträchtigen können.[28]
Fumarsäureester sind in Deutschland die zur Behandlung der Psoriasis am häufigsten verwendeten systemisch wirkenden Substanzen.[29] Eine neue, nur auf Dimethylfumarat basierende Formulierung mit kontrollierter Freisetzung des Wirkstoffes (FP187) befindet sich im späten klinischen Entwicklungsstadium für Psoriasis.[30][31]
Weitere Indikationen
Auch andere chronische Haut- und Autoimmunerkrankungen, so zum Beispiel Necrobiosis lipoidica, Granuloma anulare, Sarkoidose und Morbus Crohn, sprechen auf Dimethylfumarat an.[6]
Frühe Nutzenbewertung nach § 35a SGB V
Das IQWiG kam 2014 in der frühen Nutzenbewertung zu dem Schluss, dass ein Zusatznutzen des Wirkstoffs im Vergleich zu Interferon beta-1a in der Behandlung Erwachsener mit schubförmig-remittierender Multipler Sklerose (RRMS) mangels geeigneter Studiendaten nicht belegt sei.[32][33] Der Gemeinsame Bundesausschuss schloss sich dieser Einschätzung an.[34]
In einer weiteren frühen Nutzenbewertung hat das IQWiG 2018 untersucht, ob Fumarsäuredimethylester Erwachsenen mit mittelschwerer bis schwerer Psoriasis vulgaris, die eine systemische Arzneimitteltherapie benötigen, einen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie bietet. Personen, die auf andere systemische Therapien nur unzureichend ansprechen oder bei denen eine Kontraindikation oder Unverträglichkeit gegenüber solchen Therapien vorliegt, wurden dabei gesondert betrachtet. Weder für sie noch für die übrigen Patientinnen und Patienten ist demnach ein Zusatznutzen von Fumarsäuredimethylester belegt.[35] Der Gemeinsame Bundesausschuss schloss sich dem Bewertungsergebnis an.[36]
Sicherheitshinweise
Dimethylfumarat ist nicht nur ein potentes Kontaktallergen, sondern wird über die Haut auch gut resorbiert. Es erwies sich im Tierversuch mit Kaninchen und Ratten als mäßig toxisch (LD50 2.240 mg·kg−1 bei Ratten oral, aber bereits 1.250 mg·kg−1 bei Kaninchen dermal[3][4]). Akut werden beim Menschen Augen, Atemwege und Haut gereizt; auch eine stark hautsensibilisierende Wirkung wurde beobachtet. Häufigste unerwünschte Sofort-Symptome sind kurzzeitiges Flush und Durchfall. Bei chronischer Aufnahme, etwa bei der Psoriasisbehandlung, kommt es bei etwa der Hälfte der Patienten zu Veränderungen des weißen Blutbilds in Form einer Lymphopenie, bei ca. 11 % zur Leukopenie, und immerhin etwa 3 % der Behandelten entwickeln schwerere Formen von Lymphopenie, die während der Behandlung auch wiederholt auftreten oder dauerhaft verlaufen können. Beobachtet werden auch Verschlechterungen der Nierenfunktion und von Leberwerten. Daher sind regelmäßige Kontrollen von Nieren-, Leber- und Blutbild-Parametern notwendig, notfalls ist die Dosis zu reduzieren oder das Medikament abzusetzen.[37][28]
Nicht-medizinische Verwendung
Dimethylfumarat ist ein Biozid, das gegen Schimmelpilze wirkt. Es kann beispielsweise zum Schutz von Ledermöbeln oder Schuhen eingesetzt werden. Auf Grund von gehäufter Auslösung allergischer Reaktionen ist der Einsatz von Dimethylfumarat jedoch seit 1998 für in der Europäischen Union hergestellte, seit dem 1. Mai 2009 auch für importierte Produkte verboten.[38]
Einzelnachweise
- Eintrag zu Dimethylfumarat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-198.
- American Industrial Hygiene Association Journal, 1969, Vol. 30, S. 470.
- Eintrag zu Dimethyl fumarate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Grünes Licht für Fumarsäure und Teriflunomid zur Behandlung der schubförmigen Multiple Sklerose. (Memento vom 10. März 2016 im Internet Archive) dmsg.de, 22. März 2013; abgerufen am 26. September 2013.
- M. Meissner, E. M. Valesky u. a.: Dimethyl fumarate - only an anti-psoriatic medication? In: Journal der Deutschen Dermatologischen Gesellschaft, Band 10, Nummer 11, 2012, S. 793–801, doi:10.1111/j.1610-0387.2012.07996.x. PMID 22897153 (Review).
- Verbraucherschutz: Kommission verbietet Biozid, das schwere Allergien hervorruft. (Memento vom 16. Juni 2009 im Internet Archive) Europäische Kommission, 30. April 2009.
- Verbraucherschutz: EU verbietet Dimethylfumarat (DMF) in Konsumgütern wie Sofas, Schuhen und Plüschspielzeug. Europäische Kommission, 30. April 2009.
- Ulrich Schwabe, Dieter Paffrath: Arzneiverordnungs-Report 2005: Aktuelle Daten, Kosten, Trends und Kommentare. Springer, 2006, ISBN 978-3-540-28368-3, S. 588.
- Martin Rostami Yazdi: Pharmakokinetik und Pharmakodynamik von Fumarsäureestern. 2008, Dissertationsschrift, Mathematisch-Naturwissenschaftliche Fakultät der Universität Kiel, urn:nbn:de:gbv:8-diss-27682
- J. C. Lehmann, J. J. Listopad u. a.: Dimethylfumarate induces immunosuppression via glutathione depletion and subsequent induction of heme oxygenase 1. In: Journal of Investigative Dermatology, Band 127, Nummer 4, April 2007, S. 835–845, doi:10.1038/sj.jid.5700686. PMID 17235328.
- R. H. Scannevin, S. Chollate u. a.: Fumarates promote cytoprotection of central nervous system cells against oxidative stress via the nuclear factor (erythroid-derived 2)-like 2 pathway. In: The Journal of pharmacology and experimental therapeutics. Band 341, Nummer 1, April 2012, S. 274–284, doi:10.1124/jpet.111.190132. PMID 22267202.
- H. Ashrafian, G. Czibik u. a.: Fumarate is cardioprotective via activation of the Nrf2 antioxidant pathway. In: Cell metabolism. Band 15, Nummer 3, März 2012, S. 361–371, doi:10.1016/j.cmet.2012.01.017. PMID 22405071. PMC 3314920 (freier Volltext).
- Tecfidera® Fachinformation. (PDF; 487 kB) tecfidera.de; abgerufen am 7. Februar 2014.
- R. Gold, L. Kappos u. a.: Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. In: The New England Journal of Medicine, Band 367, Nummer 12, September 2012, S. 1098–1107, doi:10.1056/NEJMoa1114287. PMID 22992073.
- R. J. Fox, D. H. Miller u. a.: Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. In: The New England Journal of Medicine, Band 367, Nummer 12, September 2012, S. 1087–1097, doi:10.1056/NEJMoa1206328. PMID 22992072.
- A. H. Ropper: The “poison chair” treatment for multiple sclerosis. In: The New England Journal of Medicine, Band 367, Nummer 12, September 2012, S. 1149–1150, doi:10.1056/NEJMe1209169. PMID 22992079.
- FDA approves new multiple sclerosis treatment: Tecfidera, Pressemitteilung der FDA vom 27. März 2013, abgerufen am 6. Februar 2014.
- TECFIDERA® (Dimethyl Fumarate) Approved in the European Union as a First-Line Oral Treatment for Multiple Sclerosis, Pressemitteilung von BiogenIdec vom 4. Februar 2014, abgerufen am 26. März 2015.
- (AkdÄ) Tecfidera® (Dimethylfumarat), Information der Arzneimittelkommission der deutschen Ärzteschaft, 15. Mai 2014; abgerufen am 15. Mai 2014.
- CHMP has updated its previous opinion and agreed that dimethyl fumarate in Tecfidera is qualified as a new active substance. Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 18-21 November 2013; abgerufen am 6. Februar 2014.
- Galenus-von-Pergamon-Preis 2014 Preise für Innovationen und Ideen. Pressemeldung von Springer Medizin, abgerufen am 7. November 2014.
- Biogen Highlights at ECTRIMS 2018 Data on Its Industry-Leading Multiple Sclerosis Portfolio and a Range of Initiatives Aimed at Transforming Patient Care. Abgerufen am 16. April 2019 (englisch).
- Information zu Tecfidera® (PDF; 678 kB) Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); abgerufen am 26. März 2015.
- Lisa Meier: KKNMS: Engmaschige Blutbildkontrollen unter Dimethylfumarat unverzichtbar. Krankheitsbezogenes Kompetenznetz Multiple Sklerose, Pressemitteilung vom 24. Oktober 2014 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 18. Januar 2020.
- Rote-Hand-Brief zu Tecfidera® (Dimethylfumarat): Verdachtsfall von progressiver multifokaler Leukenzephalopathie (PML), AkdÄ Drug Safety Mail 2014-34 vom 4. Dezember 2014; abgerufen am 26. März 2015.
- F. von Bruchhausen, R. Braun, Siegfried Ebel: Hagers Handbuch der pharmazeutischen Praxis. Band 4: Stoffe A–K. Springer, 1999, ISBN 978-3-540-62644-2, S. 468.
- A. Nast: S3-Leitlinie zur Therapie der Psoriasis vulgaris Archiviert vom Original am 28. Februar 2013. In: AWMF Online. März.
- PsoBest: Langzeitstudie zur Wirksamkeit, Verträglichkeit und Sicherheit der Biologika- und konventionellen Systemtherapie bei Psoriasis und Psoriasis-Arthritis in der Routineversorgung: Einschlusszahlen.
- Efficacy and Safety Trial of FP187 in Moderate to Severe Plaque Psoriasis. Clinicaltrials.gov. Abgerufen am 13. Dezember 2012.
- Forward Pharma Newsroom. Forward Pharma. Archiviert vom Original am 21. September 2013. Abgerufen am 13. Dezember 2012.
- A14-14 Dimethylfumarat – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung), abgerufen am 8. Juli 2019.
- A14-33 Addendum zum Auftrag A14-14 (Dimethylfumarat), abgerufen am 8. Juli 2019.
- Beschluss des Gemeinsamen Bundesausschusses vom 16. Oktober 2014 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Dimethylfumarat, abgerufen am 8. Juli 2019.
- A17-49 Dimethylfumarat (Psoriasis) - Nutzenbewertung gemäß § 35a SGB V, abgerufen am 29. Oktober 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 16. März 2018 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Dimethylfumarat (neues Anwendungsgebiet: Plaque-Psoriasis), abgerufen am 29. Oktober 2018.
- Gebrauchsinformation für Fachkreise zu Fumaderm® und Fumaderm® initial.
- Regelungen zu Dimethylfumarat. (Memento vom 4. Februar 2012 im Internet Archive) Bundesministerium für Arbeit, Soziales und Konsumentenschutz; abgerufen am 3. Januar 2012.