Immunglobulin G
Immunglobulin G (IgG) – der Hauptbestandteil der Gammaglobulin-Fraktion der Serumelektrophorese – sind die Antikörper (Immunglobuline) der Klasse G, die vor allem gegen Viren und Bakterien wirken. Die Bildung von Immunglobulinen, genannt auch Gammaglobuline, ist Teil der humoralen Immunabwehr, also der nicht-zellgebundenen Immunabwehr durch im Blut lösliche Stoffe. Biochemisch handelt es sich um spezielle Eiweißstoffe, die Glykoproteine. Sie werden von B-Lymphozyten oder Plasmazellen nach Kontakt mit einem Antigen produziert.
Neugeborene können zunächst keine eigenen IgG bilden und sind vorübergehend auf die Antikörper der Mutter angewiesen. Schon im fötalen Blut lässt sich teilweise IgG nachweisen. Es passiert die Plazenta mit Hilfe von bestimmten Transportrezeptoren.
Funktion
Immunglobuline vom Typ G dienen der Neutralisation,[1] der Opsonisierung,[2] der Komplementaktivierung[3] und antikörperabhängigen zellvermittelten Zytotoxizität.[4] Die Immunglobuline selbst können das entsprechende Ziel nicht zerstören, sie haben vielmehr die Aufgabe, die Ziele zu markieren und für weitere Abwehrsysteme besser angreifbar zu machen. Da ein IgG jedoch nur an ein einziges Antigen binden kann, gehört die Antikörperbildung zum spezifischen Anteil des Immunsystems. Bestimmte Plasmazellen bilden ganz bestimmte Antikörper, die gegen ein bestimmtes Antigen gerichtet sind. Man spricht daher auch von der Funktion der Plasmazelle als Gedächtniszelle. Da IgG erst nach einem Klassenwechsel gebildet werden, werden sie aufgrund des verzögerten Auftretens bei einem Erstkontakt mit einem Antigen zur sekundären humoralen Immunantwort gezählt. Bei einem erneuten Kontakt werden sie bereits nach 24 bis 48 Stunden nachweisbar. Im Rahmen einer Impfung kann die Antikörperbildung gegen ein bestimmtes Antigen von den Plasmazellen „gelernt“ werden und kann den Organismus in die Lage versetzen, bei erneutem Kontakt mit dem gleichen Antigen auch nach vielen Jahren rasch und in großer Zahl spezifisch wirkende Antikörper zu bilden.
In der Milz werden die Immunglobuline teilweise zerlegt, wobei das Gewebshormon Tuftsin (ein Tetrapeptid) freigesetzt wird.
Subtypen
Es gibt vier Subtypen von IgG, IgG1-4. IgG ist der häufigste Typ von Immunglobulinen im Blutkreislauf des Menschen.
| Name | Anteil an IgG | Plazentagängigkeit | Komplementaktivierung | Bindung an Fc-Rezeptoren auf Phagozyten | Plasmahalbwertszeit[5] |
| IgG1 | 66 % | Ja (1,47)* | zweithöchste | hohe Affinität | 21 Tage |
| IgG2 | 23 % | Nein (0,8)* | dritthöchste | sehr niedrige Affinität | 21 Tage |
| IgG3 | 7 % | Ja (1,17)* | höchste | hohe Affinität | 7 Tage |
| IgG4 | 4 % | Ja (1,15)* | keine | mittlere Affinität | 21 Tage |
| * Verhältnis der Konzentrationen von Nabelschnur- zu Mutterblut.[6] | |||||
Struktur
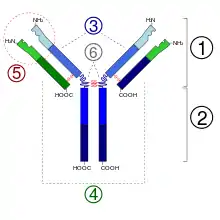
Der Antikörper besteht aus zwei langen („schweren“) und zwei kurzen („leichten“) Proteinketten und hat die Form eines „Y“. Die schweren Ketten haben eine Molekülmasse von 50.000 Dalton und sind beim "Immunglobulin G" stets der Klasse Gamma zuzuordnen, die leichten Ketten haben eine Molekülmasse von 25.000 Dalton. Die gesamte molare Masse beträgt rund 150.000 Dalton (2×50.000 + 2×25.000). An den kurzen Enden des Y befinden sich die Bindungsstellen, die an Antigene (Fremdkörper, zum Beispiel spezifische Oberflächenstrukturen von Bakterienzellen) oder Haptene binden können. Jeweils eine schwere und eine leichte Kette sind über eine Disulfidbrücke verbunden. Beide schwere Ketten sind über zwei Disulfidbrücken verbunden. Der antigenbindende Anteil der IgG (Fab-Fragment) ist sehr variabel. Es ist berechnet worden, dass etwa 106 bis 109 chemisch verschiedene Fab-Abschnitte möglich sind. Die entsprechenden Genabschnitte unterliegen während des Lebens den entsprechenden notwendigen Mutationen. Die Bindung an Oberflächenantigene löst weitere immunologische Reaktionen aus, die zur Vernichtung der betroffenen Zellen oder Antigen-präsentierenden Strukturen führen kann. Nach der Glykosylierung des IgG an Position N297 der schweren Kette steigt seine Affinität zu seinem Rezeptor Fcγ-Rezeptor[7][8] und zum Komplementrezeptor.[3] Durch unterschiedliche posttranslationale Modifikationen werden die IgG teilweise unterschiedlich verändert.[9]
Die schweren Ketten der Immunglobuline der Klasse G (Gamma) werden in vier isotypische Subklassen (Gamma 1-4) unterteilt. Die leichten Ketten kommen in zwei Arten (kappa und lambda) vor.
Durch bestimmte Enzyme (z. B. Papain oder Pepsin) lassen sich die IgG-Antikörper in zwei Fragmentarten aufspalten. Die drei Fragmente, die man nach dem Schneiden mit Papain erhält, sind:
- Fab: Zwei Fragmente, welche eine einwertige Antigenbindungsstelle enthalten (engl. fragment, antigen binding).
- Fc: Ein Fragment, das an Komplementproteine oder zelluläre Fc-Rezeptoren binden kann (engl. fragment, cristallizable).
Wenn man das Immunglobulin mit Pepsin schneidet, dann erhält man:
- F[ab]2: Ein Fragment, welches eine zweiwertige Antigenbindungsstelle enthält und durch die Disulfidbrücken unter der Gelenkregion zusammengehalten wird
- Fc: Es entsteht kein Fc-Fragment, da das Heterodimer nicht mehr durch die Disulfidbrücken unter der Gelenkregion zusammengehalten wird. Das Resultat sind zwei Polypeptidketten
Wenn man das Immunglobulin mit Plasmin schneidet, erhält man:
- Facb: Ein Fragment, welches eine zweiwertige Antigenbindungsstelle (Paratop) enthält und weiterhin durch die Polysaccharidkomponente und Disulfidbrücken im Fc-Teil zusammengehalten wird
- pFc: Zwei Polypeptidketten, die nicht durch Bindungen zusammengehalten werden.
Pathologie
Körpereigene Antigene werden im Rahmen der Selbsttoleranz als „eigen“ betrachtet und führen normalerweise nicht zu einer spezifischen Antikörperbildung gegen diese Antigene. Bei Autoimmunerkrankungen kann es jedoch zu einer Bildung von Antikörpern gegen körpereigene Strukturen kommen, die einen Krankheitswert haben.
Störungen der Antikörper-IgG-Bildung werden als Gammopathien bezeichnet. Die Hypogammaglobulinämie bezeichnet eine krankhaft zu geringe Produktion an IgG-Antikörpern. Die Agammaglobulinämie bezeichnet den Ausfall der Antikörperbildung. Schwerer Eiweißmangel (Inanition, lange Hungerzeiten) oder schwere Nierenerkrankungen (nephrotisches Syndrom) können die Antikörperbildung beeinträchtigen. Eine Herabsetzung der IgG-Bildung führt zu teilweise schweren Infektionskrankheiten. IgG sind an manchen chronisch-entzündlichen Darmerkrankungen[10] und Allergien des Typs II und III beteiligt.
IgG4-Autoimmunerkrankungen wurden als eigene Krankheitsgruppe beschrieben.
Labor
Die Immunglobuline G sind in der konventionellen Immunelektrophorese oder besser in der Immunfixationselektrophorese identifizierbar. Im Blutplasma des Menschen sind etwa 8 Gramm IgG pro Liter enthalten und stellen 11–18 % des Gesamteiweißes im Blut dar. IgG ist damit nach Albumin das zweithäufigste Protein im Blutplasma.
Anwendungen
Immunglobuline vom Typ G (Handelspräparat etwa Endobulin zur intravenösen Anwendung) werden medizinisch unter anderem zur passiven Immunisierung und zur Immuntherapie verwendet. In der Biochemie werden sie zur Zelldepletion und zur Immunfärbung eingesetzt. Manche Ärzte bieten eine Bestimmung des Immunglobulin G (IgG) an, um Beschwerden abzuklären, die auf eine Nahrungsmittelallergie zurückgehen könnten. Der IGeL-Monitor des Medizinischen Dienstes Bund bewertete die Immunglobulin G-Bestimmung zur Diagnose einer Nahrungsmittelallergie als „negativ“. Der IgG-Test sei nicht geeignet, um Nahrungsmittelallergien zu erkennen. Für Allergien sei ein anderer Typ von Immunglobulinen verantwortlich. Zudem zeigten auch die untersuchten Studien keine Hinweise auf einen Nutzen, da eine hohe Konzentration an IgG nicht mit Allergie-Symptomen einhergehe. Jedoch gebe es Hinweise auf erhebliche Schäden, da der Test zu einer unnötigen Einschränkung der Ernährung führen könne, im Extremfall sogar zu einer Mangelernährung.[11]
Weblinks
- Begleitartikel zu einem Radiobeitrag (WDR 5, „Leonardo“), der sich kritisch mit IgG-Tests auseinandersetzte. (Memento vom 30. September 2007 im Internet Archive)
- Deutsches Ärzteblatt: Nahrungsmittelallergie und - unverträglichkeit: Bewährte statt nicht evaluierte Diagnostik (8. Juli 2005)
Einzelnachweise
- S. Bournazos, D. J. DiLillo, J. V. Ravetch: The role of Fc-FcγR interactions in IgG-mediated microbial neutralization. In: The Journal of experimental medicine. Band 212, Nummer 9, August 2015, S. 1361–1369, doi:10.1084/jem.20151267. PMID 26282878, PMC 4548051 (freier Volltext).
- V. Trivedi, S. C. Zhang, A. B. Castoreno, W. Stockinger, E. C. Shieh, J. M. Vyas, E. M. Frickel, A. Nohturfft: Immunoglobulin G signaling activates lysosome/phagosome docking. In: Proceedings of the National Academy of Sciences. Band 103, Nummer 48, November 2006, S. 18226–18231, doi:10.1073/pnas.0609182103. PMID 17110435, PMC 1838734 (freier Volltext).
- I. Quast, J. D. Lünemann: Fc glycan-modulated immunoglobulin G effector functions. In: Journal of clinical immunology. Band 34 Suppl 1, Juli 2014, S. S51–S55, doi:10.1007/s10875-014-0018-3. PMID 24760108.
- M. Biburger, A. Lux, F. Nimmerjahn: How immunoglobulin G antibodies kill target cells: revisiting an old paradigm. In: Advances in immunology. Band 124, 2014, S. 67–94, doi:10.1016/B978-0-12-800147-9.00003-0. PMID 25175773.
- F. A. Bonilla: Pharmacokinetics of immunoglobulin administered via intravenous or subcutaneous routes. In: Immunology and allergy clinics of North America. Band 28, Nummer 4, November 2008, S. 803–19, ix, doi:10.1016/j.iac.2008.06.006. PMID 18940575.
- S. Hashira, S. Okitsu-Negishi, K. Yoshino: Placental transfer of IgG subclasses in a Japanese population. In: Pediatr Int. Band 42, Nr. 4, August 2000, S. 337–42, doi:10.1046/j.1442-200x.2000.01245.x, PMID 10986861.
- J. Lu, P. D. Sun: Structural mechanism of high affinity FcγRI recognition of immunoglobulin G. In: Immunological reviews. Band 268, Nummer 1, November 2015, S. 192–200, doi:10.1111/imr.12346. PMID 26497521.
- Q. M. Hanson, A. W. Barb: A perspective on the structure and receptor binding properties of immunoglobulin G Fc. In: Biochemistry. Band 54, Nummer 19, Mai 2015, S. 2931–2942, doi:10.1021/acs.biochem.5b00299. PMID 25926001, PMC 4894528 (freier Volltext).
- L. K. Hmiel, K. A. Brorson, M. T. Boyne: Post-translational structural modifications of immunoglobulin G and their effect on biological activity. In: Analytical and bioanalytical chemistry. Band 407, Nummer 1, Januar 2015, S. 79–94, doi:10.1007/s00216-014-8108-x. PMID 25200070.
- C. Cai, J. Shen, D. Zhao, Y. Qiao, A. Xu, S. Jin, Z. Ran, Q. Zheng: Serological investigation of food specific immunoglobulin G antibodies in patients with inflammatory bowel diseases. In: PloS one. Band 9, Nummer 11, 2014, S. e112154, doi:10.1371/journal.pone.0112154. PMID 25393003, PMC 4230978 (freier Volltext).
- IGeL-Monitor, Bewertung der Immunglobulin G-Bestimmung zur Diagnose einer Nahrungsmittelallergie. Abgerufen am 15. Oktober 2018.