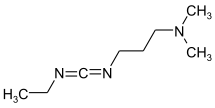
1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid
1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC, EDCI oder EDAC) ist eine reaktive organische Verbindung aus der Gruppe der Carbodiimide, die häufig in der Synthesechemie eingesetzt wird. Aufgrund der besseren Handhabung wird statt der freien Base meist das Hydrochlorid eingesetzt.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H17N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 155,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
| ||||||||||||||||||
| Dichte |
0,88 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
| ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung
Die Synthese kann in zwei Reaktionsschritten erfolgen. Im ersten Schritt wird Ethylisocyanat mit N,N-Dimethyl-1,3-diaminopropan umgesetzt. Das resultierende Harnstoffderivat wird dann im zweiten Schritt zur Zielverbindung dehydratisiert.[6]

Eigenschaften
Wie die meisten Carbodiimide hydrolysiert die Substanz in wässriger Lösung; im sauren pH-Bereich geschieht dies schneller.[7] Die Verbindung ist thermisch instabil. Eine DSC-Messung zeigt ab 120 °C eine stark exotherme Zersetzungsreaktion mit einer Wärmetönung von −549 kJ·kg−1 bzw. −105,2 kJ·mol−1.[8]
Verwendung
EDC wird häufig zur Synthese von Carbonsäureamiden und in der Biochemie zur chemischen Vernetzung (Cross-Linking) von Proteinen eingesetzt.[9] Im Gegensatz zu Dicyclohexylcarbodiimid kann der bei Carbonsäureamid-Synthesen entstehende Harnstoff leicht abgetrennt werden.
Sicherheitshinweise
Die freie Base reizt Augen, Schleimhäute und Haut und wirkt als Kontaktallergen.[5] Beim Verbrennen können giftige Gase wie Kohlenstoffmonoxid und Stickoxide entstehen.
Einzelnachweise
- Datenblatt N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide bei Sigma-Aldrich, abgerufen am 7. Februar 2020 (PDF).
- Datenblatt 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Externe Identifikatoren von bzw. Datenbank-Links zu N'-(Ethylcarbonimidoyl)-N,N-dimethylpropan-1,3-diamin Hydrochlorid: CAS-Nummer: 25952-53-8, EG-Nummer: 247-361-2, ECHA-InfoCard: 100.043.041, PubChem: 2723939, ChemSpider: 2006116, Wikidata: Q55444948.
- R. S. Pottorf: 1-Ethyl-3-(3′-dimethylaminopropyl)carbodiimide Hydrochloride. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, 2001, doi:10.1002/047084289X.re062
- Peter Wipf: Handbook of Reagents for Organic Synthesis. Wiley, 2005, ISBN 0-470-86298-X.
- J. Sheehan, P. Cruickshank, G. Boshart: A Convenient Synthesis of Water-Soluble Carbodiimides. In: J. Org. Chem. 26, (1961) 2525, doi:10.1021/jo01351a600.
- Nadia Wrobel, Manfred Schinkinger, Vladimir M. Mirsky: A Novel Ultraviolet Assay for Testing Side Reactions of Carbodiimides. In: Analytical Biochemistry. Band 305, Nr. 2, S. 135–138, doi:10.1006/abio.2002.5646 (elsevier.com [abgerufen am 12. Mai 2017]).
- Sperry, J.B.; Minteer, C.J.; Tao, J.; Johnson, R.; Duzguner, R.; Hawksworth, M.; Oke, S.; Richardson, P.F.; Barnhart, R.; Bill, D.R.; Giusto, R.A.; Weaver, J.D.: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing in Org. Process Res. Dev. 22 (2018) 1262–1275, doi:10.1021/acs.oprd.8b00193.
- D. Schulz, A. Sinz: Chemisches Cross-Linking und Massenspektrometrie zur strukturellen und funktionellen Charakterisierung von Proteinen. In: Biospektrum. Jg. 10, Nr. 1, 2004, S. 45–48. (PDF)
