HATU
HATU [O-(7-Azabenzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium-hexafluorphosphat] ist ein Kupplungsreagenz, das in der organischen Chemie und Biochemie zur Peptidsynthese und allgemein zur Kupplung von Aminosäuren verwendet wird.[2] Die Verbindung ist nach dem SprengG als explosionsgefährlich eingestuft und wurde der Stoffgruppe C zugeordnet.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
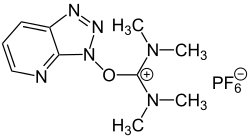 | ||||||||||||||||
| Uronium-Salz (= O-Form von HATU) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | HATU | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H15F6N6OP | |||||||||||||||
| Kurzbeschreibung |
hellbrauner kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 380,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Struktur
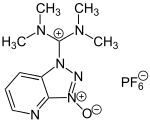
HATU kann in zwei Formen vorliegen, als Uroniumsalz (O-Form) oder als das bevorzugte, aber weniger reaktive Iminiumsalz (N-Form). Bei der Synthese aus 1-Hydroxy-7-azabenzotriazol (HOAt) muss die Anwesenheit von tertiären Aminen ausgeschlossen werden, da diese die Umwandlung der Uroniumform in die N-Form katalysieren.[4] Die O-Form kann bei der Synthese durch Verwendung von 1-Kaliumoxy-7-azabenzotriazol anstelle von 1-Hydroxy-7-azabenzotriazol erzeugt werden und wird zur Vermeidung einer Isomerisierung zügig verwendet. Die vergleichsweise hohe Reaktionsrate liegt vermutlich an einem Nachbargruppeneffekt durch das Stickstoffatom des Pyridinrings, der das angreifende Amin durch einen siebenatomigen, über eine Wasserstoffbrückenbindung geschlossenen Ring stabilisiert.[5] Durch Einwirkung von Triethylamin kann die O-Form in die N-Form umgelagert werden.
Reaktionen
Durch Reaktion von HATU mit Aminosäuren werden in einem ersten Schritt unter Freisetzung von Tetramethylharnstoff aktivierte Aminosäuren erzeugt (Übergangszustand O-Acyl(tetramethyl)isouroniumsalz), die im zweiten Schritt bereitwillig mit anderen Aminosäuren reagieren.

HATU kann im Allgemeinen für Acylierungsreaktionen von Alkoholen oder Aminen verwendet werden, die Reaktionsprodukte sind Ester bzw. Amide. Mit HATU können Amin-modifizierte Nukleinsäuren an Proteine oder Peptide gekuppelt werden.[6] HATU wird meist in Anwesenheit der Hünig-Base (N,N-Diisopropylethylamin, DIPEA) und dem Lösungsmittel Dimethylformamid verwendet. Zur Vermeidung einer Racemisierung wird oftmals alternativ HBTU, HCTU,[7] TBTU, COMU,[8] TOMBU oder COMBU verwendet.[9]
Die Verbindung ist thermisch instabil und kann sich stark exotherm zersetzen. Eine DSC-Messung zeigt ab 161 °C eine Zersetzungsreaktion mit einer Reaktionswärme von −1131 J·g−1 bzw. −430 kJ·mol−1.[10]
Geschichte
HATU wurde erstmals 1993 durch Louis A. Carpino beschrieben.[11]
Einzelnachweise
- Datenblatt HATU, ≥98.0% (CHN) bei Sigma-Aldrich, abgerufen am 1. August 2014 (PDF).
- L. P. Miranda, P. F. Alewood: Accelerated chemical synthesis of peptides and small proteins. In: Proceedings of the National Academy of Sciences of the United States of America. Band 96, Nummer 4, Februar 1999, S. 1181–1186, PMID 9989998. PMC 15437 (freier Volltext).
- Bekanntmachung der gemäß § 2 SprengG von der BAM seit 1987 neu getroffenen Feststellungen - Feststellungsbescheid Nr. 457 vom 20. Dezember 2006 pdf-Link.
- Louis A. Carpino, Hideko Imazumi, Ayman El-Faham, Fernando J. Ferrer, Chongwu Zhang, Yunsub Lee, Bruce M. Foxman, Peter Henklein, Christiane Hanay, Clemens Mügge, Holger Wenschuh, Jana Klose, Michael Beyermann, Michael Bienert: The Uronium/Guanidinium Peptide Coupling Reagents: Finally the True Uronium Salts. In: Angewandte Chemie International Edition. 41, 2002, S. 441–445, doi:10.1002/1521-3773(20020201)41:3<441::AID-ANIE441>3.0.CO;2-N.
- Louis A. Carpino, Hideko Imazumi, Bruce M. Foxman, Michael J. Vela, Peter Henklein, Ayman El-Faham, Jana Klose, Michael Bienert: Comparison of the Effects of 5- and 6-HOAt on Model Peptide Coupling Reactions Relative to the Cases for the 4- and 7-Isomers. In: Organic Letters. 2, 2000, S. 2253–2256, doi:10.1021/ol006013z.
- J. G. Aaronson, L. J. Klein, A. A. Momose, A. M. O'Brien, A. W. Shaw, T. J. Tucker, Y. Yuan, D. M. Tellers: Rapid HATU-mediated solution phase siRNA conjugation. In: Bioconjugate Chemistry. Band 22, Nummer 8, August 2011, S. 1723–1728, doi:10.1021/bc2001227. PMID 21744777.
- C. U. Hjørringgaard, A. Brust, P. F. Alewood: Evaluation of COMU as a coupling reagent for in situ neutralization Boc solid phase peptide synthesis. In: Journal of peptide science : an official publication of the European Peptide Society. Band 18, Nummer 3, März 2012, S. 199–207, doi:10.1002/psc.1438, PMID 22252935.
- R. Subirós-Funosas, L. Nieto-Rodriguez, K. J. Jensen, F. Albericio: COMU: scope and limitations of the latest innovation in peptide acyl transfer reagents. In: Journal of peptide science : an official publication of the European Peptide Society. Band 19, Nummer 7, Juli 2013, S. 408–414, doi:10.1002/psc.2517, PMID 23712932.
- Y. E. Jad, S. N. Khattab, B. G. de la Torre, T. Govender, H. G. Kruger, A. El-Faham, F. Albericio: TOMBU and COMBU as Novel Uronium-type peptide coupling reagents derived from Oxyma-B. In: Molecules. Band 19, Nummer 11, 2014, S. 18953–18965, doi:10.3390/molecules191118953, PMID 25412042.
- J. B. Sperry, C. J. Minteer, JingYa Tao, R. Johnson, R. Duzguner, M. Hawksworth, S. Oke, P. F. Richardson, R. Barnhart, D. R. Bill, R. A. Giusto, J. D. Weaver: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing. In: Organic Process Research & Development. Band 22, 2020, S. 1262–1275, doi:10.1021/acs.oprd.8b00193.
- Louis A. Carpino: 1-Hydroxy-7-azabenzotriazole. An efficient peptide coupling additive. In: Journal of the American Chemical Society. 115, 1993, S. 4397–4398, doi:10.1021/ja00063a082.

