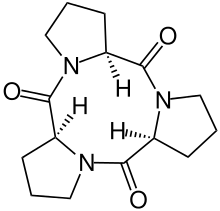
Cyclopeptide
Eigenschaften
Zu den Cyclopeptiden zählen Oligo- und Polypeptide, deren Aminosäureseabfolge kovalent zu einem Ring oder auch mehreren geschlossen ist.[2] Als sogenannte homodete Cyclopeptide besitzen sie Peptidbindungen zwischen allen Aminosäuren, so beispielsweise Cyclosporin A.
Heterodete Cyclopeptide dagegen weisen auch andere als nur Peptidbindungen auf, so besitzen beispielsweise Bacitracin und Microcystin daneben jeweils eine Isopeptidbindung. Die Cyclopeptide der Amatoxine und Phallotoxine haben außer den ringförmig verknüpfenden Peptidbindungen zwischen ihren Aminosäuren zusätzlich noch eine interne Querbrücke zwischen Tryptophan und Cystein (als Tryptathionin). Aureobasidin A und HUN-7293 besitzen außerdem Esterbindungen.
Cyclopeptide mit zwei Ringen werden als bicyclische Peptide bezeichnet, zu den kleinsten zählen Phalloidin und Amanitin.
Weitere Beispiele für Cyclopeptide sind Bacitracin, Colistin, Cyclotid, Dactinomycin, Daptomycin, Gramicidin S, HC-Toxin, Hymenistatin, Nisin, Polymyxin B, Pristinamycin, Octreotid, Valinomycin, Viscumamid oder auch Yunnanin A.
Aufgrund der Ringform sind Cyclopeptide oftmals resistent gegen Proteolyse (z. B. durch Exopeptidasen), weisen eine höhere Thermostabilität auf und sind weniger beweglich.[3]
Unter die Definition der heterodeten Cyclopeptide fallen zwar auch kettenförmige Peptide (z. B. Keratin, Insulin, Oxytocin), bei denen zwei oder mehr Ketten über mehrere Disulfidbrücken miteinander verbunden sind – diese Peptide enthalten auch Ringe, zählen im engeren Sinne jedoch nicht zu den Cyclopeptiden.
Cyclopeptide dienen in der Natur einer Vielzahl unterschiedlicher Funktionen.[4][5] Oft enthalten Cyclopeptide statt der üblichen L-Aminosäuren teilweise D-Aminosäuren oder α-Hydroxycarbonsäuren (Cyclodepsipeptide). Die Cyclodepsipeptide sind zugleich Lactame und Lactone. Manche Cyclopeptide werden per nichtribosomaler Peptidsynthese erzeugt.[6]
Beispiele
| Cyclopeptide (Beispiele) | |||
| Name | Cyclodipeptid Gly-Gly | Cyclodipeptid Ala-Ala | Cyclodepsipeptid |
| Strukturformel |  |  |  |
| Bemerkung | Einfachstes Diketopiperazin, aufgebaut aus zwei Molekülen Glycin (Peptidbindungen blau markiert) | Ein Diketopiperazin, aufgebaut aus zwei Molekülen Alanin (Peptidbindungen blau markiert) | Cyclisches Depsipeptid, aufgebaut aus Glycin und der Hydroxycarbonsäure L-Milchsäure (Peptidbindung blau markiert) |
Die einfachsten cyclischen Peptide sind Diketopiperazine (cyclische Dipeptide). Beispiele für größere homodete Cyclopeptide sind Caspofungin, Octreotid und Gramicidin S, die Cyclopeptide Oxytocin, Daptomycin und α-Amanitin sind hingegen heterodet. Weitere Beispiele für Cyclopeptide sind Penicillin, Vancomycin, Echinocandine und Bleomycin.[7]
Anwendung
Im Zuge eines Proteindesigns können zyklische Fusionsproteine erzeugt werden, die aufgrund fehlenden Zugangs für Exopeptidasen eine höhere Stabilität (und somit eine größere biologische Halbwertszeit) oder Aktivität aufweisen.[8][9] Isopeptidische Cyclopeptide können durch Inteine in vivo erzeugt werden.[10]
Einzelnachweise
- M. Rothe, K.-D. Steffen, I. Rothe: Synthese von Cyclo-tri-L-prolyl, einem Cyclo-tri-peptid mit neungliedrigem Ring, Angewandte Chemie 77, 1965, S. 347–348.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 847.
- D. J. Craik: Chemistry. Seamless proteins tie up their loose ends. In: Science. Band 311, Nummer 5767, März 2006, S. 1563–1564, doi:10.1126/science.1125248. PMID 16543448.
- S. H. Joo: Cyclic peptides as therapeutic agents and biochemical tools. In: Biomolecules & Therapeutics. Band 20, Nummer 1, Januar 2012, S. 19–26, doi:10.4062/biomolther.2012.20.1.019. PMID 24116270. PMC 3792197 (freier Volltext).
- K. Sivonen, N. Leikoski, D. P. Fewer, J. Jokela: Cyanobactins-ribosomal cyclic peptides produced by cyanobacteria. In: Applied Microbiology and Biotechnology. Band 86, Nummer 5, Mai 2010, S. 1213–1225, doi:10.1007/s00253-010-2482-x. PMID 20195859. PMC 2854353 (freier Volltext).
- A. Jegorov, M. Hajduch, M. Sulc, V. Havlicek: Nonribosomal cyclic peptides: specific markers of fungal infections. In: Journal of Mass Spectrometry Band 41, Nummer 5, Mai 2006, S. 563–576, doi:10.1002/jms.1042. PMID 16770826.
- M. Katsara, T. Tselios, S. Deraos, G. Deraos, M. T. Matsoukas, E. Lazoura, J. Matsoukas, V. Apostolopoulos: Round and round we go: cyclic peptides in disease. In: Current Medicinal Chemistry. Band 13, Nummer 19, 2006, S. 2221–2232, PMID 16918350.
- S. Chen, R. Gopalakrishnan, T. Schaer, F. Marger, R. Hovius, D. Bertrand, F. Pojer, C. Heinis: Dithiol amino acids can structurally shape and enhance the ligand-binding properties of polypeptides. In: Nature Chemistry. Band 6, Nummer 11, November 2014, S. 1009–1016, doi:10.1038/nchem.2043. PMID 25343607.
- M. Cemazar, S. Kwon, T. Mahatmanto, A. S. Ravipati, D. J. Craik: Discovery and applications of disulfide-rich cyclic peptides. In: Current Topics in Medicinal Chemistry. Band 12, Nummer 14, 2012, S. 1534–1545, PMID 22827522.
- A. R. Horswill, S. J. Benkovic: Cyclic peptides, a chemical genetics tool for biologists. In: Cell cycle (Georgetown, Tex.). Band 4, Nummer 4, April 2005, S. 552–555, PMID 15876867.