Octapeptide
Octapeptide gehören zu den Oligopeptiden und sind aus acht Aminosäure-Bausteinen aufgebaut. Die Bezeichnung „Aminosäure-Baustein“ kommt daher, dass die einzelnen Aminosäuren über Peptidbindungen miteinander verknüpft sind. Dabei erfolgt die Ausbildung einer solchen Bindung durch Wasserabspaltung zwischen der Aminogruppe einer Aminosäure und der Carboxygruppe einer anderen Aminosäure.
Wie der Großteil der Peptide kommen auch die Octapeptide zu einem großen Teil in Organismen vor, in denen sie wichtige Funktionen haben. Des Weiteren sind viele Octapeptide pharmakologisch aktiv. Zu diesem Zweck werden auch viele dieser Verbindungen synthetisch hergestellt.
Lineare Octapeptide
Sind Octapeptide linear aufgebaut, sind die Aminosäure-Bausteine in einer Kette über sieben Peptidbindungen miteinander verknüpft.
Adrenorphin
Adrenorphin ist auch unter dem Namen Metorphamid bekannt und zählt zu den Opioidpeptiden. 1983 wurde es von einer japanischen Forschergruppe um Kensaku Mizuno (* 1952)[1] erstmals aus einem menschlichen Phäochromozytom-Tumor des Nebennierenmarks sowie von einer Gruppe mit dem US-Amerikaner Christopher J. Evans (* 1954)[2] aus dem Gehirn eines Rindes erhalten.[3][4] Es ist das erste Peptid, das mit einem amidierten C-Terminus in Säugetieren gefunden wurde. Proenkephalin A bildet den Vorläuferstoff dieses Peptids.[3] Adrenorphin bindet an μ- und κ-Opioid-Rezeptoren.[4]
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
.svg.png.webp) Adrenorphin |
 |
Angiotensin II
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 .svg.png.webp) |
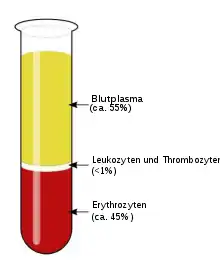 Angiotensin II wird im Blutplasma gebildet[6] |
Angiotensin II (früher: Hypertensin II)[7] ist ein Peptidhormon, das durch das Angiotensin-konvertierende Enzym aus Angiotensin I gebildet wird.[8] 1953 gelang es einer Gruppe um den US-amerikanischen Biochemiker Leonard T. Skeggs (1918–2002)[9] zu zeigen, dass dieses Octapeptid im Blutplasma gebildet wird.[6] Durch Angiotensin II wird der Blutdruck durch Vasokonstriktion sowie durch Verstärkung der Ausschüttung von Aldosteron in der Nebennierenrinde gesteigert. Zusätzlich zeigt Angiotensin II stimulierende Effekte auf die Glykogenolyse in der Leber, auf die Wiederaufnahme von Natrium-Ionen in der Niere, auf die Freisetzung von Vasopressin im Gehirn und auf die Freisetzung des Corticotropins in der Hypophyse.[10]
Cyclische Octapeptide
Durch die Ausbildung einer achten Peptidbindung kommt es zu einem Ringschluss, sodass die ringförmige Gestalt der Cyclopeptide entsteht. Dies ist ebenfalls durch weitere kovalente Bindungen möglich, wie bei Hymenistatin-I.
α-Amanitin
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 .svg.png.webp) |
 α-Amanitin kommt in den Knollenblätterpilzen vor, wie z. B. im Grünen Knollenblätterpilz Amanita phalloides[11][12] |
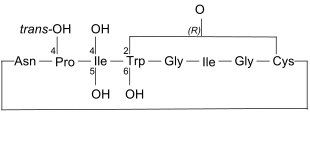
α-Amanitin gehört zu den Amatoxinen. Dies sind toxische, bicyclische Octapeptide, die z. B. in den Knollenblätterpilzen vorkommen.[11] Dieses Octapeptid ist das erste Peptid der Amatoxine, das 1941 von einer Gruppe um den deutschen Chemiker Heinrich Wieland (1877–1957) aus dem Grünen Knollenblätterpilz Amanita phalloides isoliert wurde.[12] Es wurde zunächst nur Amanitin genannt. Erst als 1949 ein weiterer Amanitin-ähnlicher Giftstoff entdeckt wurde, kam es zu der Bezeichnung α-Amanitin.[13]
Für Wirkungsweise von α-Amanitin ist charakteristisch, dass es ein Inhibitor der RNA-Polymerase II ist.[14] Aufgrund dieser Eigenschaft soll es möglich sein, diesen Stoff in der Krebsbehandlung einzusetzen.[15]
Hymenistatin-I
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 .svg.png.webp) Hymenistatin-I |
Hymenistatin-I kommt im Hornkieselschwamm Hymeniacidon vor[16] |
Hymenistatin-I wurde 1989 von einem Team um den US-amerikanischen Chemiker George R. Pettit (* 1929)[17] aus Schwämmen der Gattung Hymeniacidon isoliert, die der Klasse der Hornkieselschwämme angehören.[16] Ähnlich wie Ciclosporin unterbindet dieses Octapeptid die humorale und zelluläre Immunantwort.[18]
Moroidin
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 .svg.png.webp) Moroidin |
 Moroidin kommt in den Brennhaaren der Brennnesselgewächse vor, wie z. B. in Dendrocnide moroides[19][20] |
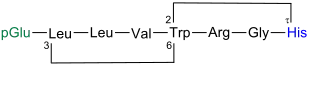
Moroidin ist ein bicyclisches Octapeptid, welches eine ungewöhnliche Brücke zwischen dem Nτ-Atom im Imidazol-Ring des Histidins und dem C2-Atom im Indol-Ring des Tryptophans aufweist. Zwischen dem C6-Atom desselben Ringes sowie dem C3-Atom im Rest des Leucins befindet sich die zweite Brücke.
Das Molekül ist in den Brennhaaren von Pflanzen der Familie der Brennnesselgewächse (z. B. in Laportea moroides und Dendrocnide moroides) enthalten, aus denen es 1985 durch eine Arbeitsgruppe um den britischen Biochemiker Dudley H.Williams (1937–2010)[21] isoliert wurde.[19][20] Es scheint für Schmerz, Rötung etc. bei Kontakt mit diesen Brennesselarten verantwortlich zu sein.[19][20] Weiterhin wurde herausgefunden, dass Moroidin die Tubulin-Polymerisation unterbindet und somit als neue Klasse der Mikrotubuli-Inhibitoren vorgeschlagen wird.[22]
Octreotid
| Aminosäurensequenz nach IUB/IUPAC[5] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
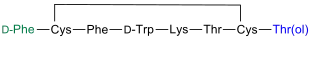 .svg.png.webp) |
Octreotid ist ein synthetisches Somatostatin-Analogon und auch unter dem Namen Sandostatin® bekannt. Es wurde erstmals 1982 von einer Arbeitsgruppe des Pharmakonzerns Sandoz in der Schweiz synthetisiert.[23] An der Struktur des Octapeptids ist auffällig, dass die Aminosäure Threonin zu einem stickstoffhaltigen Alkohol, Threoninol[24], reduziert wurde.[25]
Das Octapeptid ist pharmakologisch aktiv und hemmt unter anderem die Ausschüttung von dem Wachstumshormon Somatropin.[26] Es wird z. B. in der symptomatischen Therapie von gastroenteropankreatischen Tumoren, wie Karzinoiden, Vipomen und Glucagonomen eingesetzt.[27] Es hat sich gezeigt, dass subkutan verabreichtes Octreotid gegen Cluster-Kopfschmerzen wirksam ist.[28] Da Octreotid die innere Sekretion von gastrointestinaler Peptidhormonen (z. B. Cholezystokinin) hemmt, sind Nebenwirkungen wie Gallenstein-Bildung möglich.[28]
Einzelnachweise
- Tohuku University: 'Researchs Information: Kensaku Mizuno.' 17. März 2017, abgerufen am: 3. Juli 2017.
- Die Information zum Geburtsjahr stammt von Herrn Evans persönlich (E-Mail-Kontakt am 3. Juli 2017)
- H. Matsuo, A. Miyata, K. Mizuno: Novel C-terminally amidated opioid peptide in human phaeochromocytoma tumour. In: Nature. Band 35, 1983, S. 721–723. doi:10.1038/305721a0.
- E. Weber, F. S. Esch, P. Böhlen, S. Paterson, A. D. Corbett, A. T. McKnight, H. W. Kosterlitz, J. D. Barchas, C. J. Evans: Metorphamide: isolation, structure, and biologic activity of an amidated opioid octapeptide from bovine brain. In: Proceedings of the National Academy of Science of the United States. Band 80, Nr. 23, 1983, S. 7362–7366. doi:10.1073/pnas.80.23.7362.
- G. D. Fassman (Hrsg.): Handbook of Biochemistry an Molecular Biology. (= Proteins. Volume I). 3. Auflage. CRC Press, Cleveland 1976, ISBN 0-87819-504-1, S. 1–108.
- L. T. Skeggs, W. H. Marsh, J. R. Kahn, N. P. Shumway: The existence of two forms of Hypertensin. In: Journal of Experimental Medicine. Band 99, Nr. 3, 1954, PMC 2136205 (freier Volltext).
- E. Braun-Menendez, I. H. Page: Suggested Revision of Nomenclature – Angiotensin. In: Science. Band 127, Nr. 3292, S. 242. doi:10.1126/science.127.3292.242-a.
- L. T. Skeggs, J. R. Kahn, N. P. Shumway: The Preparation and Function of the Hypertensin-Converting Enzyme. In: Journal of Experimental Medicine. Band 103, Nr. 3, 1956, S. 295–299. doi:10.1084/jem.103.3.295.
- Case Western Reserve University: In Memoriam: Skeggs worked on artificial kidney In: Campus News. 2. Dezember 2004, abgerufen am: 29. Juni 2017.
- H.-D. Jakubke: Peptide. Spektrum Akademischer Verlag, Heidelberg/ Berlin/ Oxford 1996, ISBN 3-8274-0000-7, S. 323.
- T. Wieland: Struktur und Wirkung der Amatoxine. In: Die Naturwissenschaften. Band 59, Nr. 6, 1972, S. 225–231. doi:10.1007/BF00610196.
- H. Wieland, R. Hallermeyer, W. Zilg: Über die Gifte des Knollenblätterpilzes. VI: Amanitin, das Hauptgift des Knollenblätterpilzes. In: Justus Liebigs Annalen der Chemie. Band 548, Nr. 1, 1941, S. 1–18. doi:10.1002/jlac.19415480102.
- Th. Wieland, L. Wirth, E. Fischer: Über die Giftstoffe des Knollenblätterpilzes VII. β-Amanitin, eine dritte Komponente des Knollenblätterpilzgiftes. In: Justus Liebigs Annalen der Chemie. Band 564, Nr. 2, 1949, S. 152–160. doi:10.1002/jlac.19495640208
- H. Faulstich, T. Weiland, L. Fiume: Amatoxins, Phallotoxins, Phallolysin, and Antamanide: The Biologically Active Components of Poisonous Amanita Mushroom. In: CRC Critical Reviews in Biochemistry. Band 5, Nr. 3, 1978, S. 185–260, doi:10.3109/10409237809149870.
- I. Riede: Switch the Tumor Off: From Genes to Amanita Therapy. In: American Journal of Biomedical Research. Band 1, Nr. 4, 2013, S. 93–107. doi:10.12691/ajbr-1-4-5.
- G. R. Pettit, P. J. Clewlow, C. Dufresne, D. L. Doubek, R. L. Cerny, K. Rützler: Antineoplastic Agents. 193. Isolation and Structure of the Cyclic Peptide Hymenistatin 1. In: Canadian Journal of Chemistry. Band 68, Nr. 5, 1990, S. 708–711. doi:10.1139/v90-110.
- R. S. Byars: Waging War on Cancer – Dr. Pettit's Lifelong Quest to Find Cures. Friesenpress, Victoria 2015, ISBN 978-1-4602-5976-4, S. 1ff.
- M. Cebrat, Z. Wieczorek, I. Z. Siemion: Immunosuppressive Activity of Hymenistatin I. In: Peptides. Band 17, Nr. 2, 1996, S. 191–196. doi:10.1016/0196-9781(95)02123-X.
- C. Leung, D. H. Williams, J. C. J. Barna, S. Foti, P. B. Oelrichs: Structural Studies on the Peptide Moroidin from Laportea Moroides. In: Tetrahedron. Band 42, Nr. 12, 1986, S. 3333–3348. doi:10.1016/S0040-4020(01)87397-X.
- P. B. Oelrichs, D. H. Williams: Two Naturrally Occurring Toxins Causing Stock Lossed. In: D. Watters, M. Lavin, D. Maguire, J. Pearn (Hrsg.): Toxins and Targets – Effects of Natural and Synthetic Poisons on Living Cells and Fragile Ecosystems. Harwood Academic Publishers, Chur 1992, ISBN 3-7186-5194-7, S. 119–120. (eingeschränkte Vorschau in der Google-Buchsuche)
- D. J. Daley: Professor Dudley H. Williams ScD, FRS 1937–2010. In: Rapid Communications in Mass Spectrometry. Band 25, Nr. 8, 2011, S. 117–118. doi:10.1002/rcm.4964.
- H. Morita, K. Shimbo, H. Shigemori, J. Kobayashi: Antimiotic Activity of Moroidin, a Bicyclic Peptide from the Seed of Celosia argentea. In: Bioorganic & Medicinal Chemistry Letters. Band 10, Nr. 5, 2000, S. 469–471. doi:10.1016/S0960-894X(00)00029-9.
- W. Bauer, U. Briner, W. Doepfner, R. Haller, R. Huguenin, P. Marbach, T. J. Petcher, J. Pless: SMS 201–995: A very potent and selective octapeptide analogue of somatostatin with prolonged action. In: Life Sciences. Band 31, Nr. 11, 1982, S. 1133–1140. doi:10.1016/0024-3205(82)90087-X.
- Eintrag zu Threoninol in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 18. November 2019.
- IUPAC & IUB Joint Commission on Biochemical Nomenclature (Hrsg.): Nomenclature and Symbolism for Amino Acids and Peptides (Recommendations 1983). In: Pure and Applied Chemistry. Band 56, Nr. 5, 1984, S. 605. doi:pac198456050595.
- Lüllmann, H.; Mohr, K.; Wehling, M.: Pharmakologie und Toxikologie: Arzneimittel verstehen – Medikamente gezielt einsetzen. 15. Auflage, Georg Thieme Verlag, Stuttgart, 2003, ISBN 3-13-368515-5, S. 356.
- S. Herzig, H. Mönig: Der Arzneistoff – Octreotid. In: Deutsche Medizinische Wochenschrift. Band 120, Nr. 30, 1995, S. 1051–1052.
- M. S. Matharu, M. J. Levy, K. Meera, J. Goadsby: Subcutaneous Octreotide in Cluster Headache: Randomized Placebo-Controlled Double-Blind Crossover Study. In: Annals of Neurology. Band 56, Nr. 4, 2004, S. 488–494. doi:10.1002/ana.20210.