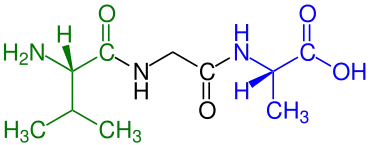Tripeptide
Tripeptide sind aus drei Aminosäure-Resten aufgebaute Peptide und zählen zur Gruppe der Oligopeptide. Wie andere Oligopeptide besitzen Tripeptide häufig eine sehr spezifische physiologische Wirkung, z. B. in der Neurochemie, im Stoffwechsel und als Releasing-Hormone.[2] Proteine werden im Zuge der Verdauung durch Peptidasen in Aminosäuren, Dipeptide und Tripeptide zerlegt.[3] Tripeptide werden im Dünndarm und der Niere über den Peptidtransporter 1 aufgenommen.[4] Tripeptidyl-Peptidasen sind Peptidasen, die Tripeptide abspalten.
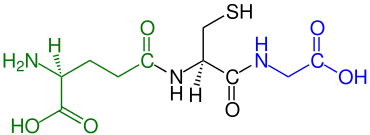
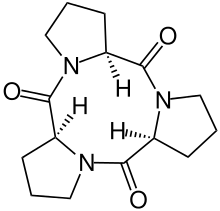
Beispiele
Beispiele für natürlich vorkommende Tripeptide sind unter anderem die Antioxidantien Glutathion, die Ophthalminsäure, den Proteaseinhibitor Leupeptin, das Melanotropin-Release-Inhibiting-Hormon, die Lactotripeptide, GHK-Cu und das Herbizid Bialaphos. Einige natürliche Tripeptide besitzen ein Amid am C-Terminus, wie Thyreoliberin und der Melanocyte-inhibiting factor. Die Peptidalkaloide unter den Mutterkornalkaloiden enthalten unter anderem ein Tripeptid. Ein nichtribosomal erzeugtes Peptid ist das ACV-Tripeptid. Synthetische Tripeptide sind die ACE-Hemmer Lisinopril, Enalapril und Ramipril sowie neuroprotektive Analoga des Thyreoliberins.[5]
Literatur
- S. Santos, I. Torcato, M. A. Castanho: Biomedical applications of dipeptides and tripeptides. In: Biopolymers. Band 98, Nummer 4, 2012, S. 288–293, PMID 23193593.
Siehe auch
- Dipeptide
- Tetrapeptide
- Pentapeptide
- Decapeptide
Einzelnachweise
- M. Rothe, K.-D. Steffen, I. Rothe: Synthese von Cyclo-tri-L-prolyl, einem Cyclo-tri-peptid mit neungliedrigem Ring, Angewandte Chemie 77, 1965, S. 347–348.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 6: T–Z. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1988, ISBN 3-440-04516-1, S. 4360.
- G. Wu: Dietary protein intake and human health. In: Food & function. Band 7, Nummer 3, März 2016, S. 1251–1265, doi:10.1039/c5fo01530h, PMID 26797090.
- T. Terada, K. Inui: Recent advances in structural biology of peptide transporters. In: Current topics in membranes. Band 70, 2012, S. 257–274, doi:10.1016/B978-0-12-394316-3.00008-9, PMID 23177989.
- A. I. Faden, S. M. Knoblach, V. A. Movsesyan, P. M. Lea, I. Cernak: Novel neuroprotective tripeptides and dipeptides. In: Annals of the New York Academy of Sciences. Band 1053, August 2005, S. 472–481, doi:10.1196/annals.1344.041, PMID 16179555.