Heptapeptide
Heptapeptide sind Oligopeptide, die aus sieben Aminosäure-Bausteinen aufgebaut sind. Die Bezeichnung „Aminosäure-Baustein“ kommt daher, dass die einzelnen Aminosäuren über Peptidbindungen miteinander verknüpft sind. Dabei erfolgt die Ausbildung einer solchen Bindung durch Wasserabspaltung zwischen der Aminogruppe einer Aminosäure und der Carboxygruppe einer anderen Aminosäure.
Wie die meisten Peptide, übernimmt auch die Mehrheit der Heptapeptide eine wichtige Rolle im Organismus eines Lebewesens und/oder ist pharmakologisch aktiv.
Lineare Heptapeptide
Heptapeptide sind linear aufgebaut, wenn die Aminosäure-Bausteine über sechs Peptidbindungen in einer Kette miteinander verknüpft sind.
β-Casomorphin-7
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 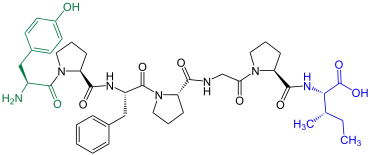 β-Casomorphin-7 |
 Braunvieh β-Casomorphin-7 ist im Casein-Pepton von Rindern enthalten[2] |
β-Casomorphin-7 wurde 1979 von einer Gruppe um den deutschen Mediziner Hansjörg Teschemacher (* 1938)[3] aus Rindercasein-Pepton isoliert.[2] Dieses Peptid zählt zu den Opioidpeptiden und lässt sich nicht durch das Enzym Pronase spalten, was eine Besonderheit darstellt.[2]
Deltorphin-I und Deltorphin-II
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen | |
  Deltorphin-I |
  Deltorphin-II |
 Phyllomedusa bicolor Die Deltorphine sind in der Haut des Frosches Phyllomedusa bicolor enthalten[4] |
Deltorphin-I enthält den Aminosäure-Baustein der Asparaginsäure und Deltorphin-II den der Glutaminsäure. 1989 wurden sie von einer Gruppe um den italienischen Pharmakologen Vittorio Erspamer (1909–1999) aus der Haut des Frosches Phyllomedusa bicolor extrahiert. Sie gehören zu den Opioidpeptiden und binden selektiv an die δ-Opioid-Rezeptoren.[4]
Dermorphin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 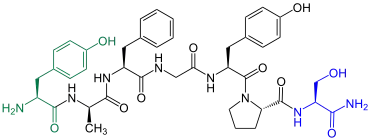 |
 Phyllomedusa sauvagei Dermorphin ist in der Haut des Frosches Phyllomedusa sauvagei enthalten[5] |
Demorphin gehört zu den Opioidpeptiden. Es wurde 1980 durch eine Gruppe um den Italiener Pier Carlo Montecucchi erstmals aus der Haut des Frosches Phyllomedusa sauvagei extrahiert.[5]
Im Gegensatz zu Deltorphin-I und Deltorphin-II bindet Demorphin selektiv an die μ-Opioid-Rezeptoren.[4]
Wwamid-1
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
  Wwamid-1 |
.jpg.webp) Achatine fulica Wwamid-1 ist in den Ganglien der afrikanischen Schnecke Achatina fulica enthalten[6] |
Wwamid-1 wurde 1993 von einer japanischen Gruppe um Hiroyuki Minakata (* 1956)[7] aus den Ganglien der afrikanischen Schnecke Achatina fulica extrahiert.[6] Dieses Neuropeptid ist ein Inhibitor eines zentralen Neurons der Schnecke. Außerdem zeigt es im peripheren Nervensystem von verschiedenen Weichtieren modellierende Effekte, d. h., es hemmt oder fördert Muskelkontraktionen. Dabei ist noch nicht klar, was geschieht. Für die Kontrolle von Muskelkontraktionen könnte es wichtig sein.[6]
Cyclische Heptapeptide
Unter cyclischen Heptapeptiden werden Heptapeptide mit einer ringförmigen Gestalt verstanden. Zu dieser Form kommt es, wenn eine siebte Peptidbindung ausgebildet wird. Ein solcher Ringschluss ist auch durch Ausbildung anderer kovalenter Bindungen möglich. Dies ist z. B. bei Viroisin der Fall.
Phalloidin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
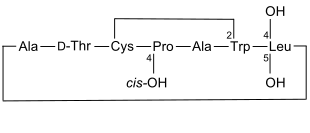 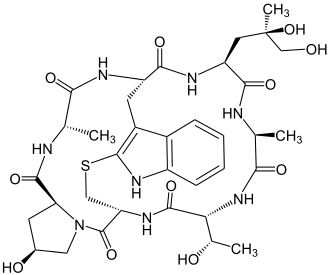 |
 Grüner Knollenblätterpilz Phalloidin kommt im Pilz Amanita phalloides vor, dem Grünen Knollenblätterpilz[8] |
Phalloidin ist ein bicyclisches Heptapeptid und gehört zu den Phallotoxinen. Dies ist eine Gruppe von Toxinen, die im Grünen Knollenblätterpilz (Amanita phalloides) gefunden wurden.[9][8] 1937 gelang es den beiden Deutschen Feodor Lynen (1911–1979) und Ulrich Wieland (1911–2003)[10] das toxische Peptid in kristalliner Form aus diesem Pilz zu isolieren.[11]
Für die Wirkungsweise dieses Heptapeptids ist charakteristisch, dass Leberzellmembranen so verändert werden, dass sich Ausstülpungen bilden und Blut aufgenommen wird.[12] Dies ist darauf zurückzuführen, dass Phalloidin die Depolymerisation von filamentösem F-Aktin zu monomeren G-Aktinen, also den Abbau von Mikrofilamenten, hemmt.[13][14]
Viroisin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 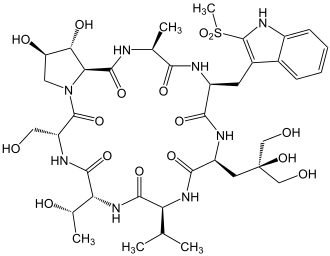 Viroisin |
 Amanita virosa Viroisin kommt in Europa in dem Pilz Amanita virosa vor[15][16] |
Viroisin gehört zu den Virotoxinen. Dies sind monocyclische, toxische Heptapeptide, die in den Knollenblätterpilzen vorkommen. In Europa scheint diese Gruppe von toxischen Peptiden nur in der Pilzart Amanita virosa enthalten zu sein.[15][16] 1980 gelang es Heinz Faulstich und Kollegen, Viroisin aus diesem Pilz zu isolieren.[15]
Die Wirkungsweise von Viroisin ist der von Phalloidin sehr ähnlich. Wie Phalloidin unterbindet auch Viroisin die Depolymerisation von filamentösen F-Aktinen, sodass es hier ebenfalls zur Aufnahme von Blut in die Leber kommt.[15]
Bei Viroisin scheint es so, dass dieses Peptid erst in der aktiven Konformation vorliegt, wenn es nach dem Induced fit-Mechanismus an Aktin gebunden ist.[15]
Einzelnachweise
- G. D. Fassman (Hrsg.): Handbook of Biochemistry an Molecular Biology. (= Proteins. Volume I). 3. Auflage. CRC Press, Cleveland 1976, ISBN 0-87819-504-1, S. 1–108.
- V. Brantl, H. Teschemacher, A. Henschen, F. Lottspeich: Novel Opioid Peptides Derived from Casein (β-Casomorphins). II. Structure of Active Components from Bovine Casein Peptone. In: Hoppe-Seyler's Zeitschrift für Physiologische Chemie. Band 360, Nr. 9, 1979, S. 1217–1224, doi:10.1515/bchm2.1979.360.2.1211.
- Rudolf Buchhein Institut für Pharmakologie: Geschichte des Rudolf-Buchheim Instituts für Pharmakologie – Erstes Pharmakologisches Institut. 27. September 2007, abgerufen am: 3. Juli 2017.
- V. Erspamer, P. Melchiorri, G. Falconieri-Erspamer, L. Negri, R. Corsi, C. Severini, D. Barra, M. Simmaco, G. Kreil: Deltorphins: A Family of Naturally Occurring Peptides With High Affinity and Selectivity for Delta Opioid Binding Sites. In: Proceedings of the National Academy of Sciences USA. Band 86, Nr. 13, 1989, S. 5188–5192, doi:10.1073/pnas.86.13.5188.
- P. C. Montecucchi, R. de Castiglione, S. Piani, L. Gozzini, V. Erspamer: Amino acid composition and sequence of dermorphin,a novel opiate-like peptide from the skin of PhylIomedusa sauvagei. In: International Journal of Peptide and Protein Research. Band 17, Nr. 3, 1981, S. 275–283, doi:10.1111/j.1399-3011.1981.tb01993.x.
- H. Minakata, T. Ikeda, Y. Muneoka, M. Kobayashi, K. Nomoto: WWamide-1, -2 and -3: novel neuromodulatory peptides isolated from ganglia of the African giant snail, Achatina fulica. In: FEBS letters. Band 323, Nr. 1–2, 1993, S. 104–108, doi:10.1016/0014-5793(93)81458-C.
- Die Information zum Geburtsjahr stammt von Hiroyuki Minakata persönlich (E-Mail-Kontakt am 7. Juli 2017).
- T. Wieland, H. W. Schnabel: Über die Giftstoffe des Grünen Knollenblätterpilzes–Neue Sequenzanalyse von Phalloidin und Phalloin. In: Justus Liebigs Annalen der Chemie. Band 657, Nr. 1, 1962, S. 225–228, doi:10.1002/jlac.19626570128.
- R. Hänsel, E. Steinegger: Pharmakognosie und Phytopharmazie. 4. Auflage. Springer-Verlag, Berlin/ Heidelberg 1988, ISBN 3-662-08319-1, S. 475, eingeschränkte Vorschau in der Google-Buchsuche.
- Verein für Computergenealogie: Grabstein der Familie Wieland. 2013, abgerufen am: 6. Juli 2017.
- F. Lynen, U. Wieland: Über die Giftstoffe des Knollenblätterpilzes. VI. In: Justus Liebigs Annalen der Chemie. Band 533, Nr. 1, 1937, S. 93–117, doi:10.1002/jlac.19385330105.
- A. Bresinsky, H. Besl: Giftpilze–Ein Handbuch für Apotheker, Ärzte und Biologen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1985, ISBN 3-8047-0680-0, S. 23–24.
- T. Wieland: Amatoxine, Phallotoxine – die Gifte des Knollenblätterpilzes. In: Chemie in unserer Zeit. Band 13, Nr. 2, 1979, S. 56–63, doi:10.1002/ciuz.19790130205
- J. Rassow, K. Hauser, R. Netzker, R. Deutzmann: Biochemie. 3. Auflage. Georg Thieme Verlag, Stuttgart 2012, ISBN 978-3-13-125353-8, S. 376ff.
- H. Faulstich, A. Buku, H. Bodenmüller, T. Wieland: Virotoxins: actin-binding cyclic peptides of Amanita virosa mushrooms. In: Biochemistry. Band 19, Nr. 14, 1980, S. 3334–3343, doi:10.1021/bi00555a036.
- A. Bresinsky, H. Besl: Giftpilze–Ein Handbuch für Apotheker, Ärzte und Biologen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1985, ISBN 3-8047-0680-0, S. 19–21.