Hexapeptide
Hexapeptide sind Oligopeptide, die aus sechs Aminosäure-Bausteinen aufgebaut sind. Die Bezeichnung „Aminosäure-Baustein“ kommt daher, dass die einzelnen Aminosäuren über Peptidbindungen miteinander verknüpft sind. Dabei erfolgt die Ausbildung einer solchen Bindung durch Wasserabspaltung zwischen der Aminogruppe einer Aminosäure und der Carboxygruppe einer anderen Aminosäure.
Wie die meisten Peptide, übernimmt auch die Mehrheit der Hexapeptide eine wichtige Rolle im Organismus eines Lebewesens und/oder ist pharmakologisch aktiv.
Lineare Hexapeptide
Unter linearen Hexapeptiden werden Hexapeptide verstanden, bei denen die Aminosäuren-Bausteine über fünf Peptidbindungen in einer Kette miteinander verknüpft sind.
Argireline
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
  Argireline |
Argireline wird auch Acetylhexapeptid-8 oder Acetylhexapeptid-3 genannt.[2] Es ist ein synthetisches Hexapeptid mit einer Acetylgruppe am N-Terminus sowie einer Aminogruppe am C-Terminus, das 2002 von einer Gruppe um den spanischen Chemiker Antonio Ferrer-Montiel (* 1962)[3] hergestellt wurde.[4] Dieses Peptid hemmt die Neurotransmitterfreisetzung, so wie Botox. Aus diesem Grund wird es zur Minderung von Mimikfalten eingesetzt.[4] Dazu wird Argireline über eine Creme, die nichtinvasiv und nichttoxisch ist, auf die Haut aufgetragen. Der Vorteil gegenüber Botox ist dabei, dass Argireline für diejenigen geeignet ist, die unter neuromuskulären oder Autoimmunkrankheiten leiden oder eine Botox-Intoleranz aufweisen. Allerdings ist die Wirkung von Argireline nicht mit der von Botox vergleichbar.[5][6]
Calpinactam
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 Calpinactam |
Calpinactam kommt im Pilz Mortierella alpina vor[7] |
Calpinactam wurde 2009 von einer Gruppe um den Japaner Hiroshi Tomoda (* 1955)[8] aus dem Pilz Mortierella alpina isoliert.[7] An der Struktur dieses Hexapeptids ist besonders, dass der C-Terminus von α-Amino-ε-caprolactam gebildet wird, welches aus Lysin gewonnen werden kann.[7]
Das Peptid ist gegen die Bakterienarten Mycobacterium smegmatis und Mycobacterium tuberculosis wirksam.[7][9]
GHRP-6
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
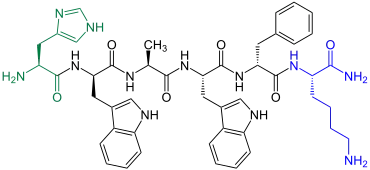 GHRP-6 |
GHRP-6 ist die englische Abkürzung für Growth Hormone-Releasing Peptide-6 und bedeutet übersetzt „Wachstumshormon freisetzendes Hexapeptid“. Es ist damit ein Wachstumshormon-Sekretagogum und verbessert zusätzlich die Gewebe-Viabilität verschiedener Organe.[10] GHRP-6 ist ein synthetisches Peptid, das 1983 erstmals durch eine Gruppe um den US-Amerikaner Cyril Y. Bowers hergestellt wurde.[11]
Neuromedin N
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
 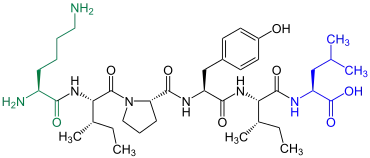 Neuromedin N |
 Neuromedin N ist im Rückenmark von Schweinen enthalten[12] |
Neuromedin N ist ein Neuropeptid mit ähnlicher Wirkung wie Neurotensin.[13] 1984 wurde es von einer Gruppe um den Japaner Naoto Minamino (* 1953)[14] erstmals aus dem Rückenmark von Schweinen isoliert.[12]
Cyclische Hexapeptide
Cyclische Hexapeptide sind Hexapeptide mit einer ringförmigen Gestalt. Im Gegensatz zu den linearen Hexapeptiden, kommt es durch Ausbildung einer sechsten Peptidbindung zu einem Ringschluss. Dieser kann auch erfolgen, wenn eine andere kovalente Bindung vorliegt.
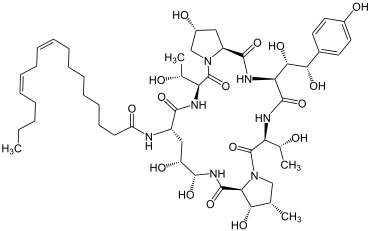
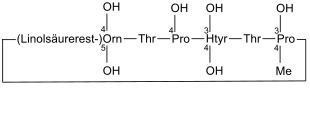
Echinocandin B
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
|
 Echinocandin B kommt im Schimmelpilz Aspergillus nidulans vor[15] |
Echinocandin B ist ein Antimykotikum. Es wurde 1974 durch die Schweizer Firma CIBA-GEIGY aus dem Schimmelpilz Aspergillus nidulans isoliert.[15]
Dieses Peptid hemmt die Synthese von β-(1,3)-D-Glucan, einem wichtigen Bestandteil der Zellwände von Pilzen, sodass es eine antifungische Wirkung aufweist (z. B. gegen Candida albicans).[16]
An der Struktur von Echinocandin B ist besonders, dass dieses Peptid Linolsäure enthält, wodurch es zur Hämolyse kommen soll.[17] Um zu überprüfen, ob es weitere Peptide gibt, die die Synthese von β-(1,3)-D-Glucan ebenfalls unterbinden und effizienter sind, wurde nach weiteren natürlich vorkommenden Peptiden gesucht und Analoga dieser hergestellt.[18] Dazu gehört z. B. Caspofungin.
Bouvardin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
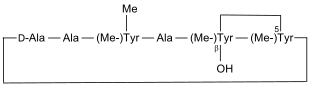 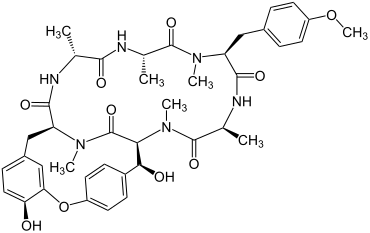 Bouvardin |
 Bouvardin ist in der Pflanze Bouvardia ternifolia (Rubicae) enthalten[19] |
Bouvardin wurde 1977 von einer Forschergruppe um den US-Amerikaner Jack R. Cole (* 1929)[20] aus der Pflanze Bouvardia ternifolia (Rubicae) isoliert.[19] Dieses Peptid zeigt Anti-Tumor-Aktivität gegen lymphatische Leukämie und gegen das maligne Melanom, indem es insbesondere die Protein-Synthese hemmt.[19][21][22]
Literatur
- E. Boschetti, P. Giorgio Righetti: Hexapeptide combinatorial ligand libraries: the march for the detection of the low-abundance proteome continues. In: BioTechniques. Band 44, Nummer 5, April 2008, S. 663–665, doi:10.2144/000112762. PMID 18474042.
- A. Fröhlich, C. Lindermayr: Deep insights into the plant proteome by pretreatment with combinatorial hexapeptide ligand libraries. In: Journal of Proteomics. Band 74, Nummer 8, August 2011, S. 1182–1189, doi:10.1016/j.jprot.2011.02.019. PMID 21354349.
Einzelnachweise
- G. D. Fassman (Hrsg.): Handbook of Biochemistry an Molecular Biology. Teil A: Proteins. Volume I, 3. Auflage, CRC Press, Cleveland 1976, ISBN 0-87819-504-1, S. 1–108.
- F. Gorouhi, H. I. Maibach: Review Article–Role of topical peptides in preventing or treatingaged skin. In: International Journal of Cosmetic Science. Band 31, 2009, S. 327–345, doi:10.1111/j.1468-2494.2009.00490.x.
- J. Villalaín Boullón: Translational Biophysics – A conversation with Antonio Ferrer-Montiel. In: Biofisica Magazine. Band 6, 2016, S. 11–15, Online Version, abgerufen am 13. Juli 2017.
- C. Blanes-Mira, J. Clementy, G. Jodasy, A. Gil, G. Fernandez-Ballester, B. Ponsatiy, L. Gutierrez, E. Perez-Paya, A. Ferrer-Montie: A synthetic hexapeptide (Argireline) withantiwrinkle activity. In: International Journal of Cosmetic Science. Band 24, 2002, S. 303–310, doi:10.1046/j.1467-2494.2002.00153.x.
- Raja K Sivamani: Cosmeceuticals and Active Cosmetics. 3. Auflage. CRC Press, 2016, ISBN 978-1-4987-8246-3.
- Grosse Versprechen, aber wenig Fakten zum Wirkstoff Argireline: Die «sanfte Alternative» zu Botox gibt es noch nicht. auf: nzz.ch, abgerufen am 17. Mai 2017.
- N. Koyama, S. Kojima, T. Fukuda, T. Nagamitsu, T. Yasuhara, S. Omura, H. Tomoda: Structure and Total Synthesis of Fungal Calpinactam, A New Antimycobacterial Agent. In: Organic Letters. Band 12, Nr. 3, 2010, S. 432–435, doi:10.1021/ol902553z.
- Prabook: Profil von Hiroshi Tomoda. abgerufen am: 13. Juli 2017.
- N. Koyama, S. Kojima, K. Nonaka, R. Masuma, M. Matsumoto, S. Omura, H. Tomoda: Calpinactam, a new anti-mycobacterial agent, produced by Mortierella alpina FKI-4905. In: The Journal of Antibiotics. Band 63, 2010, S. 183–186, doi:10.1038/ja.2010.14.
- A. Cabralesa, J. Gilb, E. Fernándezc, C. Valenzuelad, F. Hernándezd, I. Garcíad, A. Hernández, V. Besadab, O. Reyesa, G. Padrónb, J. Berlangae, G. Guillénf, L. J. González: Pharmacokinetic study of Growth Hormone-Releasing Peptide 6 (GHRP-6) in nine male healthy volunteers. In: European Journal of Pharmaceutical Sciences. Band 48, Nr. 1–2, S. 40–46, doi:10.1016/j.ejps.2012.10.006.
- F. A. Momany, C. Y. Bowers, G. A. Reynolds, A. Hong, K. Newlander: Conformational Energy Studies and in Vitro and in VivoActivity Data on Growth Hormone-Releasing Peptides. In: Endocrinology. Band 114, Nr. 5, 1984, S. 1531–1536, doi:10.1210/endo-114-5-1531.
- N. Minamino, K. Kangawa, H. Matsuo: Neuromedin N: A novel neurotensin-like peptide identified in porcine spinal cord. In: Biochemical and Biophysical Research Communications. Band 122, Nr. 2, 1984, S. 542–549, doi:10.1016/S0006-291X(84)80067-4.
- J. Falbe, M. Regitz (Hrsg.): Römpp Lexikon Chemie. Georg Thieme Verlag, Stuttgart 1998, ISBN 3-13-734910-9, S. 2876.
- Die Information zum Geburtsjahr stammt von Naoto Minamino persönlich (E-Mail-Kontakt am 14. Juli 2017)
- F. Benz, F. Knüsel, J. Nüesch, H. Treichler, W. Voser, R. Nyfeler, W. Keller-Schierlein: 267. Stoffwechselprodukte von Mikroorganismen – 143. Mitteilung – Echinocandin B , ein neuartiges Polypeptid-Antibioticum aus Aspergillus nidulans var. echinulatus: Isolierung und Bausteine. In: Helvetica Chimica Acta. Band 57, Nr. 8, 1974, S. 2459–2477, doi:10.1002/hlca.19740570818.
- M. B. Kurtz, C. M. Douglas: Lipopeptide inhibitors of fungal glucan synthase. In: Journal of Medical & Veterinary Mycology. Band 35, Nr. 2, 1997, S. 79–86, doi:10.1080/02681219780000961.
- L. L. Klein, L. Li: Design and Preparation of Cyclopeptamine Antifungal Agents. In: Current Pharmaceutical Design. Band 5, Nr. 2, 1999, S. 57–71, eingeschränkte Vorschau in der Google-Buchsuche.
- G. Erkel: Non-β-Lactam Antibiotics. In: K. Esser, M. Hofrichter (Hrsg.): The Mycota – Industrial Applications X. 2. Auflage. Springer Verlag, Berlin/ Heidelberg 2010, ISBN 978-3-642-11457-1, S. 125f. eingeschränkte Vorschau in der Google-Buchsuche.
- S. D. Jolad, J. J. Hoffman, S. J. Torrance, R. M. Wiedhopf, J. R. Cole, S. K. Arora, R. B. Bates, R. L. Gargiulo, G. R. Kriek: Bouvardin and Deoxybouvardin, Antitumor Cyclic Hexapeptides from Bouvardia ternifolia (Rubiaceae). In: Journal of the American Chemical Society. Band 99, Nr. 24, 1977, S. 8040–8044, doi:10.1021/ja00466a043.
- Jaques Cattell Press (Hrsg.): 2. C–F. In: American Men & Women of Science. Physical and Biological Sciences. 16. Auflage. R. R. Bowker Company. New York 1986, ISBN 0-8352-2223-3, S. 307.
- M. P. Chitnis, A. D. Alate, R. S. Menon: Effect of Bouvardin (NSC 259968) on the Growth Characteristics and Nucleic Acids and Protein Syntheses Profiles of P388 Leukemia Cells. In: Chemotherapy. Band 27, Nr. 2, 1981, S. 126–130, doi:10.1159/000237967.
- R. K. Johnson, M. P. Chitnis: Antineoplastic and Biochemical Effects in Murine Tumors of Bouvardin, A Cyclic Hexapeptide from Bouvardia terniflora. In: Proceedings of the American Association for Cancer Research and American Society of Clinical Oncology. Nr. 19, 1978, S. 218.