Mammographie
Mammographie bzw. -grafie ist eine Methode zur Früherkennung von Brustkrebs (Mammakarzinom), der in den meisten Ländern häufigsten Krebserkrankung der Frau. Die Mammographie ist in erster Linie ein Verfahren der Radiologie zur Diagnostik der weiblichen, gegebenenfalls aber auch der männlichen Brust, und wird als Synonym für die Röntgenmammographie verwendet. Alternative bildgebende Verfahren sind die Mammasonographie, die Tomosynthese, die Magnetresonanz-Mammographie sowie die Brust-Computertomographie (Mamma-Computertomographie).

Die weltweit erste klinische Mammographie fertigte der Chirurg Otto Kleinschmidt 1927 am Leipziger Uniklinikum an.[1][2] Ein weiterer Pionier war Ende der 1950er Jahre Robert Egan am University of Texas M.D. Anderson Cancer Center, der 1964 ein Buch über Mammographie veröffentlichte. Die Breitenanwendung der Mammographie setzte aber erst nach einer umfangreichen klinischen Studie in New York ein, die 1966 veröffentlicht wurde (Leiter Philip Strax).
Technik der Untersuchung
Klassische 2D-Mammographie
Die Untersuchung erfolgt an speziellen Röntgengeräten. Die angewendete Röntgenstrahlung ist eine weiche Strahlung mit einer Energie von ungefähr 25 bis 35 keV (Kiloelektronenvolt). In der Mammographie kommen praktisch kaum noch Film-Folien-Systeme, sondern hauptsächlich digitale Röntgengeräte zum Einsatz. Letztere teilen sich in Speicherfoliensysteme und Flachdetektorsysteme auf. Diese wiederum teilen sich auf in direkt digitale Detektoren, bei denen die Röntgenstrahlung direkt in ein elektrisches Signal umgewandelt wird und in indirekt digitale Detektoren, bei denen die Röntgenstrahlung erst in sichtbares Licht und dann in ein elektrisches Signal umgewandelt werden. Die Röntgenaufnahmen werden auf einer speziellen Mammographie-Befundstation betrachtet, welche sich im Wesentlichen durch zwei Graustufenmonitore mit jeweils 5 Megapixeln auszeichnet oder aber einen Graustufenmonitor mit mindestens 10 Megapixeln.
3D-Mammographie/Tomosynthese
Bei der klassischen 2D-Mammographie besteht das Problem, dass durch die Überlagerung verschiedener Gewebestrukturen mitunter krankhafte Veränderungen im Gewebe verdeckt werden, wodurch sie übersehen werden können. Dies versucht man auszugleichen, indem man aus zwei Winkeln die Brust aufnimmt, und zwar „craniocaudal“ und „mediolateral oblique“, d. h. einmal senkrecht und einmal im 45-Grad-Winkel. Dies hilft, löst das Problem jedoch nicht immer. Bei der Tomosynthese wird die Brust aus unterschiedlichen Winkeln aufgenommen, und zwar je nach Hersteller über einen Winkel von 15 bis 50 Grad (Röntgentomographie). Dabei werden zwischen 9 und 25 Aufnahmen mit niedriger Dosis und hoher Beschleunigungsspannung aufgenommen, sodass die Gesamtdosis in etwa der einer klassischen 2D-Aufnahme entspricht. Aus diesen Aufnahmen werden einzelne Schichten des Brustgewebes errechnet. Bei 1-mm-Schichten zum Beispiel werden für eine 5 cm dick komprimierte Brust 50 Schichten errechnet. Da nun die Schichten über und unter der jeweils zur Ansicht ausgewählten Schicht bei der Befundung ausgeblendet werden, sind Gewebeveränderungen leichter zu sehen. Da zur Befundung aber auch die konventionelle 2D-Aufnahme gebraucht wird, diese aber nicht zusätzlich zur Tomosynthese erstellt werden soll, da dann zusätzliche Röntgenstrahlung für die 2D-Aufnahme gebraucht wird (doppelte Dosis für einmal Tomosynthese und einmal 2D), wird bei einigen Herstellern inzwischen aus dem Datensatz der 3D-Tomosynhese auf ein 2D-Bild zurückgerechnet (synthetische 2D-Mammographie).
Die drei größten Studien zum Thema sind:
- Die Oslo-Studie.
- Die vierjährige prospektive Studie mit dem Titel „Two-View Digital Breast Tomosynthesis Screening with Synthetically Reconstructed Projection Images: Comparison with Digital Breast Tomosynthesis with Full-Field Digital Mammographic Images [Digitale Zwei-Ebenen-Tomosynthese bei Vorsorgeuntersuchungen der Brust mit synthetisch rekonstruierten Projektionsdarstellungen: Vergleich mit digitaler Brust-Tomosynthese mit digitalen Vollfeld-Mammografiebildern]“, die anhand von 24.901 Vorsorgeuntersuchungen in einem großen Krankenhaus in Norwegen durchgeführt wurde, evaluierte die Verwendung von 2D-Bildern aus 3D-Mammografieschichtbildern anstelle der konventionellen 2D-Bilder, die als Teil der digitalen Tomosynthese der Brust erforderlich sind. Per Skaane, Abteilung für Radiologie, Osloer Universitäts-Krankenhaus Ullevaal, und seine Kollegen stellten fest, dass die Verwendung von 3D-Bildern und daraus erstellter 2D-Bilder die Strahlendosis um durchschnittlich 45 % reduzierte und bei der diagnostischen Genauigkeit gegenüber 3D-Mammografiebildern und konventionellen 2D-Bildern keine bedeutsamen Unterschiede feststellbar waren. Die Studie wurde bereits vor der am 24. Januar 2014 in der Zeitschrift Radiology, einer wissenschaftlichen Zeitschrift der Radiological Society of North America (RSNA), erschienenen Druckausgabe online veröffentlicht.
- Die UPMC Studie.
- Die Reader-Studie, „Comparison of Two-dimensional Synthesized Mammograms versus Original Digital Mammograms Alone in Combination with Tomosynthesis Images [Vergleich zweidimensionaler synthetischer Mammogramme mit ursprünglichen digitalen Mammogrammen alleine in Kombination mit Tomosynthesebildern]“, untersuchte ebenfalls, ob erzeugte 2D-Bilder anstelle konventioneller 2D-Bilder bei einer 3D-Mammografie verwendet werden können. Die Autoren verglichen in dieser retrospektiven Studie die Ergebnisse von acht Fachleuten, die verschiedene Fälle auswerteten, welche die gesamte Bandbreite der Läsionen und der in der klinischen Praxis auftretenden, identifiziertenStörfaktoren abdeckten. Margarita L. Zuley, Department of Radiology, Magee Women's Hospital, University of Pittsburgh Medical Center, und ihre Kollegen kamen zu dem Schluss, dass die erzeugten 2D-Bilder zu keinen klinisch bedeutsamen Unterschieden bei der Diagnosegenauigkeit führten und daher verwendet werden könnten, um die konventionelle 2D-Mammografie als Teil der routinemäßigen 3D-Mammografieuntersuchung zu ersetzen. Die Studie wurde bereits vor der am 21. Januar 2014 in der Zeitschrift Radiology erschienenen Druckausgabe online veröffentlicht.
- Die Massachusetts General Hospital Studie.
- Die Multi-Reader-Studie, „Diagnostic Accuracy and Recall Rates for Digital Mammography and Digital Mammography Combined with One-view and Two-view Tomosynthesis: Results of an Enriched Reader Study [Diagnosegenauigkeit und Rückrufraten bei digitaler Mammographie sowie digitaler Mammographie, kombiniert mit Ein-Ebenen- und Zwei-Ebenen-Tomosynthese: Ergebnisse einer erweiterten Reader-Studie]“, stellte fest, dass die Verwendung der Ein-Ebenen-3D-Mammographie von Hologic zusätzlich zur konventionellen digitalen Mammographie die Diagnosegenauigkeit zwar nennenswert verbessert und die Rückrufrate reduziert, dass aber der zusätzliche Einsatz der Zwei-Ebenen-3D-Mammographie von Hologic die doppelte Leistungsverbesserung brachte und die Zahl der unnötigen Rückrufe von Patienten noch weiter verringerte. Die Forscher kamen zu dem Schluss, dass „ein Ansatz, der die Zwei-Ebenen-3D-Mammographie mit digitaler Mammografie kombiniert, in der klinischen Praxis verwendet werden sollte.“ Außerdem stellten die Forscher fest, dass die zusätzliche Verwendung der Zwei-Ebenen-3D-Mammografie im Vergleich zu konventioneller Mammografie die Diagnosegenauigkeit der Bildgebung bei Frauen mit dichtem Brustgewebe erheblich steigert.
Aufnahmetechniken
Jede Brust wird aus zwei, gegebenenfalls auch mehreren Richtungen aufgenommen. Die beiden am häufigsten und üblicherweise angewendeten Projektionen sind die cranio-caudale Abbildung (Röntgenbild der Brust von oben) und die MLO-Aufnahme (mediolateral oblique, Röntgenbild der Brust von der Mitte nach außen). Während der Aufnahme wird die Brust zwischen dem Objekttisch und einer Plexiglasplatte moderat komprimiert. Dies ist notwendig, um die Strahlendosis gering zu halten und die zu untersuchende Brustregion bestmöglich abzubilden. Die Untersuchung wird von einem Teil der Patientinnen als unangenehm empfunden.
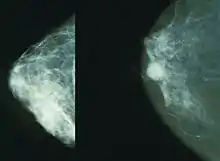
Die weiche Strahlung führt zu kontrastreicheren Aufnahmen, als sie bei anderen Röntgenuntersuchungen mit harter Strahlung möglich wären. Mit der Untersuchung können kleine, nicht tastbare Gewebeformationen sowie Mikrokalk erkannt werden. Die Röntgenbilder werden durch den untersuchenden Arzt ausgewertet, wobei in den europäischen Screeningprogrammen die Doppelbefundung durch zwei Ärzte erfolgt. Hierbei können CAD-Systeme (Computer-assisted Detection) die Radiologen bei der Auswertung von Röntgenaufnahmen unterstützen.[3] Sie sind in den USA und den Niederlanden abrechnungsfähig.
Mammographie als individuelle Untersuchung
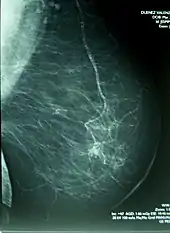
Die Mammographie kann zur weiteren Abklärung tumorverdächtiger Befunde eingesetzt werden, meist ein tastbarer Knoten oder eine Sekretion aus der Brustwarze. Unter Fachleuten ist dafür der Begriff kurative Mammographie gebräuchlich. Das Ergebnis der Untersuchung fließt in die Planung der weiteren Therapie ein.
Mammographie als Screening-Untersuchung

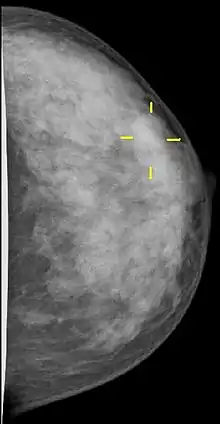
Die Mammographie wird auch zur Früherkennung von Brustkrebs eingesetzt. Ziel dieser Screening-Maßnahme ist es, durch möglichst frühzeitiges Erkennen die Lebenserwartung an Brustkrebs erkrankter Frauen zu verlängern. Zu diesem Zweck führt man in einigen Staaten (Niederlande, Schweden, Finnland seit 1974; Großbritannien seit 1979) organisierte Reihenuntersuchungen an Frauen ohne Symptome durch. Damit konnte angeblich die Sterblichkeit um 25–30 % gesenkt werden.[4][5][6]
Neuere Untersuchungen relativieren diesen Nutzen inzwischen aber. Eine Metaanalyse aus dem Jahre 2013 führt die ursprünglich gefundenen positiven Effekte auf die Sterblichkeit, auf mangelhafte Randomisierung der Patientenkollektive zurück. Die Studien, in welchen dies korrekt durchgeführt wurde, fanden hingegen keine signifikanten Unterschiede in der Krebssterblichkeit nach 10 Jahren und in der Gesamtsterblichkeit nach 13 Jahren.[7]
Weiters wurde in einer kanadischen Studie über einen Zeitraum von 25 Jahren mit einer zufälligen Zuteilung von insgesamt fast 90 000 Frauen zu entweder einer Gruppe mit jährlicher Mammographie und klinischer Untersuchung oder einer Gruppe mit ausschließlich einer jährlichen klinischen Untersuchung, kein signifikanter Unterschied in der Brustkrebssterblichkeit zwischen den beiden Gruppen festgestellt.[8]
Die Inzidenz von Brustkarzinomen steigt durch das Screening an, da es zu Überdiagnosen[9] kommt, d. h. auch Karzinome entdeckt werden, an denen die Frau nicht gestorben wäre. Die Früherkennung kann eine Erkrankung an Brustkrebs nicht verhindern (wie z. B. Impfungen). Sie dient in erster Linie dazu, den Brustkrebs in einem frühen Stadium zu erkennen und weniger invasiv behandeln zu können.[10]
In Deutschland wurde auf Beschluss des Bundestags[11] seit 2005 ein nationales Mammographie-Screeningprogramm[12] unter Beachtung der entsprechenden europäischen Leitlinie aufgebaut.[13] Im Unterschied zur kurativen Mammographie erfolgt das Screening nur in wenigen hochspezialisierten Zentren und mit extrem aufwändigem Qualitätsmanagement. Nur speziell geschulte Radiologen bzw. Gynäkologen, Radiologieassistenten und Pathologen dürfen an dem Programm teilnehmen. Die Qualifikation muss durch jährliche Prüfungen erneut nachgewiesen werden. Die Erfolgsquoten werden durch spezielle übergeordnete Zentren, den sogenannten Referenzzentren, überprüft.
Die gesamte Bevölkerung der 50- bis 69-jährigen Frauen wird über die Einwohnermelderegister angeschrieben. Im Dezember 2009 nahm die letzte der insgesamt 94 Einheiten den Betrieb auf.[14] Bis Dezember 2009 wurden 9,2 Millionen Frauen zum Screening eingeladen, 54 % ließen sich untersuchen.[14] Um auch Frauen außerhalb von Ballungszentren zu erreichen, wird der ländliche Raum zum Teil durch Sattelauflieger mit eingebautem Mammographiegerät, so genannten Mammobilen, erschlossen.
Qualitätssicherung
Durch radiologische und pathologische Doppelbefundung wird erreicht, dass die Rate kleiner Karzinome und präinvasiver Läsionen (z. B. DCIS) hoch ist und andererseits möglichst wenige Biopsien gutartiger Mammatumoren durchgeführt oder diese operativ entfernt werden. Die EUREF-Richtlinie verlangt mindestens 50 % bösartige Tumoren bei den Bioptaten;[15] manche Programme erreichen bis zu 80 %.[16]
Eine Qualitätssicherung hat die Senkung der Rate falsch-positiver oder übersehener Befunde zum Ziel. Speziell ausgebildete Radiologen, die in der Beurteilung an vielen Mammogrammen geübt sind, können sowohl die Spezifität als auch die Sensitivität stark verbessern. Unerlässlicher Bestandteil des Mammographie-Screenings sind auch spezialisierte Pathologen, die entnommene Proben (z. B. Vakuumbiopsie) histologisch beurteilen. Zu der individuellen Diagnosefindung geben sie dem Radiologen auch eine Rückmeldung über die Richtigkeit seiner Befundinterpretation (Korrelation der Befunde) in einer sogenannten Screening-Einheit. Das sind Zentren, die auf das Mammographie-Screening spezialisiert sind und eine gültige Zulassung (Zertifikat) hierfür besitzen. Ärzte, die die strengen Kriterien der EuRef-Norm für Mammographieuntersuchungen erfüllen, bekommen dafür ein Zertifikat verliehen, das jährlich erneuert werden muss. Frauen, die eine Mammographie durchführen lassen wollen oder müssen, sollten sich im Vorfeld erkundigen, ob der Röntgenarzt ein solches Zertifikat besitzt. Dies gibt ihnen weitgehende Sicherheit, sowohl was das Strahlenrisiko und die Bildqualität angeht, als auch bezüglich der Qualifikation des Arztes und seiner Mitarbeiterinnen. Weiter dienen der Qualitätssicherung ein Brustkrebsregister und eine Qualitätssicherung der technischen Apparate.
Empfehlungen bezüglich des Untersuchungsalters
Für Frauen unter 40 bis 50 Jahren scheint die Screening-Mammographie nach derzeitigem Stand des Wissens keinen Vorteil zu bringen, da der Anteil an falsch positiven Befunden umso höher wird, je jünger die Frau ist. Dies ist unter anderem mit der höheren Gewebedichte der Brüste jüngerer Frauen zu erklären, die die allgemeine Beurteilbarkeit der Röntgenaufnahme erschwert. Das deutsche Screeningprogramm lädt daher alle Einwohnerinnen von 50 bis 69 Jahren alle zwei Jahre zur Untersuchung ein.
Kritik am Mammographie-Screening
Kritik am allgemeinen Nutzen des Röntgen-Screenings
Kritiker argumentieren, dass die relative Risikoreduktion oft missverstanden, bzw. der erwartete Nutzen für die Teilnehmerinnen überschätzt werde und schlussfolgern daraus unnötige Untersuchungen bei Berücksichtigung der Strahlenbelastung. Ähnlich wie bei der unumstrittenen Vorsorgeuntersuchung gegen einen langsam wachsenden Gebärmutterhalskrebs (sog. „Abstriche“), ist es sehr wahrscheinlich, dass eine Frau, die regelmäßig zur Mammographie geht, niemals einen Krebs entwickelt und damit keinen Nutzen von der Untersuchung hat. Die Gesamtsterblichkeit von Frauen an Krebs (alle Arten) ändere sich durch Teilnahme an einem Mammographie-Screeningprogramm nicht.[17] Es gibt keine effektive Möglichkeit zu ermitteln, welche Frau einen Nutzen von der Mammographie haben wird. Ein wesentliches Problem des Brustkrebs und seiner Vorstufen ist, dass er in der Regel erst (relativ groß) erkannt wird, wenn ein fortgeschritteneres Tumorstadium vorliegt. Das Ziel des strahlenfreien Mammasonographie- und des Mammographie-Screenings ist jedoch nicht nur, die allgemeine Sterblichkeit an Brustkrebs zu verringern, sondern vor allem auch Tumoren in einem früheren Stadium zu entdecken und somit die Überlebenszeit und die Lebensqualität der betroffenen Frau zu verbessern.[18] Cochrane Nordic schreibt, dass es allerdings mittlerweile nicht mehr sinnvoll zu sein scheint, an Brustkrebs-Screenings teilzunehmen.[19]
Kritik der Überdiagnostik durch falsch-positive Befunde
Wie jeder Test liefert auch die Mammographie falsch positive Ergebnisse, also einen Krebsverdacht, obwohl kein Krebs vorhanden ist. Laut Christa Halbwachs von der Austrian Breast Imaging Study Group habe die Mammographie eine Sensitivität (Richtig-Positiv-Rate) von 83 % und eine Spezifität (Richtig-Negativ-Rate) von 97 %. Jeder krebsverdächtige Befund im Screening sollte standardmäßig abgeklärt werden, entweder durch eine Vakuum- oder Stanzbiopsie oder durch eine zeitnahe mammographische Kontrolluntersuchung (z. B. in sechs Monaten). Nur in Ausnahmefällen wird eine offene Biopsie (d. h. eine Operation) zur Diagnosesicherung vorgenommen. Diese falsch-positiven Befunde können für die betreffende Frau psychisch sehr belastend sein. Von vielen Frauen wird eine histologische Abklärung mit abschließender Entwarnung (also eine Sicherung der Diagnose) als Erleichterung empfunden, auch wenn die Untersuchung im Nachhinein unnötig war. Im deutschen Screeningprogramm beträgt das Verhältnis von benignen zu malignen Biopsien 1:2,3.
Kritik der Strahlenbelastung
Die Mammographie selbst kann, da es sich um ionisierende Strahlung handelt, zumindest statistisch Karzinome hervorrufen. Die Häufigkeit ist jedoch nicht direkt messbar, es existieren nur Daten historischer Untersuchungen, die das theoretische Risiko auf 0,01 % schätzen.[20]
Kritik der „ungefährlichen Karzinome“ und unnötigen Operationen
Der Brustkrebs ist keine einzelne Erkrankung, sondern besteht aus einer heterogenen Gruppe verschiedener Tumoren mit unterschiedlicher Prognose. Grundsätzlich ist die Überlebensrate von bestimmten Faktoren abhängig. Dazu zählen Tumorgröße, Absiedlungen in den Lymphknoten der Achselhöhle, Fernmetastasen (TNM-Klassifikation), histologischer Differenzierungsgrad und die Art der Tumortherapie.
Screening-Kritiker weisen darauf hin, dass unter anderem durch die mammographische Reihenuntersuchung auch Karzinome entdeckt werden, die – wären sie nicht in der Mammographie aufgefallen – einen nicht lebensbedrohlichen Verlauf nehmen könnten (indolenter Tumor). Dadurch, so die Kritik, würden unnötige Operationen und Krebstherapien durchgeführt, die die Lebensqualität der Patientin einschränken, auch wenn sie unbehandelt nicht an Brustkrebs gestorben wäre.[21] Da der individuelle Verlauf einer Krebserkrankung nicht mit ausreichender Sicherheit vorhergesagt werden kann, ist diese Haltung unter Experten stark umstritten. Italienischen Forschern zufolge ist der Nutzen des Screenings größer als die Gefahr der Überdiagnostik.[22] Befürworter des Screening-Programmes verweisen auf die gesunkene Mortalität (Sterblichkeit) seit Einführung des Screenings. Die Sterblichkeit bei Frauen über 70 Jahren ist dabei jedoch nicht verringert, d. h. die Frauen profitierten aufgrund ihres Lebensalters nicht von der Untersuchung. Die obere Altersgrenze für die Teilnahme am Mammographie-Screening liegt deshalb bei 70 Jahren.[23]
In Zusammenhang mit indolenten Tumoren wird häufig auch von unnötigen Operationen gesprochen, die zu einer Stigmatisierung oder Verstümmelung führen könnten. Tatsächlich stellt die weibliche Brust besondere Anforderungen an den Operateur, um sowohl bei brusterhaltender Therapie als auch bei einer Mastektomie ein onkologisch gerechtes und gleichzeitig kosmetisch ansprechendes Ergebnis zu erzielen. Der Anspruch, ein möglichst gutes kosmetisches Ergebnis bei jeder Operation zu erzielen, ist auch in den S3-Leitlinien zur Behandlung des Mammakarzinoms verankert. Deshalb wird generell die Behandlung in einem zertifizierten Brustzentrum empfohlen.[18]
Kosten
- Bei einer Teilnahmerate von 70 Prozent belaufen sich die Kosten in Deutschland auf etwa 300 Millionen Euro, die von den gesetzlichen Krankenkassen getragen werden. Für die teilnehmenden Frauen ist die Untersuchung kostenlos.
Forschung an weiteren Methoden
Die Darstellung der Brust mit Hilfe von Mikrowellen wird für die Erkennung und Beobachtung, Screening und Chemotherapie-Monitoring erforscht.[24] Das Potenzial derartiger Verfahren liegt in den unterschiedlichen dielektrischen Eigenschaften, die zwischen gesunden und von Krebs befallenen Gewebe zu beobachten sind.[25]
Siehe auch
Literatur
- Ingrid Mühlhauser, Birgit Höldke: Mammographie. Brustkrebs-Früherkennungs-Untersuchung. Kirchheim-Verlag, Mainz 2000
- H. Jung: Mammographie und Strahlenrisiko. In: RöFo: Fortschritte auf dem Gebiet der Röntgenstrahlen und bildgebenden Verfahren. 169, Nr. 4, 1998, S. 336–343.
- L. Nystrom et al.: An overview of the Swedish randomised mammography trials: total mortality pattern and the representativity of the study cohorts. In: Journal of Medical Screening. 3, 1996, S. 85–87.
- Siddhartha Mukherjee: Der König aller Krankheiten: Krebs – eine Biografie. DuMoint Buchverlag, Köln 2012, ISBN 978-3-8321-9644-8, S. 367–387. (Geschichte der Mammographie).
- N. Perry, M. Broeders, C. de Wolf, S. Törnberg, R. Holland, L. von Karsa: European guidelines for quality assurance in breast cancer screening and diagnosis. 4. Auflage. Office for Official Publications of the European Communities, Luxembourg 2006, ISBN 92-79-01258-4 (europa.eu [PDF; 156 kB]).
- S3-Leitlinie Brustkrebs-Früherkennung der Deutschen Gesellschaft für Senologie und der Deutschen Krebsgesellschaft, AWMF-Register Nr. 077/001, Stand: 02/2008
- S3-Leitlinie Diagnostik, Therapie und Nachsorge des Mammakarzinoms der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe und der Deutschen Krebsgesellschaft, AWMF-Register Nr. 032/045, Stand: 04/2008
- Informationsbroschüre Mammographie-Screening der Deutschen Krebsgesellschaft (PDF; 1,0 MB)
- Patienteninformationsbroschüre zum Thema Mammographiescreening (PDF; 1,45 MB)
Weblinks
- Mammographie-Screening-Programm – Informationen der Kooperationsgemeinschaft Mammographie (gemeinsame Trägerschaft von den gesetzlichen Krankenkassen und der Kassenärztlichen Bundesvereinigung [KBV])
- Brustkrebsscreening: Tomosynthese ante portas. Deutsches Ärzteblatt 13/2017, abgerufen am 19. November 2018. (Dtsch Arztebl 2017; 114(13): A-632 / B-545 / C-531)
Einzelnachweise
- Mario Beck: Radiologie-Tagung mit Ausflug in die Geschichte. In: Leipziger Volkszeitung, 23. März 2012
- J. Gossner, C. Scherer: Leipzig und die Entwicklung der klinischen Mammografie. In: Ärzteblatt Sachsen 06|2018
- McKinney, S.M., Sieniek, M., Godbole, V. et al.: International evaluation of an AI system for breast cancer screening. In: Nature 577, 89–94 (2020) doi:10.1038/s41586-019-1799-6.
- S. W. Duffy et al.: The impact of organized mammography service screening on breast carcinoma mortality in seven Swedish counties. In: Cancer. 2002 Aug 1;95(3), S. 458–469, PMID 12209737
- L. G. Larsson et al.: Updated overview of the Swedish Randomized Trials on Breast Cancer Screening with Mammography: age group 40-49 at randomization. In: J Natl Cancer Inst Monogr., 1997, 22, S. 57–61, PMID 9709277
- A. H. Olsen et al.: Breast cancer mortality in Copenhagen after introduction of mammography screening: cohort study. In: BMJ, 2005 Jan 29,330(7485), S. 220
- Peter C. Gøtzsche, Karsten Juhl Jørgensen: Screening for breast cancer with mammography. In: The Cochrane Database of Systematic Reviews. Nr. 6, 4. Juni 2013, ISSN 1469-493X, S. CD001877, doi:10.1002/14651858.CD001877.pub5, PMID 23737396.
- Anthony B. Miller, Claus Wall, Cornelia J. Baines, Ping Sun, Teresa To: Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. In: BMJ (Clinical research ed.). Band 348, 11. Februar 2014, ISSN 1756-1833, S. g366, doi:10.1136/bmj.g366, PMID 24519768, PMC 3921437 (freier Volltext).
- "Mammographie-Screening: Nutzen-Schaden-Abwägung im internationalen Vergleich"
- R. L. Benett et al.: Results from the UK NHS Breast Screening Programme 2000-05. In: J Med Screen., 2007, 14(4), S. 200–204, PMID 18078565
- 3.11 Berufsstruktur - Deutscher Bundestag bundestag.de, am 30. April 2014
- Mammographie-Screening-Programm Seite mammo-programm.de
- European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis (PDF; 156 kB)
- Ärzte Zeitung, 20. Mai 2010, S. 1
- Deutsche Programmrichtlinie für das Mammographiescreening, siehe Leitlinien - European Guidlines, S. 317
- S. Fabbri u. a.: Benign breast diseases in breast cancer screening programs in italy 2000-2001. (Memento vom 31. Januar 2012 im Internet Archive) (PDF; 155 kB) In: Tumori 90, 2004, S. 547–549. PMID 15762354
- P. C. Gøtzsche, K. J. Jørgensen: Screening for breast cancer with mammography. Cochrane Database of Systematic Reviews 2013, Issue 6. Art. No.: CD001877. doi:10.1002/14651858.CD001877.pub5
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB)
- Screening für Brustkrebs mit Mammographie. Abgerufen am 11. Oktober 2019 (englisch).
- E. A. Nekolla u. a.: Einführung eines Mammographiescreeningprogramms in Deutschland. Erwägungen zu Nutzen und Risiko. (Memento des Originals vom 26. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF) In: Radiologe 45, 2005, S. 245–254.
- K. Kerlikowske: Efficacy of screening mammography among women aged 40 to 49 years and 50 to 69 years: Comparison of relative and absolute benefit. In: Monographs of the National Cancer Institute 22, 1997, S. 79–86, PMID 9709281.
- Ärztezeitung vom 16. September 2012.
- European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis (PDF; 156 kB).
- Hang Song, Shinsuke Sasada, Takayuki Kadoya, Morihito Okada, Koji Arihiro, Xia Xiao, Takamaro Kikkawa, Detectability of Breast Tumor by a Hand-held Impulse-Radar Detector: Performance Evaluation and Pilot Clinical Study, Scientific Reports, Band 7, Nr. 16353 (2017).
- Declan O’Loughlin, Martin O’Halloran, Brian M. Moloney, Martin Glavin, Edward Jones, M. Adnan Elahi, Microwave Breast Imaging: Clinical Advances and Remaining Challenges, IEEE Transactions on Biomedical Engineering, PP (99), März 2018, DOI 10.1109/TBME.2018.2809541.