Therapeutische Hyperthermie
Therapeutische Hyperthermie (griechisch für Überwärmung) nennt man in der Medizin eine Behandlung, bei der die Temperatur des Körpergewebes künstlich erhöht wird. Sie ist ein Teilbereich der Thermotherapie. Es gibt Überwärmungen des ganzen Körpers und solche von Regionen oder einzelnen Organen. Unter die Bezeichnung fallen nicht die einfachen äußeren Wärmeanwendungen, die vor allem die Temperatur der Hautschichten erhöhen (Fango, Infrarot-Behandlung) usw.
Bei der Überwärmungstherapie (kurz auch Hyperthermie)[1] wird im Gegensatz zur Fiebertherapie die Wärmeabgabe des Körpers künstlich eingeschränkt, beispielsweise durch Bäder oder wärmestauende Wickel. Grundsätzlich werden als Hyperthermie all jene Verfahren bezeichnet, bei denen die Überwärmung des Körpers oder des Tumorbereichs durch Mikro- oder Radiowellen, bzw. durch Infrarotstrahler von außen bewirkt wird.
Geschichte der therapeutischen Hyperthermie
Erstmals erwähnt wurde die heilende Wirkung der Wärme schon in den altägyptischen Hochkulturen (2400 v. Chr.), aber erst Mediziner der griechischen Antike haben diesen therapeutischen Ansatz konsequent angewandt, anerkannt und benannt: Überwärmung (griechisch: Hyperthermie). So wird im Corpus Hippocraticum in Die epidemischen Krankheiten über eine heilende Wirkung der Malaria quartana bei Epilepsie berichtet.[2] Ein heilendes Fieber wird auch literarisch zu Anfang des 13. Jahrhunderts[3] geschildert. Auch im Stockholmer Arzneibuch findet sich ein seltenes Beispiel einer mittelalterlichen Heilfieber-Therapie.[4]
Im Laufe der Jahrhunderte fanden sich verschiedene Anwendungsgebiete. So war zeitweise bei der Bekämpfung von Infektionskrankheiten die künstliche Erzeugung von Fieber mit Hilfe pyrogener Stoffe als Fiebertherapie (zu therapeutischen Zwecken hervorgerufene Fieber[5]) üblich. Diese Eingriffe in Organismus und Körperfunktionen lassen sich als aktive Hyperthermie bezeichnen und werden auch Heilfieber[6][7][8] genannt. Ein Mittel dafür war das Haarseil. Die passive Hyperthermie bezeichnet hingegen die Erhöhung der Körpertemperatur mittels Geräteeinsatzes von außen. Sie kommt heute vor allem in der Krebsbehandlung zum Einsatz.
Als Pionier der modernen „Fiebertherapie“ darf Julius Wagner von Jauregg gelten. Zunächst beobachtete von Jauregg zufällig bei einem Patienten mit Erysipel eine Heilung für eine generalisierte Paralyse bei systemischer Lues; später entwickelte er dann die Fiebertherapie mittels Malaria-infiziertem Blut, auch Malariatherapie genannt. Von Jauregg erhielt 1927 den Nobelpreis für Physiologie oder Medizin für die Behandlung von Lues mittels Fiebertherapie. Das Verfahren hat mit dem Aufkommen der Antibiotikatherapie seine Bedeutung verloren. Auch in der Behandlung der Schizophrenie wurde zeitweise der Einsatz von fiebererzeugenden Mitteln (Saprovitan, Pyrifer) versucht.[9]
Hyperthermie in der Krebsbehandlung
Hinweis: Eine im Hinblick auf die Krebsbehandlung weiterentwickelte Hyperthermieform wird gelegentlich auch als Onkothermie oder Oncothermie bezeichnet (Zusammensetzung mit dem Begriff Onkologie).
Ganzkörper-Hyperthermie
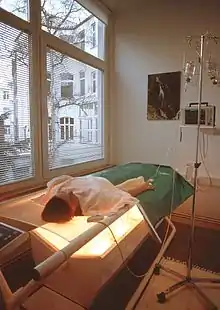
1886 veröffentlichte der deutsche Chirurg Wilhelm Busch einen Artikel „über die Wirkungen, welche heftige Erysipeln (die mit hohem Fieber einher gehen) auf bösartige Neubildungen haben“. Zunächst wurde versucht, bösartige Tumoren mit künstlich erzeugtem Fieber zu heilen. In den ersten beiden Jahrzehnten des 20. Jahrhunderts kamen mehr und mehr Apparate zum Einsatz. Anfang der 1960er Jahre wurde diese bereits bekannte und angewandte Methode als Ganzkörperhyperthermie wiederentdeckt. Interesse ist dabei allgemeine Leistungssteigerung, Steigerung der Immunabwehr, Ergänzung von Krebstherapien. In der alternativen Krebstherapie wird die Hyperthermie besonders bei Rezidiven, Metastasen und Tumoren und als Begleittherapie während und nach der schulmedizinischen Behandlung als nebenwirkungsarme Therapie eingesetzt. Seit den 1970er Jahren laufen Studien zu dieser Therapieform. In Ost-Deutschland war es vor allem der Physiker und Krebsforscher Manfred von Ardenne, der eine Ganzkörper-Hyperthermie entwickelte. Hohe Eindringtiefe erzielte er mit langwelligem Infrarotlicht. Mangels einer genauen Kontrollmöglichkeit der inneren Körpertemperatur war es zu Anfang schwierig, die Methode zu optimieren. Zur Unterstützung wird sie in der Regel mit anderen Therapien kombiniert, zum Beispiel fast immer mit einer Sauerstoffinhalation, analog zum Einsatz von Sauerstoff in der evidenzbasierten Medizin. Er verband daher diese Infrarotlicht-Therapie mit seiner Sauerstoff-Mehrschritt-Therapie zur Krebs-Mehrschritt-Therapie – inklusive erhöhter Zufuhr von Traubenzucker, um das in Bezug auf den Stoffwechsel abweichende Verhalten der Krebszellen nutzbar zu machen, da der „Glykolysestoffwechsel“ in diesen Fällen dominiert. Die vor allem von seinem Institut beziehungsweise der entsprechenden Nachfolgefirma entwickelte moderne Gerätetechnologie ermöglicht eine gute Steuerung der Überwärmung und erleichtert so die Anwendung in der medizinischen Praxis. Von Ardenne konnte nie den klinischen Beweis für die Wirksamkeit in Bezug auf Krebs durch Doppelblindstudien bei einer Therapie, die mit der Inhalation zu tun hat, erbringen. Im Tierversuch gibt es Untersuchungen die positiv verlaufen sind. Die beschriebenen Erfolge der Sauerstoff-Mehrschritt-Therapie und der Krebs-Mehrschritt-Therapie sind Gegenstand von Diskussionen gewesen. Beide Methoden sind in diesem Sinn aktuell der alternativen Medizin zuzurechnen (alternative Krebstherapie – komplementäre Onkologie). Die heilende Wirkung der Überwärmung in Form des Fiebers und auch des künstlich herbeigeführten so genannten „Heilfiebers“ ist unbestritten. Die Hyperthermie ahmt nach und nutzt ein Prinzip, das von der Natur vorgegeben ist.
Bei einer modernen Ausführung, die bei der Ganzkörper-Hyperthermie von Interesse ist (Ardenne), wird die Wärme als gefilterte Infrarotstrahlung zugeführt. Ein Teil der Wärmestrahlung wird, bevor sie den Patienten erreicht, über eine Schicht zirkulierenden Wassers absorbiert. Der Vorteil besteht darin, dass die Strahlung relativ gleichmäßig eindringt, Überhitzung der Hautschichten daher weitestgehend vermieden wird. Der Patient liegt mit dem Rücken auf einer IR-durchlässigen Matte. Die Wärmestrahlung kommt von unten und wird an der Oberseite des Körpers reflektiert. Die Reflexion erfolgt an einer dünnen Metallfolie (ähnlich einer Rettungsdecke), mit der der Patient zugedeckt wird. Sie ermöglicht es, die IR-Strahlung besser auszunützen, sie passiert den Körper zweifach. Alternativ zur offenen Anwendungsform gibt es auch Anlagen, bei denen sich der Patient (ebenfalls in liegender Position) in einer isolierten Kammer befindet, die elektrisch beheizt wird. Der Kopf befindet sich dabei außerhalb der Heizzone (Vorteil = diese Anlage ist technisch einfacher zu realisieren und daher preisgünstiger). Die Ganzkörper-Hyperthermie wird in zwei Anwendungsformen verwendet. Man unterscheidet zwischen der extremen bei Temperaturen von 41,8 °C und der moderaten bei 40,5 °C.
Die Ganzkörper-Hyperthermie wird innerhalb der evidenzbasierten Medizin komplementär eingesetzt. Die mit der extremen Ganzkörper-Hyperthermie erreichten Temperaturen von maximal 41,8 °C erhöhen das Risiko für Komplikationen erheblich. In diesem Fall kann auch die Gabe eines Beruhigungsmittels erforderlich sein. Im Extremfall wird eine Narkose eingeleitet. Verbreiteter sind jedoch Anwendungsformen, bei denen etwas niedrigere Temperaturen (40,5 °C) angewendet werden. In der komplementären Onkologie (alternative Krebsmedizin) erreicht der Körper bei der Ganzkörperhyperthermie Temperaturen zwischen 39,5 und 40,5 °C. Zur Hitzeerzeugung kommen Infrarotstrahler zum Einsatz. Die Ganzkörperhyperthermie wird in der alternativen Krebsbehandlung häufig bei stark metastasierenden Krebserkrankungen angewandt, ebenso bei Metastasen und Tumoren, die nicht operiert werden können. Die Übererwärmung dauert in der Regel nicht länger als eine Stunde. Die Temperatur wird stufenweise und unter ständiger Beobachtung des Patienten (Puls, Blutdruck, Körpertemperatur) gesteigert und reduziert.
In den GUS-Staaten wird die Ganzkörper-Hyperthermie häufig eingesetzt. Dort wird die Körpertemperatur der Patienten unter Kühlung des Gehirns auf Temperaturen von bis zu 43 °C erhöht.
Teilkörper-Hyperthermie
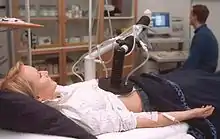
Die Anwendung als Oberflächen-, Tiefen- oder Teilkörper-Hyperthermie wird vielerorts weiterentwickelt und in klinischen Studien erprobt. Bei der loko-regionalen Tiefenhyperthermie wird der Körper örtlich begrenzt überwärmt. „Zunächst wird die vom Tumor betroffene Körperregion durch zwei Applikatoren fixiert. Computergesteuert werden dann Radiowellen im Tumor bzw. im Tumorbett gebündelt, und es erfolgt eine Erwärmung auf 42 bis maximal 44 °C. Die Temperatur wird für ca. 60 bis 90 Minuten im Tumorbett aufrechterhalten.“[10] Fast immer wird die Hyperthermie mit Strahlen- oder Chemotherapie kombiniert, wenn es um Krebserkrankungen geht. In der Behandlung von Krebserkrankungen wird sie vor allem dann eingesetzt, wenn andere Verfahren (Operation, Strahlentherapie oder Chemotherapie) keinen ausreichenden Erfolg mehr versprechen, das heißt, wenn die Patienten austherapiert sind. Die Wirksamkeit einer Chemo- bzw. Strahlentherapie kann durch die Kombination mit einer Hyperthermie bei bestimmten Krebsarten verbessert werden. In einer Phase-3-Studie mit Hyperthermie bei Weichteilsarkomen – die weniger als 1 % aller Krebserkrankungen ausmachen – wurde bei 341 Hochrisikopatienten die Kombination aus Chemotherapie und Hyperthermie oder alleiniger Chemotherapie verglichen. Das mittlere krankheitsfreie Überleben betrug in der Kombi-Therapiegruppe 30 Monate, gegenüber 16 Monaten bei der reinen Chemotherapie-Gruppe. Auch beim mittleren lokalen progressionsfreien Überleben schnitt die Hyperthermie mit 38 gegenüber 26 Monaten besser ab.[11]
Transurethrale Hyperthermie
In der Urologie wird die hochenergetische Mikrowellentherapie bei der gutartigen Prostatavergrößerung (BPH) eingesetzt. Durch eine spezielle Behandlungsmethode (CoreTherm-Therapie) wird die Prostata im bestimmten Bereich kontrolliert auf 55 °C erhitzt. Bei diesem minimalinvasiven Verfahren wird das überschüssige Prostatagewebe zerstört.
Bei dieser Form der Behandlung, der so genannten transurethralen Hyperthermie, wird zusätzlich zur Wärme ein elektromagnetisches Feld aus Radiokurzwellen aufgebaut, welche – im Gegensatz zu den früher verwendeten Mikrowellen – eine größere Reichweite haben. In der alternativen Krebstherapie wird bei der transurethralen Radiofrequenz-Hyperthermie (TUR) die Therapieelektrode direkt unter örtlicher Betäubung in der Harnröhre platziert. Über eine Sonde werden nun, für den Patienten schmerzfrei, elektromagnetische Wellen durch das Prostatagewebe gesendet, wo sie in Wärme umgewandelt werden. Die Sonde selbst bleibt kalt, so besteht keine Verletzungsgefahr der Harnröhre. Je dichter das Gewebe ist, desto mehr absorbiert es die Wellen und desto höher wird die Temperatur. Diese liegt bei der transurethralen Hyperthermie bei etwa 48 bis 52 °C. Die durch die elektrischen Wellen erzeugte Wärme schädigt das vergrößerte Gewebe der Prostata, das elektrische Feld agiert dabei als eine Art Alphablocker, das bedeutet, es „depolarisiert“ die so genannten Alpharezeptoren, die sich an der Prostatamuskulatur befinden. Auf diese Weise wird die Muskulatur entspannt, der Harnfluss verbessert und die Prostata verkleinert. Durch gleichzeitige medikamentöse Maßnahmen kann mit dieser nebenwirkungsfreien Methode in vielen Fällen eine Rückbildung bzw. eine vollständige Remission erreicht werden. Eine Operation oder Bestrahlung kann somit umgangen werden, ebenso wie die bei einer Operation bekannten Nebenwirkungen der Inkontinenz oder Impotenz.[12]
Unterschiedliche Verfahren
Die Überwärmung auf 40 bis 44 °C wird gezielt im Tumorgebiet erzeugt, meist von außen mit Hilfe von Mikrowellen, Radiowellen oder Ultraschall. Andere Gruppen experimentieren mit implantierten Antennen, magnetisch angeregten Thermoseeds oder mit heißem Wasser gespeisten Röhren. Einzelne Organe können vom Blutkreislauf vorübergehend getrennt und mit erwärmter Lösung gespült werden. Es gibt auch experimentelle Ansätze, Heizspulen direkt in einen Tumor hineinzubringen oder magnetische Flüssigkeiten zu injizieren und diese dann induktiv zu erwärmen.
Ein aktueller Ansatz beruht z. B. auf der Injektion einer Suspension von superparamagnetischen Eisenoxid-Partikeln mit einem Durchmesser von etwa 15 nm und einer Umhüllung aus Aminosilanen in den Tumor. Diese Teilchen werden relativ selektiv von Tumorzellen aufgenommen und erhitzen sich im magnetischen Wechselfeld.
Die klinische Erprobung, vorwiegend in der Arbeitsgruppe des Berliner Radioonkologen Peter Wust, hat das Stadium von Kleinserien und Machbarkeitsstudien erreicht.[13] Je nach dem verwendeten Zielverfahren (Injektion unter Computertomographie, Durchleuchtung, oder Ultraschall) und dem Tumorsitz ist die ungleichmäßige Temperaturverteilung noch problematisch. Eine möglichst homogene Hyperthermie von 42 °C im gesamten Zielvolumen ist bisher nicht erreicht worden.
Ein Wirksamkeitsnachweis der vom Hersteller (MagForce AG) Nano-Krebstherapie genannten Methode wurde erbracht.[14] Die erste Phase-II-Studie mit Gehirntumoren wurde im Januar 2010 abgeschlossen. In den Medien wird für diese Form der Hyperthermie oft der unspezifische Ausdruck „Nanotherapie“ verwendet.
Bei der laserinduzierten Thermotherapie (LIT) wird der Tumor per Laser gezielt lokal überhitzt, um die Krebszellen abzutöten. Die LIT wird unter computertomographischer Kontrolle vorbereitet und durchgeführt. Lasersonden werden dabei zum Tumorherd geführt.
Wirkungsweise
Die erhöhten Temperaturen sollen eine verstärkte Durchblutung im Tumorgewebe begünstigen und damit zu einer verbesserten Wirkung von Strahlen- und Chemotherapie beitragen. Krebszellen können aufgrund ihrer primitiven Blutversorgung Wärme im Gegensatz zu gesundem Gewebe schlecht abführen. Das hängt damit zusammen, dass Tumorzellen einen anderen Stoffwechsel und eine andere Gefäßversorgung haben als gesunde Zellen. Somit entsteht in den Krebszellen ein Hitzestau, der zu einer Unterversorgung der Tumorzellen mit Sauerstoff und zur Nährstoffverarmung im Tumor führt.[15] Diese Mangelerscheinung führt zu Störungen wichtiger Stoffwechselprozesse bei der Zellteilung und Zellerhaltung, wobei auch Reparatursysteme der Zellen ausfallen. So können thermische (durch Hyperthermie geschädigte) Zellbestandteile nicht ersetzt werden, was zum Absterben der Tumorzellen führen kann. Der sogenannte synergistische Effekt der Hyperthermie führt zu einer Potenzierung der Wirksamkeit bei Kombination der Standardtherapien mit therapeutischer Hyperthermie. Eine aktuelle Studie der Berliner Charité, die Rektumkarzinom-Patienten untersuchte, kam darüber hinaus zu folgendem Ergebnis: Der zusätzliche Einsatz von Hyperthermie in Kombination mit Strahlen- und Chemotherapie hat eine positive Wirkung auf die Lebensqualität von Krebspatienten gegenüber denjenigen, die keine Behandlung mit Hyperthermie erhielten.[16]
Man hat festgestellt, dass Zytostatika bei Temperaturen über 40 °C deutlich aggressiver wirken als bei der normalen Körpertemperatur. Darüber hinaus sind die thermisch vorgeschädigten Tumorzellen leichter durch die Strahlentherapie zu bekämpfen, weil ihre Reparaturfähigkeiten herabgesetzt sind. Untersuchungen haben weiterhin ergeben, dass Krebszellen bei einer Erwärmung auf ca. 42 °C im Gegensatz zu gesundem Gewebe besonders geartete Eiweißstrukturen auf ihrer Oberfläche bilden. Diese Eiweißstrukturen, auch Hitzeschockproteine genannt, werden vom Abwehrsystem als körperfremd erkannt, so dass die Krebszellen vom Abwehrsystem zerstört werden können.
Hyperthermie soll an zwei Fronten wirken: zum einen durch thermische Schädigung, zum anderen durch die Stimulierung des Immunsystems.
Bei Temperaturen bis 46 °C innerhalb des Tumors wird die Wirkung einer gleichzeitig angewandten Strahlen- oder Chemotherapie verstärkt. Die Wirkungsverstärkung gegenüber einer Strahlentherapie erfolgt dabei beispielsweise durch den wärmebedingten Funktionsverlust von Reparaturenzymen, die normalerweise Strahlenschäden an der DNA reparieren und so das weitere Überleben von Tumorzellen ermöglichen. Werden diese wichtigen Enzyme durch Wärme geschädigt, sterben die Tumorzellen bereits bei kleineren Strahlendosen ab und somit werden auch strahlenresistente Tumorzellen von der Kombinationsbehandlung erfasst. Wärme beeinträchtigt aber auch andere Proteine, die zum Beispiel dafür verantwortlich sind, dass chemoresistente Tumorzellen die für sie schädlichen Zytostatika aus den Zellen wieder herausschleusen können. Fallen diese „Pumpen“ durch Wärmeeinwirkung aus, sterben selbst chemoresistente Tumorzellen, weil die Wirkstoffe weiterhin in den Zellen verbleiben.
Bei Temperaturen über 46 °C werden nahezu alle Biomoleküle der Zellen betroffen und die Zelle stirbt direkt an den Folgen der Überhitzung.
Gegenwärtiger Stand
Es gibt viele Geräte mit unterschiedlicher Funktionsweise am Markt, aber noch kaum größere Behandlungsserien mit echter Vergleichbarkeit zu den klassischen Krebstherapien. Das erklärt, warum Hyperthermie-Behandlungen noch nicht als Standardtherapien eingesetzt werden. Mit Mikrowellen arbeitende Geräte der Firma Dr. Sennewald Medizintechnik GmbH benutzen mehrere phasengesteuerte Antennen, die Wärme lokal steuern können und sind derzeit nur in onkologischen Zentren verfügbar. Gegenwärtig gibt es Behandlungsprogramme an 14 onkologischen Zentren in Deutschland (zum Beispiel München/Großhadern, Universitätsklinik Tübingen, Berlin/Charité). Geräte des Herstellers Oncotherm GmbH arbeiten mit Funkwellen der ISM-Frequenz 13,56 MHz (Kurzwelle, vgl. auch Kurzwellentherapie) und Leistungen bis 600 W (Gerät EHY-3010[17]) und finden sich vor allem bei niedergelassenen Ärzten, die vor allem Krebspatienten in den späteren Stadien der Krankheit therapieren. Der deutsche Hersteller Celsius42 aus Eschweiler fertigt ebenfalls ein Kurzwellengerät (Frequenz 13,56 MHz) mit Leistungen bis 500 W und verkauft es an Privatkliniken und Krankenhäuser.
Hyperthermie ist in Deutschland seit 2004 keine Regelleistung der gesetzlichen Krankenversicherung mehr, aber auf Antrag können dort im Rahmen einer individuellen Fallentscheidung die Kosten übernommen werden.
HIPEC
HIPEC steht für „Hypertherme intraperitoneale Chemotherapie“, englisch hyperthermic intraperitoneal chemotherapy. Dieses Verfahren wird bei einer peritonealen Metastasierung von Magen-Darm-Tumoren oder gynäkologischen Tumoren nach einer zytoreduktiven Operation eingesetzt (CRS, englisch "cytoreductive surgery") eingesetzt. Tumoren, die sich auf dem Peritoneum, also der Oberfläche von Bauchorganen und innerer Bauchwand, angesiedelt haben, lassen sich in der Regel nicht kurativ operieren. Bei der CRS wird so viel Tumorgewebe wie möglich chirurgisch entfernt. Danach erfolgt die Bekämpfung der Tumorreste mit einer hyperthermen Lösung von Chemotherapeutika, welche in die Bauchhöhle appliziert wird. Durch die hohe Temperatur wird die Wirkung der Chemotherapie auf die Tumorzellen erhöht. Dadurch werden mikroskopische Tumorreste zerstört und das Rezidivrisiko vermindert.[18] Obwohl das Verfahren bereits gute Ergebnisse geliefert hat, sollte es vorerst nur in geeigneten Zentren im Rahmen von Studien angewendet werden, weil das Risiko von Nebenwirkungen bei falscher Anwendung erheblich ist und Indikation sowie methodische Einzelheiten noch nicht genug validiert sind.
Weblinks
- Hyperthermie: Wärme gegen Krebs, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 30. Juni 2013. Zuletzt überprüft am 4. September.
- Interdisziplinäre Arbeitsgruppe Hyperthermie (IAH) in der Deutschen Krebsgesellschaft
- Scheitern eines innovativen Ansatzes: Manfred von Ardenne und die Krebs-Mehrschritt-Therapie
- Deutsche Gesellschaft für Hyperthermie
- Beschluss des Gem. Bundesausschuss zur Hyperthermie (PDF; 360 kB)
- Bericht des Gem. Bundesausschuss zur Hyperthermie (PDF; 4,69 MB)
Einzelnachweise
- www.dgo.de.
- Bernhard D. Haage: Heilfieber. In: Enzyklopädie Medizingeschichte. 2005, S. 545.
- Bernhard Dietrich Haage, Gundolf Keil: Zum künstlich erzeugten Heilfieber in Wolframs „Parzival“. In: Kurt Gärtner, Joachim Heinzle (Hrsg.): Studien zu Wolfram von Eschenbach. Festschrift für Werner Schröder zum 75. Geburtstag. Tübingen 1989, S. 343–355.
- Gundolf Keil: Randnotizen zum „Stockholmer Arzneibuch“. In: Studia neophilologica. Band 44, Nr. 2, 1972, S. 238–262, hier: S. 251.
- Gundolf Keil: Il contromodello: febbre provocata a scopo terapeutico nella medicina italiana dell’alto e tardo Medioevo. (Übersetzt von Marco Toni) In: Università degli studi di Padova, Casa della Gioventù Universitaria di Bressanone: Europäische Initiativen des Triangulums Innsbruck - Freiburg i. B. - Padua 2002. Padua 2003, S. 142–156.
- Gerhard Eis: Zur Geschichte des künstlichen Heilfiebers. In: Sudhoffs Archiv. Band 51, 1967, S. 266–267; auch in: Gerhard Eis: Forschungen zur Fachprosa. Bern/München 1971, S. 49 und 367.
- Bernhard D. Haage: Heilfieber. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 545.
- Vgl. auch Gerhard Eis: Künstliches Heilfieber. Fiebertherapie im 16. und 17. Jahrhundert. In: Medizinische Monatsschrift. Band 11, 1957, S. 823–826.
- Bangen, Hans: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, Seite 32–37 Fiebertherapien ISBN 3-927408-82-4.
- Peter Wolf: Neue Wege in der Krebstherapie. Oktober 2008, S. 34f.
- R. D. Issels, L. H. Lindner u. a.: Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomised phase 3 multicentre study. In: The Lancet Oncology. Band 11, Nummer 6, Juni 2010, S. 561–570, ISSN 1474-5488. doi:10.1016/S1470-2045(10)70071-1. PMID 20434400.
- Peter Wolf: Neue Wege in der Krebstherapie. Naturasanitas, Hannover 2008, ISBN 978-3-9812416-0-0, S. 36.
- P. Wust u. a.: Magnetic nanoparticles for interstitial thermotherapy--feasibility, tolerance and achieved temperatures. In: International Journal of Hyperthermia 22/2006, S. 673–85. PMID 17390997
- MagForce Nanotechnologies AG erhält europäische Zulassung für die Nano-Krebs®-Therapie. In: MagForce AG. 28. Juni 2010, abgerufen am 26. Oktober 2011.
- J. van der Zee: Heating the patient: a promising approach? In: Annals of Oncology. Band 13, Nr. 8, 1. August 2002, ISSN 0923-7534, S. 1173–1184, doi:10.1093/annonc/mdf280, PMID 12181239.
- T. Schulze, P. Wust, J. Gellermann, B. Hildebrandt, H. Riess: Influence of neoadjuvant radiochemotherapy combined with hyperthermia on the quality of life in rectum cancer patients. In: International Journal of Hyperthermia: The Official Journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. Band 22, Nr. 4, 1. Juni 2006, ISSN 0265-6736, S. 301–318, doi:10.1080/02656730600665504, PMID 16754351.
- oncotherm.com (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- F. C. Roxan, P. A. Helderman, Daan R. Löke, H. Petra Kok, Arlene L. Oei, Pieter J. Tanis: Variation in Clinical Application of Hyperthermic Intraperitoneal Chemotherapy: A Review. In: Cancers. Band 11, Nr. 1, 11. Januar 2019, ISSN 2072-6694, doi:10.3390/cancers11010078, PMID 30641919, PMC 6357036 (freier Volltext).