Guanin
Guanin (G, Gua) ist eine der vier Nukleinbasen in der DNA und RNA, zusammen mit Adenin, Cytosin und Thymin (Uracil in RNA). Es ist eine heterocyclische organische Verbindung mit einem Puringrundgerüst und zwei Substituenten (Aminogruppe an Position 2 und Sauerstoffatom an Position 6). Das Nukleosid von Guanin ist das Desoxyguanosin in der DNA und das Guanosin in der RNA. In der Watson-Crick-Basenpaarung bildet es drei Wasserstoffbrücken mit Cytosin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
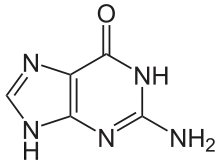 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Guanin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H5N5O | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblich weißer Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 151,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Biosynthese und Metabolismus
Der Organismus der meisten Lebewesen ist in der Lage, Guanin selbst zu synthetisieren; da dieser Stoffwechselweg sehr energieaufwändig ist, kann der Körper über den Salvage Pathway das Purin-Derivat Guanin auch wiederverwenden, aus abzubauenden Nukleinsäure-Molekülen ausschneiden und bei Bedarf wieder an Ribose binden.
Der Abbau des Guanins erfolgt zu Xanthin und weiter zu Harnsäure.
Bei Reptilien und Vögeln stellt Guanin neben Harnsäure eine wichtige Ausscheidungsform für Stickstoff (hauptsächlich aus dem Protein- und Nukleotidabbau) dar. Das Ausscheidungsprodukt ist pastös und beinhaltet wenig Wasser, so dass dessen Masse nicht mitgeführt werden muss, was die Flugfähigkeit unterstützt. Dies ist energiesparender, als die im Guanin enthaltene chemische Energie zu nutzen. Aus demselben Grund scheiden auch Fledermäuse Guanin aus. Ausgeschiedenes Guanin (und Harnsäure) bildet nach Verwitterung den Guano, besonders auf kalkreichen Böden.
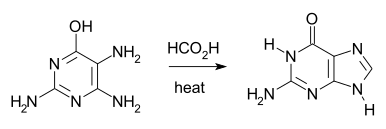
Darstellung
Eine Darstellung erfolgt über die Traube-Synthese durch ein Erhitzen von 2,4,5-Triamin-1,6-dihydro-6-oxopyrimidin (als Sulfat) mit Ameisensäure über mehrere Stunden.
Eigenschaften
Guanin ist ein weißer bis gelblich weißer Feststoff, der bei über 365 °C unter Zersetzung schmilzt. Es ist unlöslich in Wasser, löslich in verdünnten Säuren und Laugen, schwerlöslich in Ethanol und Diethylether.
Geschichte und biologische Bedeutung
1871 berichtete Friedrich Miescher von einer phosphorhaltigen Substanz, die er aus den Zellkernen von Erythrozyten isolieren konnte. Er nannte sie Nuklein.[6] 1883 konnte der spätere Nobelpreisträger Albrecht Kossel beweisen, dass Guanin das Spaltprodukt eines aus Gänseblut gewonnenen Nukleins ist.[7] Guanin war seit 1844 als eine stickstoffreiche Base bekannt, die sich in den Exkrementen von Säugetieren und Vögeln anreichert. Erste Erkenntnisse zum Vorkommen des Guanins im Nuklein gab es schon seit 1874. Sie gingen auf den Schweizer Chemiker Jules Piccard zurück, der auf Bitte von Friedrich Miescher hin das „Nuclein des Lachsspermas“ (Nukleinsäure) untersucht hatte.[8] Kossel wies 1891 erstmals nach, dass Guanin ein Spaltprodukt der aus Hefe gewonnenen Nukleinsäure ist.[9]
Guanin kann Bestandteil der DNA, RNA oder verschiedener Nukleoside und Nukleotide sein.
Nukleoside
Über das N9-Atom des Fünfringes kann Guanin an das C1-Atom der Ribose N-glycosidisch gebunden werden; man spricht dann von einem Nukleosid, dem Guanosin. Bei der Bindung an Desoxyribose entsteht das Nukleosid Desoxyguanosin.
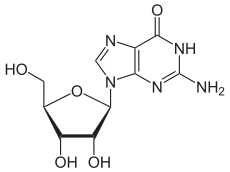
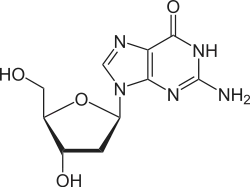
Guanosin, G Desoxyguanosin, dG
Nukleotide
Über die Phosphorylierung des Guanosins am C5-Atom der Ribose gelangt man zu den wichtigen Nukleotiden Guanosinmonophosphat (GMP), Guanosindiphosphat (GDP) und Guanosintriphosphat (GTP), bzw. analog für das Desoxyguanosin zu Desoxyguanosinmonophosphat (dGMP), Desoxyguanosindiphosphat (dGDP) und Desoxyguanosintriphosphat (dGTP).
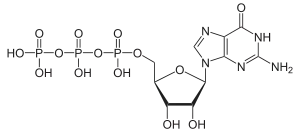 Strukturformel von GTP
Strukturformel von GTP
Bestandteil der DNA und RNA
In der DNA-Doppelhelix bildet Guanin über die Oxogruppe, das N1-Atom und die Aminogruppe drei Wasserstoffbrücken mit der zugehörigen Cytosin-Base des komplementären Stranges aus.
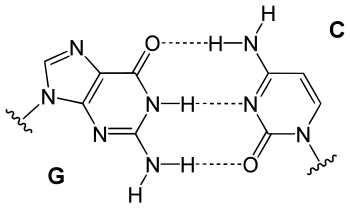 Strukturformel eines G-C-Basenpaars
Strukturformel eines G-C-Basenpaars
Pathophysiologie
Bei Störungen des Salvage Pathway, besonders bei einem Defekt des Enzyms Hypoxanthin-Guanin-Phosphoribosyl-Transferase (HGPRT), kommt es zum Krankheitsbild des Lesch-Nyhan-Syndroms.
Bei einer zu hohen Menge an metabolisiertem Guanin kann die entstehende, unphysiologisch hohe Menge an Harnsäure (Hyperurikämie) in der Niere, den ableitenden Harnwegen oder in bradytrophen Geweben (vor allem Gelenkkapseln) auskristallisieren und zu Harnsteinen oder Gicht führen.
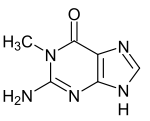
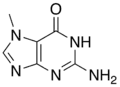
Verwandte Verbindungen
 |
 |
 |
-dimethylguanine.svg.png.webp) |
 |
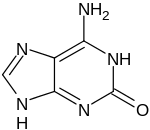 |
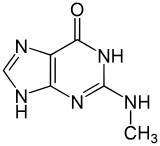
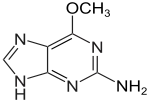
| 1-Methylguanin | 7-Methylguanin | N2-Methylguanin | N2,N2-Dimethylguanin | 6-O-Methylguanin | Isoguanin |
Einzelnachweise
- Eintrag zu GUANINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. September 2021
- Eintrag zu CI 75170 in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. März 2020.
- Eintrag zu Guanin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- Datenblatt Guanin (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Eintrag zu Guanin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Februar 2017. (JavaScript erforderlich)
- Miescher, F.: Über die chemische Zusammensetzung der Eiterzellen. In: Hoppe-Seyler`s medizinisch-chemische Untersuchungen, Heft 4, 1871, S. 441–460.
- Kossel, A.: Zur Chemie des Zellkerns. In: Zeitschrift für physiologische Chemie, Band 7, 1882-83, S. 7.
- Piccard, J.: Über Protamin, Guanin und Sarkin, als Bestandtheile des Lachsspermas. In: Berichte der Deutschen Chemischen Gesellschaft, 1874, S. 1714.
- Kossel, A.: Über die chemische Zusammensetzung der Zelle. Vortrag in: Archiv für Anatomie und Physiologie. Physiologische Abteilung, 1891, S. 178.
Weblinks
- Eintrag zu Guanine in der Human Metabolome Database (HMDB), abgerufen am 18. November 2013.
