Serratia
Bei Bakterien der Gattung Serratia handelt es sich um eine Gruppe gramnegativer, fakultativ anaerober Stäbchenbakterien aus der Familie der Enterobakterien (Enterobacteriaceae). Im Deutschen werden sie als Serratien bezeichnet. Eine bekannte Art aus der Gattung ist Serratia marcescens, deren Merkmal die rote Pigmentierung ist. Serratia-Arten kommen, wie auch andere Enterobakterien, im Darm vor, sie sind aber ebenso in anderen Lebensräumen ubiquitär verbreitet. Sie kommen im Wasser, im Boden, bei Tieren und auf Pflanzen vor. Sie können für manche Insekten pathogen sein, andererseits sind auch Fälle von Symbiosen bekannt. Viele Serratia-Arten sind für den Menschen apathogen oder nur selten als Krankheitserreger (etwa von Bakteriämien und Lungenentzündungen[1]) nachgewiesen worden. Es wurde jedoch vereinzelt über nosokomiale Infektionen in Kinderabteilungen und Intensivstationen berichtet. Die Systematik innerhalb der Gattung Serratia hat sich seit Beginn des 20. Jahrhunderts mehrfach verändert. In der Vergangenheit wurden oftmals Bakterien mit einer roten oder rosa Färbung der Kolonien als Serratia-Art klassifiziert. Aktuell (Stand 2014) sind 15 verschiedene Arten bekannt.
| Serratia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
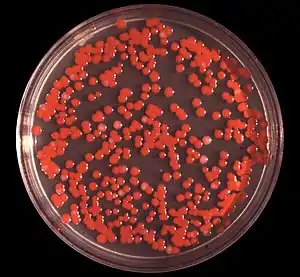
Serratia marcescens-Kolonien auf der Oberfläche eines Agargels in einer Petrischale | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Serratia | ||||||||||||
| Bizio 1823 |
Merkmale
Erscheinungsbild
Die Zellen von Serratia-Arten sind stäbchenförmig und durch Flagellen aktiv beweglich (motil). Die Gram-Färbung verläuft negativ.[2] Auf festen Nährmedien gewachsene Kolonien zeichnen sich oft durch eine rote Pigmentierung aus.[3] Verantwortlich dafür ist das von den Bakterien gebildete Prodigiosin. Die Kolonien auf einem Nährmedium, aber auch auf Brot, Polenta oder Hostien erinnern an Blutstropfen[4] (vergleiche Blutwunder). Das Phänomen wurde zuerst bei Serratia marcescens beschrieben, aber auch andere Serratia-Arten (z. B. S. plymuthica und S. rubidaea) wachsen als rot bis rosafarbene Kolonien.[5] Daneben gibt es auch nicht-pigmentierte Bakterienstämme.[3]
Wachstum und Stoffwechsel
Serratia-Arten nutzen verschiedene organische Verbindungen als Energiequelle und zum Aufbau zelleigener Strukturen, dies ist im oxidativem oder fermentativem Energiestoffwechsel möglich. Sie sind somit fakultativ anaerob und chemoorgano-heterotroph. Sie können verschiedene Kohlenhydrate unter Gas- und Säurebildung verwerten.[2] Bezüglich der Produkte, die bei der Gärung gebildet werden, gehören sie zu den Enterobacteriaceae, die eine 2,3-Butandiolgärung durchführen.[3] Die Substrate, die sie dabei verwenden, können zur Identifizierung von Serratia-Arten bzw. Unterscheidung von anderen Vertretern der Enterobacteriaceae verwendet werden (siehe Abschnitt Nachweise). Wie für Enterobacteriaceae typisch, verlaufen der Katalase-Test positiv und der Oxidase-Test negativ.[3] Der besondere Geruch, den S. odorifera, S. ficaria und einige Stämme von S. rubidaea verbreiten, wird durch von den Bakterien produzierte Alkyl-Methoxypyrazine (Derivate des Pyrazins) verursacht. Die Hauptkomponente ist 3-Isopropyl-2-methoxy-5-methylpyrazin.[5] Eine ähnliche Verbindung, 2-Isopropyl-3-methoxypyrazin, kommt in Kartoffeln vor, wo sie die „erdige“ Note im Geruch und Geschmack hervorruft. Auch der Geruch dieser Serratia-Arten wird als kartoffelartig beschrieben.[5]
Für die Kultivierung sind einfache Nährmedien geeignet, es sind keine besonderen Wachstumsfaktoren notwendig. Serratia-Arten sind mesophil, Wachstum erfolgt in einem Temperaturbereich von 20–37 °C, dabei sind nach eintägiger Inkubation bereits Kolonien sichtbar. Für biochemische Nachweisreaktionen wird die Inkubation bei 30 °C empfohlen, auch die Pigmentbildung erfolgt eher bei 30 °C als bei 37 °C. Einige Serratia-Arten sind psychrotolerant und wachsen auch noch bei 5 °C (z. B. S. ficaria, S. fonticola und S. odorifera). Andere Arten, wie S. entomophila und S. marcescens wachsen noch bei 40 °C. Ein Natriumchlorid-Gehalt bis zu 40 g/L im Nährmedium wird toleriert. Wachstum erfolgt bis zu einem pH-Wert von 9.[6]
Chemotaxonomie
Der GC-Gehalt, also der Anteil der Nukleinbasen Guanin und Cytosin in der Bakterien-DNA, liegt bei 52–60 Molprozent.[3] Bestandteile der Bakterienzelle wirken als Antigene, von diagnostischer Bedeutung sind die somatischen O-Antigene und die H-Antigene[7] (vergleiche das bei den Salmonellen angewendete Kauffmann-White-Schema). Die in den Membranlipiden vorkommenden Fettsäuren sind hauptsächlich Moleküle mit einer geraden Zahl von Kohlenstoffatomen und keiner Doppelbindung (gesättigte Fettsäuren), wie Myristinsäure (Tetradecansäure, C14:0), Palmitinsäure (Hexadecansäure, C16:0) und Stearinsäure (Octadecansäure, C18:0), auch eine Fettsäure mit Hydroxygruppe (3-Hydroxy-tetradecansäure) kommt vor.[5]
Pathogenität
Viele Serratia-Arten sind apathogen oder nur selten als Krankheitserreger nachgewiesen worden. Nosokomiale Infektionen in Kinderabteilungen und Intensivstationen kamen jedoch vor, wobei Frühgeborene oder erwachsene Patienten mit eingeschränkter Immunabwehr betroffen waren.[8] Dabei handelt es sich v. a. um S. marcescens, deren Bedeutung als nosokomialer Erreger wächst.[9]
S. entomophila, S. ficaria, S. fonticola, S. odorifera, S. plymuthica, S. quinivorans und S. ureilytica sind apathogen und werden durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 1 zugeordnet.[10]
Nachweise

Zur Kultivierung von Serratia sind keine besonderen Wachstumsfaktoren notwendig, so dass einfache Nährmedien auf Pepton-Basis, wie Trypton-Soja-Agar geeignet sind. Es sind auch Minimalmedien definiert, die genau die chemischen Verbindungen enthalten, die für das Wachstum nötig sind. Außerdem sind Serratia-Arten, mit Ausnahme von S. fonticola, resistent gegenüber Thalliumsalzen. Für die Isolierung von Serratia-Arten aus Umweltproben wird daher das sogenannte CT-Medium empfohlen, ein Minimalmedium, das Caprylsäure als Energie- und Kohlenstoffquelle und Thallium(I)-sulfat enthält.[11] Biochemische Merkmale, wie beispielsweise die vorhandenen Enzyme und die daraus resultierenden Stoffwechseleigenschaften können in einer Bunten Reihe zur Identifizierung von Serratia-Arten bzw. Unterscheidung von anderen Vertretern der Enterobacteriaceae verwendet werden.
Zu den Kohlenhydraten, die sie verwerten können, gehören beispielsweise die Monosaccharide Fructose, Galactose, Glucose, Mannose und Ribose, die Disaccharide Maltose und Trehalose sowie die Zuckeralkohole Glycerin (Glycerol) und Mannitol.[6] In der Literatur wird Serratia meist als Lactose-negativ beschrieben,[2][3] bei den einzelnen Arten ergibt sich im Bezug auf die Lactoseverwertung kein einheitliches Bild. Bei mehreren Arten erfolgt die Angabe „variabel“, d. h., dass es sowohl Stämme gibt, die Lactose abbauen können, wie auch Stämme, die dies nicht können. Bei S. marcescens wird das unterschiedliche Verhalten zur Differenzierung der Biotypen genutzt. Im Allgemeinen sind lediglich S. rubidae und S. fonticola im Lactosenachweis durch Säurebildung positiv. Interessanterweise verläuft der ONPG-Test bei allen Serratia-Arten positiv.[6] Dieser biochemische Nachweis zeigt, dass sie über das Enzym β-Galactosidase verfügen, mit dem Lactose in die beiden Bestandteile Glucose und Galactose hydrolysiert wird. Tests, bei denen der Lactoseabbau über die Säurebildung detektiert wird, zeigen möglicherweise ein negatives Ergebnis, da zu wenig Säure produziert wird.
Das Enzym Urease ist nicht vorhanden,[2] lediglich S. ureilytica bildet eine Ausnahme und kann Harnstoff abbauen.[12] Serratia-Arten verfügen über Lipasen,[6] proteolytische Enzyme, mit denen beispielsweise Gelatine hydrolysiert wird[2] und das Enzym Desoxyribonuklease (DNase).[3] Einige Stämme von S. fonticola zeigen bei entsprechenden Tests jedoch negative Ergebnisse.[6] Es erfolgt keine Bildung von Schwefelwasserstoff (H2S).[6] Nitrat wird zu Nitrit reduziert.[3] Die Voges-Proskauer-Reaktion verläuft positiv, es wird Acetoin gebildet.[2] Hingegen verläuft der Indol-Test negativ,[2] lediglich S. odorifera ist in der Lage, Indol zu bilden.[6]
Um die einzelnen Serratia-Arten zu identifizieren, eignen sich Tests, die auf dem Abbau verschiedener organischer Verbindungen beruhen und dabei gebildete Stoffwechselprodukte anzeigen. Dafür sind miniaturisierte Testsysteme besser geeignet als der Oxidations-Fermentations-Test. Bei den dafür zweckdienlichen Verbindungen handelt es sich beispielsweise um Adonitol, L-Arabinose, D- und L-Arabitol, Dulcitol, D-Melibiose, L-Rhamnose und D-Sorbitol.[6]
Eine serologische Unterscheidung verschiedener Stämme von S. marcescens ist gebräuchlich. Dabei werden Antikörper gegen die somatischen O-Antigene und die durch die Flagellen begründeten H-Antigene verwendet. Mehrere Serotypen (z. B. O5:H2, O5:H3 u. a.) werden zu einem Biotyp (z. B. S. marcescens Biotyp A1a) zusammengefasst. Eine Biogruppe besteht aus mehreren Biotypen (z. B. S. marcescens Biogruppe A1).[7] Diese Typisierung wird beispielsweise bei nosokomialen Infektionen genutzt, um den Infektionsweg zu ergründen.[9] Auch bei S. ficaria, S. plymuthica, S. proteamaculans und S. rubidaea gibt es darauf basierende Einteilungen der Serotypen.[7]
Systematik
Äußere Systematik
Die Gattung Serratia zählt zu der Familie der Enterobacteriaceae (Enterobakterien) in der Ordnung der Enterobacteriales, die zur Klasse der Gammaproteobacteria gehört.[13] Die Enterobacteriaceae bilden eine große Gruppe gramnegativer Bakterien, zu denen u. a. die Gattungen Citrobacter, Enterobacter, Escherichia, Klebsiella, Proteus, Raoultella, Salmonella, Shigella und Yersinia gehören, von denen einige Vertreter als Krankheitserreger von Bedeutung sind. In der Vergangenheit wurde diskutiert, Serratia aufgrund phänotyper Ähnlichkeiten mit Klebsiella und weiteren Gattungen zum Tribus der Klebsielleae zu zählen.[14] Weitere Untersuchungen seit den 1970er Jahren zeigen jedoch, dass sich Serratia durchaus von diesen unterscheidet.[4] Die Rangstufe Tribus ist seit der Revision (1990) des International Code of Nomenclature of Bacteria (Bakteriologischer Code) nicht mehr üblich.
Innere Systematik
Bartolomeo Bizio beschrieb 1823 rot-pigmentierte Mikroorganismen, die er auf Polenta entdeckt hatte, und bezeichnete sie als Serratia marcescens.[4] Dies wird als Erstbeschreibung der Art und der Gattung angesehen.[13] Bizio wählte den Gattungsnamen zu Ehren von Serafino Serrati, einem italienischen Physiker.[13][15] Zu Beginn des 20. Jahrhunderts waren mehr als 70 unterschiedlich benannte Serratia-Arten bekannt. Dabei ließ sich zum damaligen Zeitpunkt nicht unterscheiden, ob es sich um Arten oder Synonyme einer Art handelt, ihr gemeinsames Merkmal war die rote oder rosa Farbe der Kolonien. Immerhin 23 Arten wurden in der Erstauflage des Bergey's Manual of Systematic Bacteriology von 1923 genannt. Die Anzahl der als gesichert geltenden Arten von Serratia nahm seitdem ab, in den 1960er und 1970er Jahren nahm man an, S. marcescens sei die einzige Art der Gattung.[4]
Mit Hilfe moderner Untersuchungsmethoden, wie der DNA-DNA-Hybridisierung, konnte jedoch gezeigt werden, dass sich verschiedene Bakterienstämme deutlich voneinander unterscheiden, so dass die Etablierung von verschiedenen Arten gerechtfertigt erscheint. In dieser Übergangsphase wurde auch eine numerische Taxonomie verwendet, z. B. die Bezeichnung als Serratia III, auch die Einordnung als Biotyp oder Biogruppe war gängige Praxis.[4] In der auf dem neu organisierten Bakteriologischen Code basierenden Approved Lists of Bacterial Names (engl. für „anerkannte Listen der Bakteriennamen“) von 1980 wurden schließlich acht Arten anerkannt: S. fonticola, S. liquefaciens, S. marcescens, S. marinorubra, S. odorifera, S. plymuthica, S. proteamaculans und S. rubidaea.[16]
Aktuell (Stand 2014) werden in der Gattung folgende Arten und Unterarten geführt, S. marcescens ist die Typusart.[13]
- Serratia entomophila Grimont et al. 1988[17]
- Serratia ficaria Grimont et al. 1981[18]
- Serratia fonticola Gavini et al. 1979[19]
- Serratia glossinae Geiger et al. 2010[20]
- Serratia grimesii Grimont et al. 1983[21]
- Serratia liquefaciens (Grimes & Hennerty 1931) Bascomb et al. 1971[22][21]
- Serratia marcescens Bizio 1823
- Serratia marcescens subsp. marcescens (Bizio 1823) Ajithkumar et al. 2003
- Serratia marcescens subsp. sakuensis Ajithkumar et al. 2003
- Serratia nematodiphila Zhang et al. 2009[23]
- Serratia odorifera Grimont et al. 1978[24]
- Serratia plymuthica (Lehmann & Neumann 1896) Breed et al. 1948
- Serratia proteamaculans (Paine & Stansfield 1919) Grimont et al. 1978
- Serratia quinivorans corrig. (Grimont et al. 1983) Ashelford et al. 2002[25]
- Serratia rubidaea (Stapp 1940) Ewing et al. 1973[26] = Serratia marinorubra ZoBell & Upham 1944
- Serratia symbiotica Sabri et al. 2011, zuvor im Status eines Candidatus geführt[27]
- Serratia ureilytica Bhadra et al. 2005[12]
Die Frage, ob es sich bei S. marinorubra und S. rubidaea (beide sind auf der Approved Lists of Bacterial Names geführt) um zwei verschiedene Arten handelt, beschäftigte die Mikrobiologen über einen längeren Zeitraum. Auf der Liste war irrtümlich ein falscher Typusstamm für S. marinorubra angegeben worden, der identisch mit dem von S. rubidaea ist. Nach den Regeln des Bakteriologischen Codes sind beide homotypische Synonyme, wobei der Name S. marinorubra Priorität hat (er ist älter).[4][13] Auch S. liquefaciens und S. proteamaculans waren Gegenstand taxonomischer Debatten. Untersuchungen von Grimont & Grimont haben jedoch gezeigt, dass es sich um zwei verschiedene Spezies handelt.[22] Durch sie wurde 1983 außerdem eine Unterart von S. proteamaculans entdeckt, die jedoch 2002 als S. quinivorans in den Artstatus erhoben wurde.[25] Bei Serratia profundus handelt es sich um eine nicht anerkannte Art, deren Namen nicht gültig publiziert wurde.[28]
Vorkommen und Ökologie
Serratia-Arten sind beinahe ubiquitär verbreitet. Sie kommen im Wasser, im Boden, bei Tieren und auf Pflanzen vor. Weniger häufig als andere Enterobacteriaceae besiedeln sie auch den menschlichen Darm.[29] Bezüglich der Habitate gibt es durchaus Unterschiede bei den Arten.
Wasser
Süßwasser ist ein wichtiges Habitat von S. fonticola,[19] S. grimesii, S. liquefaciens, S. marcescens, S. plymuthica und S. rubidaea (bzw. als S. marinorubra bezeichnet).[4] S. ureilytica wurde im indischen Fluss Torsa entdeckt.[12] Serratia-Stämme, die Prodigiosin produzieren, sind toxisch für Protozoen, was einen Vorteil für die Bakterien bei der Besiedlung von Wasser und Boden darstellt. Weitere Untersuchungen haben ergeben, dass die pigmentierten Stämme eher in Brunnen- oder Quellwasser zu finden sind, während nicht-pigmentierte Stämme eher für belastetes Flusswasser typisch sind.[4]
Insekten und andere Invertebrata
Serratia-Arten sind häufig bei verschiedenen Insekten zu finden. Beispiele dafür gibt es in den Ordnungen der Heuschrecken (Orthoptera), Termiten (Isoptera), Käfer (Coleoptera), Schmetterlinge (Lepidoptera), Hautflügler (Hymenoptera) und Zweiflügler (Diptera). Hauptsächlich nachgewiesen wurden dabei S. liquefaciens, S. marcescens und S. plymuthica. Serratia-Arten können für manche Insekten pathogen sein, das von ihnen produzierte Enzym Chitinase wird als Virulenzfaktor angesehen. Allerdings werden Serratia-Arten auch bei gesunden Insekten, beispielsweise im Darm, gefunden.[30] Auch Symbiosen von Bakterien und Insekten sind bekannt. Bei der Entwicklung von Tetanops myopaeformis, einer Fliegenart, findet man die Larven (Maden) auf Zuckerrüben. In allen Entwicklungsstadien des Insekts sind S. liquefaciens und S. marcescens vorhanden. Man nimmt an, dass sie bei der Metamorphose durch Chitinabbau des Pupariums (Puppenhülle) mitwirken.[31]
S. symbiotica ist ein Endosymbiont der Schwarzen Bohnenlaus (Aphis fabae). Das Bakterium wird dabei nicht als obligater Symbiont angesehen, sondern als ein nicht unbedingt notwendiger (fakultativer bzw. sekundärer) Symbiont, der Nutzen aus der Lebensgemeinschaft zieht. S. symbiotica lässt sich auch in-vitro kultivieren, was bei Endosymbionten wegen der speziellen Anpassung ihres Stoffwechsels nicht immer möglich ist. Sie tritt bei mehreren Vertretern der Röhrenblattläuse (Aphididae) auf und ist im Cytoplasma bestimmter Zellen zu finden. Sie spielt eine Rolle beim Schutz gegen Parasiten.[27]
In Neuseeland ist Costelytra zealandica als Pflanzenschädling des Weidelandes von Bedeutung. Die Larven von Costelytra zealandica (grass grubs, „Grasmaden“) vermehren sich im Gras oder Klee und ernähren sich davon. Nach vier bis sechs Jahren nimmt ihre Population dramatisch ab, was auf eine als amber disease bezeichnete Erkrankung zurückgeführt wird. Untersuchungen haben gezeigt, dass S. entomophila und S. proteamaculans dafür verantwortlich sind, die den Darm der Larven besiedeln.[17] Suspensionen von S. entomophila werden auf den Weideflächen ausgebracht, um die Pflanzenschädlinge zu bekämpfen.[30]
S. glossinae wurde im Mitteldarm der Tsetsefliege Glossina palpalis gambiensis gefunden. Glossina-Arten sind Vektoren für Protozoen der Gattung Trypanosoma, die die Schlafkrankheit verursachen. Die mikrobiellen Flora von Glossina-Arten wird erforscht, um mit Hilfe der Bakterien die Übertragung der Protozoen zu verhindern oder die Tsetsefliege zu schädigen.[20] S. nematodiphila lebt in Symbiose mit der Fadenwurm-Art Heterorhabditidoides chongmingensis, die ihrerseits pathogen für Insekten ist.[23]
Vertebrata
Auch bei den Wirbeltieren (Vertebrata) sind Serratia-Arten vertreten, manchmal wurde ein Zusammenhang mit Infektionskrankheiten hergestellt, oftmals sind sie apathogener Teil der mikrobiellen Flora.[32] Die Isolierung von kleineren Säugetieren und des sie umgebenden Territoriums – Pflanzen und Erdboden – gelang besonders häufig bei S. liquefaciens und S. proteamaculans.[4] Chronische Infektionen bei wechselwarmen Tieren werden manchmal mit Serratia in Verbindung gebracht. Serratia-Arten wurden jedoch auch bei gesunden Echten Schmuckschildkröten (Pseudemys scripta elegans), anderen Schildkröten und Geckos nachgewiesen. In einer systematischen Untersuchung von Kotproben europäischer Wildvögel wurde S. fonticola mehrfach gefunden. Bei Etwa 40 % der in Fallen gefangenen Nagetiere und Spitzmäuse wurden Stämme von Serratia im Darm gefunden, ohne dass die Obduktion der Tiere Anzeichen einer Infektion ergab.[32]
Pflanzen
S. proteamaculans wurde 1919 auf der tropischen Pflanze Königs-Protea (Protea cynaroides) aus der Gattung der Zuckerbüsche (Protea) entdeckt und mit einer Blattkrankheit (englisch leaf spot disease) in Verbindung gebracht. Ähnliche Läsionen der Blätter von Protea, Tabakpflanzen (Gattung Nicotiana) und Bohnenpflanzen lassen sich auch durch S. marcescens und S. rubidaea erzeugen und werden als Hypersensitivitätsreaktion gedeutet. S. ficaria wurde bei der Echten Feige (Ficus carica) entdeckt.[18] Zusammen mit bestimmten Biotypen von S. marcescens ist sie Bestandteil der mikrobiellen Flora der Feigenwespe Blastophaga psenes (Feigengallwespe). Durch die komplexen Vorgänge bei der Bestäubung (neben der Feigengallwespe sind auch zwei Feigenvarietäten erforderlich, um essbare Früchte zu erhalten), lassen sich die beiden Serratia-Arten in dem Insekt, den gebildeten Gallen und der Frucht finden.[4]
S. rubidaea ist bei typischerweise bei Kokosnüssen zu finden, im Fruchtfleisch und daraus hergestellter Kokosmilch.[30] S. quinivorans wurde von Zuckerrüben und ihrer Rhizosphäre isoliert.[25] Mehrere Serratia-Arten (neben S. proteamaculans vor allem S. liquefaciens) wurden auch noch auf vielen anderen Pflanzen nachgewiesen, wo sie als Reduzenten (Destruenten) dazu beitragen, organisches Material abzubauen. So sind sie auch auf pflanzlichen Lebensmitteln zu finden, beispielsweise Kopfsalat, Blumenkohl und Rosenkohl. Eine mögliche Übertragung von pathogenen Serratia-Arten im Krankenhaus über die gereichte Rohkost wird diskutiert.[30]
Medizinische Bedeutung
Humanmedizin
Die Arten S. marcescens und S. liquefaciens sind von humanmedizinischer Bedeutung, S. marcescens vor allem im Zusammenhang mit nosokomialen Infektionen („Krankenhausinfektionen“). Sie gilt als opportunistischer Erreger, der bei Patienten mit geschwächtem Immunsystem Infektionen verursachen kann.[9] Dabei handelt es sich um Sepsis, Wundinfektionen, Endokarditis, Harnwegsinfekte und Infektionen des Respirationstraktes.[29] Zur antibiotischen Therapie kommen Imipenem, Meropenem, Ertapenem, Ciprofloxacin oder Levofloxacin zum Einsatz, alternativ auch Gentamicin und Amikacin.[33]
Veterinärmedizin
Geflügel und somit auch als Nahrungsmittel verwendetes Geflügelfleisch oder Eier können mit Serratia-Arten kontaminiert sein, so wurde beispielsweise S. marcescens im Verdauungstrakt von Hennen nachgewiesen, ohne dass die Tiere dadurch beeinträchtigt erschienen.[32] Außerdem spielt Serratia eine untergeordnete Rolle als Krankheitserreger der Mastitis bei Kühen. Verschiedene Untersuchungen ergaben, dass sie in 0,2–1,5 % der Fälle als Krankheitsursache diagnostiziert wurde. Auch in Milch, vor allem Rohmilch, oder in Milchprodukten wurden gelegentlich Serratia-Arten nachgewiesen, vor allem S. grimesii und S. liquefaciens.[32]
Weblinks
Quellen
Literatur
- Francine Grimont, Patrick A. D. Grimont: The Genus Serratia (Chapter 3.3.11). In: Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6: Proteobacteria: Gamma Subclass. 3. Auflage. Springer-Verlag, New York 2006, ISBN 978-0-387-25496-8, S. 219–244, doi:10.1007/0-387-30746-x_11.
Einzelnachweise
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 267.
- Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3, S. 307–313.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 3-8274-0566-1, S. 531–536.
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 219–220.
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 228–229.
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 230–233.
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 233–236.
- jp/nhh/dpa: Nach Tod eines Frühchens in Berlin: Ein mit Serratien-Keimen infiziertes Baby außer Lebensgefahr. In: Focus. 22. Oktober 2012, abgerufen am 25. Oktober 2012.
- Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 5. Auflage. Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-125315-6, S. 411.
- TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Webseite der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. April 2012, S. 200, abgerufen am 4. November 2014.
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 228–229.
- B. Bhadra, P. Roy, R. Chakraborty: Serratia ureilytica sp. nov., a novel urea-utilizing species. In: International Journal of Systematic and Evolutionary Microbiology. Band 55, Nr. 5, September 2005, S. 2155–2158, ISSN 1466-5026. doi:10.1099/ijs.0.63674-0. PMID 16166724.
- Jean Euzéby, Aidan C. Parte: Genus Serratia. In: List of Prokaryotic names with Standing in Nomenclature (LPSN). Abgerufen am 8. November 2014.
- S. Bascomb u. a.: Numerical Classification of the Tribe Klebsielleae. In: Journal of General Microbiology. Band 66, Nr. 3, Juni 1971, S. 279–295, ISSN 0022-1287. doi:10.1099/00221287-66-3-279.
- B. Bizio: Lettera di Bartolomeo Bizio al chiarissimo canonico Angelo Bellani sopra il fenomeno della polenta porporina. In: Biblioteca Italiana o sia Giornale di Letteratura, Scienze e Arti (Anno VIII). Band 30, 1823, S. 275–295.
- Approved Lists of Bacterial Names. In: V. B. D. Skerman, Vicki McGowan, P. H. A. Sneath (Hrsg.): International Journal of Systematic Bacteriology. Band 30, Nr. 1, 1980, S. 362, doi:10.1099/00207713-30-1-225 (PDF, 17,0 MB [abgerufen am 13. April 2014]). PDF, 17,0 MB (Memento des Originals vom 22. Januar 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- P. A. D. Grimont, T. A. Jackson u. a.: Serratia entomophila sp. nov. Associated with Amber Disease in the New Zealand Grass Grub Costelytra zealandica. In: International Journal of Systematic Bacteriology. Band 38, Nr. 1, Januar 1988, S. 1–6, ISSN 0020-7713. doi:10.1099/00207713-38-1-1.
- P. A. D. Grimont, F. Grimont, M. P. Starr: Serratia ficaria sp. nov., a bacterial species associated with Smyrna figs and the fig waspBlastophaga psenes. In: Current Microbiology. Band 2, Nr. 5, September 1979, S. 277–282, ISSN 0343-8651. doi:10.1007/BF02602859.
- F. Gavini, C. Ferragut u. a.: Serratia fonticola, a New Species from Water. In: International Journal of Systematic Bacteriology. Band 29, Nr. 2, April 1979, S. 92–101, ISSN 0020-7713. doi:10.1099/00207713-29-2-92.
- A. Geiger, M. L. Fardeau u. a.: Serratia glossinae sp. nov., isolated from the midgut of the tsetse fly Glossina palpalis gambiensis. In: International Journal of Systematic and Evolutionary Microbiology. Band 60, Nr. 6, Juni 2010, S. 1261–1265, ISSN 1466-5026. doi:10.1099/ijs.0.013441-0. PMID 19667382.
- P. A. D. Grimont, F. Grimont, K. Irino: Biochemical characterization of Serratia liquefaciens sensu stricto, Serratia proteamaculans, and Serratia grimesii sp. nov. In: Current Microbiology. Band 7, Nr. 2, März 1982, S. 69–74, ISSN 0343-8651. doi:10.1007/BF01568416.
- P. A. D. Grimont, F. Grimont, M. P. Starr: Comment on the Request to the Judicial Commission to Conserve the Specific Epithet liquefaciens over the Specific Epithet proteamaculans in the Name of the Organism Currently Known as Serratia liquefaciens. In: International Journal of Systematic Bacteriology. Band 31, Nr. 2, April 1981, S. 211–212, ISSN 0020-7713. doi:10.1099/00207713-31-2-211.
- C. X. Zhang, S. Y. Yang u. a.: Serratia nematodiphila sp. nov., associated symbiotically with the entomopathogenic nematode Heterorhabditidoides chongmingensis (Rhabditida: Rhabditidae). In: International Journal of Systematic and Evolutionary Microbiology. Band 59, Nr. 7, Juli 2009, S. 1603–1608, ISSN 1466-5026. doi:10.1099/ijs.0.003871-0. PMID 19578149.
- P. A. D. Grimont, F. Grimont u. a.: Deoxyribonucleic Acid Relatedness Between Serratia plymuthica and Other Serratia Species, with a Description of Serratia odorifera sp. nov. (Type Strain: ICPB 3995). In: International Journal of Systematic Bacteriology. Band 28, Nr. 4, Oktober 1978, S. 453–463, ISSN 0020-7713. doi:10.1099/00207713-28-4-453.
- K. E. Ashelford, J. C. Fry u. a.: Characterization of Serratia isolates from soil, ecological implications and transfer of Serratia proteamaculans subsp. quinovora Grimont et al. 1983 to Serratia quinivorans corrig., sp. nov. In: International Journal of Systematic and Evolutionary Microbiology. Band 52, Nr. 6, November 2002, S. 2281–2289, ISSN 1466-5026. doi:10.1099/00207713-52-6-2281. PMID 12508898.
- W. H. Ewing, B. R. Davis u. a.: Biochemical Characterization of Serratia liquefaciens (Grimes and Hennerty) Bascomb et al. (Formerly Enterobacter liquefaciens) and Serratia rubidaea (Stapp) comb. nov. and Designation of Type and Neotype Strains. In: International Journal of Systematic Bacteriology. Band 23, Nr. 3, Juli 1973, S. 217–225, ISSN 0020-7713. doi:10.1099/00207713-23-3-217.
- A. Sabri, P. Leroy u. a.: Isolation, pure culture and characterization of Serratia symbiotica sp. nov., the R-type of secondary endosymbiont of the black bean aphid Aphis fabae. In: International Journal of Systematic and Evolutionary Microbiology. Band 61, Nr. 9, September 2011, S. 2081–2088, ISSN 1466-5034. doi:10.1099/ijs.0.024133-0. PMID 20870890.
- Taxonomy Browser Serratia. In: Website National Center for Biotechnology Information (NCBI). Abgerufen am 6. November 2014.
- S. Suerbaum, J. Bockemühl, H. Karch: Enterobakterien. In: Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum (Hrsg.): Medizinische Mikrobiologie und Infektiologie. 6. Auflage. Springer Verlag, Heidelberg 2009, ISBN 978-3-540-46359-7, S. 237–268 (hier 249).
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 222–223.
- K. L. Iverson, M. C. Bromel u. a.: Bacterial Symbionts in the Sugar Beet Root Maggot, Tetanops myopaeformis (von Röder). In: Applied and Environmental Microbiology. Band 47, Nr. 1, Januar 1984, S. 22–27, ISSN 0099-2240. PMID 16346457. PMC 239605 (freier Volltext).
- F. Grimont, P. A. D. Grimont: The Genus Serratia. In: The Prokaryotes. A Handbook on the Biology of Bacteria, Volume 6. 2006, S. 223–225.
- Marianne Abele-Horn (2009).