Mannit
Mannit (der Mannit), auch (das) Mannitol, ist ein Zuckeralkohol und leitet sich strukturell von der Mannose ab. Er kommt in der Natur als D-Mannitol vorwiegend in Salzpflanzen (Halophyten), aber auch in Pilzen, Algen und Tieren vor.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
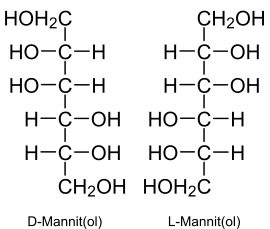 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Mannitol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H14O6 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, süß schmeckende Kristalle[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 182,17 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,52 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
13,5[4] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (216 g·l−1 bei 25 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Der Name stammt von Manna, und konkret vom süßen Saft der Manna-Esche (Fraxinus ornus L.). Der eingetrocknete Saft der Manna-Esche enthält 13 % Mannit.
Mannit wird besonders in Braunalgen (bis zu 40 % der Trockenmasse), Pilzen, Flechten, Ölbaumgewächsen und Braunwurzgewächsen akkumuliert. Bekannte Pflanzen mit hohen Mannitgehalten sind Feigen und Olivenbäume. Mannit kommt auch im Saft der Lärche sowie in Meeresalgen der Gattung Laminaria (der Gehalt kann bei bis zu 20 % liegen) vor.
Mannit wird aus Fructose durch Hydrierung (wie z. B. andere Polyole Sorbit und Maltit) gewonnen. In der Weinherstellung gilt der Mannitstich als Weinfehler.
Verwendung
Mannit findet als Zuckeraustauschstoff (Zusatzstoffnummer E 421) Verwendung. Bezogen auf Saccharose hat eine 10%ige Lösung eine Süßkraft von 50–69 %.[7][8] Mannit wird ferner als pharmazeutischer Hilfsstoff (u. a. zur Tablettenherstellung) und als Arzneistoff in der Pharmaindustrie verwendet. Er wird auch als Verschnittstoff für Heroin und andere Drogen benutzt.
Therapeutische Verwendung
Mannit ist das am häufigsten verwendete Osmodiuretikum. Es wird im menschlichen Organismus nicht verstoffwechselt. Mannit wird unverändert über die Nierenkörperchen filtriert, ohne dass es im weiteren Verlauf des Nierenkanälchens zurück resorbiert wird. Dadurch wird Wasser im frisch gebildeten Harn (Primärharn) osmotisch zurückgehalten, welches normalerweise rückresorbiert worden wäre. Die Wasserausscheidung wird erhöht. Angezeigt ist Mannit zur Vorbeugung gegen akutes Nierenversagen prärenaler Ursache (etwa bei Blut- und Flüssigkeitsverlusten nach Operationen, Traumen, Schockzuständen, Verbrennungen) sowie zur Hirn- und Augendrucksenkung und beschleunigten Diurese bei Vergiftungen.
Mannit wird ebenfalls als mildes Abführmittel (Laxans) verwendet.
Zur Vorbereitung von MRT-Untersuchungen des Dünndarms kann eine Mannitol-Lösung als Kontrastmittel verwendet werden. Auch in der Computertomografie wird Mannitol-Lösung als negatives Kontrastmittel zur Kontrastierung des Magen-Darm-Traktes verabreicht.
In der Entwicklung ist ein Trockenpulverinhalat zur verbesserten Verflüssigung der Schleimschicht in den Bronchien bei einer Mukoviszidose oder der Atemwegserkrankung COPD.[9] Darin ersetzt Mannit teilweise die Funktion des durch die Chloridsekretionsstörung fehlenden Salzes und erhöht durch eine Steigerung der Konzentration wasseranziehender gelöster Teilchen den Flüssigkeitsgehalt des periziliären Flüssigkeitsfilmes, der für die Funktion der Zilien (Flimmerhärchen) und den Abtransport der darauf liegenden Schleimschicht unerlässlich ist. Außerdem soll Mannit die Viskosität des Schleims günstig beeinflussen und die Wirkung der Zilien stimulieren. Phase 2-Studien laufen bei Mukoviszidose, Phase 3-Studien bei COPD (Stand Januar 2006).
Verwendung in mikrobiologischen Testverfahren
In der Mikrobiologie wird häufig Mannit-Rhodanid-Agar verwendet, um z. B. Azotobacter oder Staphylococcus anzureichern. Dazu wird Erde auf den stickstofffreien Agar (N2-Fixierer) aufgetragen. Die Inkubation erfolgt im Dunkeln bei 30 °C. Man ist so in der Lage, aerobe Säurebildner nachzuweisen (Bromthymolblau erfährt einen Farbumschlag von blau nach gelb).
Verwendung als Sprengstoff
Mannitolhexanitrat ist ein selten gebrauchter Sprengstoff und Initialsprengstoff. Aufgrund seiner Empfindlichkeit ist er überwiegend durch handhabungssicherere Sprengstoffe ersetzt worden.
Mannitsynthese aus Mannose
Nicht mehr üblich ist die industrielle Herstellung von künstlichen Harzen aus Mannit. Dabei wird Mannit über Reduktion von Mannose gewonnen. Dazu wird Zink in Schwefelsäure in Gegenwart von Mannose umgesetzt. Dabei entstehen Mannit und Zinksulfat.
Die eigentliche Reaktion ist jedoch eine Reduktion der Mannose durch den bei der Umsetzung von Zink mit Schwefelsäure entstehenden naszierenden Wasserstoff:
Handelspräparate
- Arzneimittel: Osmofundin (DE, AT), Osmosteril (DE, AT) und generische Zubereitungen.
Einzelnachweise
- Eintrag zu E 421: Mannitol in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 6. August 2020.
- Eintrag zu MANNITOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. August 2020.
- Eintrag zu Mannitol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Eintrag zu Mannitol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt D-Mannitol, 97+% bei AlfaAesar, abgerufen am 6. Dezember 2019 (PDF) (JavaScript erforderlich).
- Wissenschaft-Online-Lexika: Eintrag zu Mannit im Lexikon der Biologie, abgerufen am 8. April 2009.
- Kurt Rosenplenter, U. Nöhle (Hrsg.): Handbuch Süßungsmittel. 2. Auflage, Behr‘s Verlag, 2007, ISBN 978-3-89947-262-2, S. 431.
- Hans-Dieter Belitz, Werner Grosch und Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage, Springer, Berlin 2008; ISBN 978-3-540-73201-3, S. 263.
- Pharmaxis Ltd. (Australien): Bronchitol, abgerufen am 18. März 2013.