Antibiotikaresistenz
Antibiotikaresistenz bezeichnet Eigenschaften von Mikroorganismen wie Bakterien oder Pilzen, die ihnen ermöglichen, die Wirkung von antibiotisch aktiven Substanzen abzuschwächen oder ganz zu neutralisieren. Eine Resistenz gegen Antibiotika tritt meist in Kombination oder als Anpassung an extreme Umweltbedingungen auf: So sind Streptomyceten als bodenbewohnende Bakterien nicht nur resistent gegen viele Umwelttoxine, sondern auch gegen praktisch alle aktuell eingesetzten antibiotischen Wirkstoffe.[1] Antibiotikaproduzenten wie Streptomyceten besitzen in den meisten Fällen Resistenz gegen die von ihnen selbst erzeugten Stoffe. Weltweit starben im Jahr 2014 nach Angaben der WHO ca. 700.000 Menschen jährlich an den Folgen von Antibiotikaresistenz, mit steigender Tendenz;[2] in Deutschland ca. 6.000.[3][4]
| Klassifikation nach ICD-10 | |
|---|---|
| U82 | Resistenz gegen Beta-Laktam-Antibiotika |
| U83 | Resistenz gegen sonstige Antibiotika |
| U84 | Resistenz gegen sonstige antimikrobielle Medikamente |
| ICD-10 online (WHO-Version 2019) | |
Entstehung
Da Antibiotikaresistenzen bei Bakterien gefunden wurden, die seit vier Millionen Jahren isoliert lebten, nehmen Forscher an, dass es sich um ein zentrales, uraltes Merkmal dieser Lebewesen handelt.[5][6]
Viele pathogene (krankheitserregende) Mikroorganismen besitzen eine kurze Generationszeit, ihre Biomasse kann sich unter günstigen Bedingungen schon innerhalb von 20 bis 30 Minuten verdoppeln. Vorteilhafte Mutationen können so relativ schnell entstehen. Verstärkt wird diese Tendenz durch eine Reihe „mobiler Elemente“. Das sind DNA-Abschnitte, die im Bakterienchromosom oder außerhalb davon als Plasmide, Integrone, Transposonen vorkommen und per horizontalem Gentransfer übertragen werden können. Hierbei werden „Resistenzkassetten“ selbst zwischen phylogenetisch sehr weit entfernten Arten weitergegeben.[7]
Gegen manche Antibiotika bilden sich schneller Resistenzen als gegen andere. So bilden sich z. B. gegen Makrolide schnell Resistenzen, weil sie nur ein bestimmtes Enzym (die Translokase) hemmen (Einschritt-Resistenzmuster). Ist die Translokase mutiert, wirken sie unter Umständen nicht mehr. Deshalb gibt es gegen Makrolide bereits zunehmend Resistenzen, obwohl sie erst in den 1990er-Jahren entwickelt wurden. Dagegen greift Penicillin an sechs verschiedenen Penicillin-bindenden Proteinen (PBP) an. Es wird heute noch für viele Indikationen verwendet, obwohl es schon seit Jahrzehnten existiert.
Bisweilen werden Kombinationen von Antibiotika eingesetzt, um die Entwicklung von Resistenzen unwahrscheinlicher zu machen und die Wirkung zu verstärken. Eine Kombination von Antibiotika wird aber nicht in jedem Fall indiziert. Grundsätzlich ist es jedoch sinnvoll, denselben Stoffwechselweg an unterschiedlichen Stellen zu hemmen, da die Wahrscheinlichkeit mit jedem Antibiotikum sinkt, dass die zur Resistenzbildung notwendigen Mutationen gleichzeitig auftreten. Deshalb werden z. B. Sulfonamide mit anderen Folsäureantagonisten kombiniert.
Eine Studie stellte 2013 fest, dass die Darmflora schon bei kleinen Kindern gegen einen Großteil der Antibiotika resistent ist.[8] Dies kann sowohl mit der frühen Anwendung von Antibiotika (innerhalb des ersten Lebensjahres), als auch mit Antibiotika-Einsatz in der Nahrungsmittelindustrie und der Erstbesiedelung resistenter Keime des bei Geburt noch keimfreien Darms zusammenhängen. Die multiresistente Darmflora an sich ist eher ein Vorteil, da die Darmflora durch Antibiotika-Gabe nicht so sehr geschädigt wird. Allerdings können die Resistenzen auch an pathogene Keime übertragen werden.
Bei hohen Konzentrationen an Bakterien kommt es bei β-Lactam-Antibiotika zu einer Abnahme der Wirkung, die als Eagle-Effekt bezeichnet wird.
Ursachen
Unkritische Anwendung
Eine wichtige Ursache für Resistenzentwicklungen ist die unkritische Verschreibung von Antibiotika. Beispielhaft sei die Verschreibungspraxis bei Bronchitis, obwohl nur etwa fünf Prozent der Hustenerkrankungen auf Bakterien zurückzuführen sind, der Rest wird durch Viren verursacht. Da Antibiotika nicht gegen Viren und andere Keime wirken, sind sie hier meist wenig hilfreich. Im Gegenteil, durch den wiederholten und breiten Einsatz werden resistente Mikroorganismen gezüchtet. Bei einem echten Bedarf wirken die Antibiotika dann nicht mehr. Antibiotika sollten deshalb nur eingesetzt werden, wenn sie eindeutig indiziert sind. Dies gilt zum Beispiel für eine bakterielle Lungenentzündung oder fieberhafte Harnwegsinfektion.
Weit verbreitet ist die Ansicht, die Therapie müsse bei einem Ansprechen konsequent zu Ende geführt werden, um Resistenzbildung zu minimieren.[9] Inzwischen gibt es jedoch Studien die besagen, dass dies sogar Resistenzen fördern kann, da andere Bakterien im Körper damit den Antibiotika länger ausgesetzt sind.[10] Demnach sollten Antibiotika nur genau so lange eingesetzt werden wie nötig, wobei möglicherweise kürzere Zeiten als bisher üblich ausreichend sind.[11] Die Gefahr, dass überlebende pathogene Bakterien eine Resistenz ausbilden ist gering.[10]
Ein weiterer kritischer Punkt ist der unzureichende Abbau von Antibiotika im Körper. Dadurch gelangen Antibiotikareste ins Abwasser und Bakterien bilden Resistenzen in den Abwasserkanälen bzw. Kläranlagen infolge des Selektionsdrucks aus.
Auch durch unterdosierte Antibiotika können Bakterien Resistenzen ausbilden und Resistenzgene auf andere Bakterienindividuen übertragen. Dieser Genaustausch findet z. B. in Krankenhäusern statt, wo unterschiedliche Bakterienstämme in Kontakt miteinander kommen können und von Bett zu Bett getragen werden. So wird die Bildung von Resistenzen gefördert und auch die Verbreitung resistenter Keime (infektiöser Hospitalismus).
Studien weisen darauf hin, dass auch die Kombinationstherapie mit mehreren Antibiotika gleichzeitig die Entwicklung von Resistenzen fördert. Die Beschleunigung der Resistenzentwicklung ist wohl von der Kombination der jeweiligen Antibiotika abhängig.[12]
Einsatz in der Tiermast
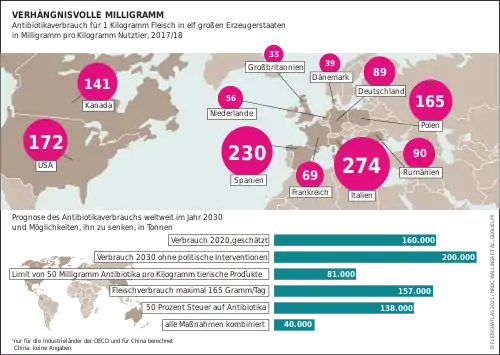
Eine weitere wichtige Ursache für die Verbreitung von Resistenzen ist die Verwendung von Antibiotika zum prophylaktischen Einsatz und als Wachstumsförderer in der landwirtschaftlichen Tiermast. Hierfür kommen laut Lester A. Mitscher von der University of Kansas fast die Hälfte der weltweit produzierten Antibiotika zum Einsatz.[14] Mehrere europäische Länder haben diese Praktik deshalb in der Massentierhaltung zur Nahrungsmittelerzeugung seit Mitte der 1990er-Jahre untersagt. In der Folge konnte die Resistenzrate reduziert werden, dennoch bleibt die Ausbreitung der Resistenzen besorgniserregend.[15] Zudem konnte nachgewiesen werden, dass die landwirtschaftliche Ausbringung von Gülle zu einer Zunahme antibiotikaresistenter Bakterien im Boden führt. Außerdem gibt es Hinweise, dass entsprechende Resistenzgene häufiger ausgetauscht werden. Aufgrund des langen Verbleibs der Resistenzen im Boden ist damit ein Eintrag entsprechender Bakterien in die menschliche Nahrungskette möglich.[16]
Seit 2006 ist EU-weit eine Wartezeit zwischen einer veterinärmedizinischen Antibiotika-Gabe und der Schlachtung vorgeschrieben, in der die Medikamente im Tierkörper abgebaut werden können (siehe unten: Abschnitt Gegenmaßnahmen). Eine direkte Übertragung resistenter Erreger auf den Menschen ist aber möglich.
2012 wurden in Deutschland fast 1.620 Tonnen Antibiotika in der Tiermast eingesetzt.[17]
Es sind mittlerweile Krankheitsfälle bekannt, bei denen bestimmte antibiotikaresistente Keime (MRSA-Keime) vom Menschen auf das Tier und zurück zum Menschen übertragen wurden. Die Keime erlangen dabei im Tier zusätzliche Resistenzen. Sie finden ihren Weg, u. a. über die Abluft der Stallungen über die Atemwege, sowie über verzehrtes Gemüse, das mit Gülle gedüngt wurde, in den menschlichen Organismus zurück.[18] Durch verminderte Gabe von Antibiotika bei unveränderten Haltungsbedingungen wurde auf Reserveantibiotika zurückgegriffen.[19][20]
Resistenzbestimmung
Es werden in der Regel automatisierte und in jedem Fall standardisierte Verfahren angewendet. Nach der Resistenzbestimmung werden die nachgewiesenen Keime als S – sensibel, I – Intermediär oder R – resistent bezeichnet. Die Resistenzbestimmung dient dem Mikrobiologen und dem behandelnden Arzt zur Auswahl einer gezielten antibiotischen Therapie.
Grundsätzlich gibt es drei Möglichkeiten der Bestimmung von Resistenzen:
Direkte Kultivierung
Abstriche werden auf Nährmedium oder in Zellkultur in Anwesenheit und in Abwesenheit von Antibiotika kultiviert. Dieses Verfahren wird allgemein „Antibiotika-Resistenzbestimmung“[21] genannt. Es ist bei den meisten Organismen das einfachste und billigste, bei manchen Organismen ist diese Methode jedoch nicht optimal, da diese zu langsam wachsen und zu aufwändig zu züchten sind (Bsp.: Mykobakterien).
Molekularbiologische Methoden / Immunologische Methoden
Mithilfe von Antikörpern, die gegen Teile des gesuchten Organismus gerichtet sind, kann das Vorhandensein von resistenten Strängen oder Pathovaren direkt oder indirekt bestimmt werden. Die bekanntesten Methoden hierbei sind ELISA und der Western Blot.
Genetische Methoden
Der Nachweis erfolgt durch gezielte Suche nach Resistenzgenen im Genom des jeweiligen Organismus. Diese Methode ist zurzeit die genaueste. Es werden Techniken wie PCR eingesetzt. Nachteile sind die oft zu lange Testdauer, der höhere Aufwand und der Preis. Auch kann ein Resistenzgen zwar vorhanden sein, aber nicht exprimiert werden, dadurch zeigt der Stamm keine Resistenz, wird jedoch durch diese Methode als resistent erkannt.
Arten der Antibiotikaresistenz
Je nach Ursprung der Resistenz lassen sich diese in verschiedene Klassen einteilen.
- Primäre Resistenz: Als primär wird eine Resistenz bezeichnet, wenn ein Antibiotikum bei einer bestimmten Gattung oder Art eine Wirkungslücke besitzt. So wirken beispielsweise Cephalosporine nicht bei Enterokokken und Ampicillin nicht bei Pseudomonas aeruginosa
- Sekundäre oder erworbene Resistenz: Diese Form der Resistenz zeichnet sich durch den Verlust der Wirksamkeit eines Antibiotikums bei einem primär nicht resistenten Bakterium aus. Sie kann spontan durch Mutation oder durch Übertragung entstehen.
- Resistenz durch Mutation: Mutationen im Genom finden natürlicherweise in einer Größenordnung von ca. 10−7 statt. Die Mutationsrate kann sich jedoch sprunghaft erhöhen, wenn durch spezifische Faktoren das Korrekturlesen („proof reading“) der DNA-Polymerase deaktiviert wird. Das kann ein Weg sein schneller Resistenzen oder günstige Eigenschaften zu erwerben. Sie können zur Resistenz gegen ein Antibiotikum führen, welche sodann bei Exposition zum entsprechenden Antibiotikum zu einem Selektionsvorteil führt.
- Resistenz durch Übertragung: Bakterien können über die Vorgänge der Transformation, Transduktion und Konjugation untereinander genetische Informationen übertragen, die auf Plasmiden, Transposons und Integrons lokalisiert sind. So können auch Resistenzgene übertragen werden.
Resistenzmechanismen
Abhängig von der Wirkungsweise und vom eingesetzten Antibiotikum entwickelten sich im Laufe der Zeit verschiedene Mechanismen zur Reduzierung oder Neutralisierung der Wirkung.
Alternative Proteine
Es wird ein alternatives Protein gebildet, das dieselbe Funktion hat wie das vom Antibiotikum blockierte. Ein Beispiel sind alternative Penicillin Bindeproteine (PBP). PBP sind für die Synthese des Mureins notwendig und werden normalerweise von β-Lactam-Antibiotika inaktiviert. Durch Mutationen entstehen neue Varianten, die nicht mehr inaktiviert werden können, dadurch wird das Bakterium resistent. Bei MRSA (Methicillin Resistent Staphylococcus aureus) ist es beispielsweise PBP2a.
Inaktivierende Proteine
Das Bakterium produziert Proteine, die das Antibiotikum neutralisieren. Bekanntestes Beispiel hierfür sind die β-Lactamasen. Diese Proteine hydrolysieren β-Lactame am β-Lactam-Ring; dadurch kann das Antibiotikum nicht mehr an den Zielproteinen, den PBP, binden und zeigt somit keine Wirkung. Escherichia coli besitzt so genannte ESBL (extended spectrum beta lactamases), die eine Vielzahl von β-Lactam-Antibiotika, wie Cephalosporine und Penicilline, neutralisieren können.
Zielmutationen
Zielproteine oder Strukturen im Bakterium sind durch Mutationen verändert. So kommt es bei vielen vancomycinresistenten Stämmen zu einer Veränderung des Mureins. Es wird anstatt einer D-Alanin/D-Alanin Verbindung eine D-Alanin/D-Lactam Verbindung erzeugt. Dadurch bindet das eingesetzte Antibiotikum nicht mehr und ist wirkungslos.
Posttranslationale/Posttranskriptionale Modifikationen
Wenn ein Antibiotikum an einer bestimmten Stelle in einem Protein bindet und es dadurch inaktiviert, kann durch eine Modifikation nach der Translation oder der Transkription die Bindungskraft stark vermindert werden. So wird das Antibiotikum nur sehr schlecht oder gar nicht mehr gebunden. Ein Resistenzmechanismus gegen Streptomycin basiert auf der Modifikation eines Asparaginsäure-Restes im ribosomalen Protein S12.
Reduzierte Aufnahme
Durch Veränderungen der Zellwand kann das Antibiotikum nicht mehr nach innen diffundieren. Bekanntestes Beispiel hierfür ist die säurefeste Zellwand von Mycobakterien. Das ermöglicht eine Resistenz gegen eine Vielzahl von Antibiotika und Toxinen.
Efflux-Pumpen
Spezielle Transportproteine (Multidrug Resistance-Related Proteine) geben in die Zelle eingedrungene Antibiotika nach außen ab, so dass die Konzentration innerhalb der Zelle niedrig genug gehalten werden kann um keinen Schaden anzurichten. Die Transporter, die hierfür zuständig sind, können in bestimmte Klassen eingeteilt werden. Ein Beispiel ist der RND-Transporter (Resistance-Nodulation-Cell Division), wovon Escherichia coli alleine sieben verschiedene besitzt.
Überproduktion
Das vom Antibiotikum inaktivierte Protein wird in größeren Mengen als benötigt produziert. So inaktiviert das Antibiotikum den größten Teil des vorhandenen Proteins, es bleiben jedoch noch genügend funktionsfähige Moleküle erhalten, die ein Weiterleben der Zelle ermöglichen. So kann eine Überexpression von PBP zu einer Resistenz gegen Betalactame führen.
Alternative Stoffwechselwege
Ein Stoffwechselprodukt, das von einem Antibiotikum blockiert wird, kann unter bestimmten Umständen durch ein anderes ersetzt werden. Bei Staphylococcus aureus kann eine Resistenz gegen Trimethoprim durch eine Auxotrophie von Trihydrofolat erreicht werden. Es wird im Stoffwechsel kein Trihydrofolat mehr benötigt, daher kann das Antibiotikum, welches dieses Molekül inaktiviert, nicht mehr wirken.
Biofilme
Biofilme sind in eine Schleim-Matrix eingebettete Ansammlungen von Mikroorganismen. Durch die dichte Besiedlung kommt es zur Ausscheidung von verschiedenen Substanzen als Schutz nach außen, auch ist eine Übertragung von genetischem Material und damit von Resistenzgenen vereinfacht. Allerdings ist der genaue Mechanismus noch nicht bekannt.[22]
Gezielte Mutationen
Durch die Exprimierung bestimmter Faktoren kann die Fähigkeit der DNA-Polymerase zur Fehlerkorrektur stark gesenkt werden. Dadurch lassen sich leichter Mutationen induzieren. Die Resistenzbildung gegen Ciprofloxacin in einem Escherichia-coli-Stamm konnte durch Deaktivieren des Mutationsfaktors lexA verhindert werden.[23]
Eindringen in Körperzellen
Es konnte im in-vitro-Modell mit Staphylococcus aureus gezeigt werden, dass Bakterien in Epithelzellen der Lunge eindringen können und dort in eine Art Ruhezustand mit stark veränderter Genaktivität versetzt werden. So wird mit reduziertem Stoffwechsel die Produktion zelltoxischer Substanzen und die Teilungsrate verringert. Erst beim Tod der Wirtszelle wird das bis dahin vor Antibiotika und Immunsystem geschützte Bakterium freigesetzt und aktiviert. Eine Behandlung mit Antibiotika tötete im Modell zwar die meisten Zellen innerhalb von vier Tagen ab, allerdings konnten auch noch nach zwei Wochen lebende Mikroben nachgewiesen werden. Dies könnte somit ein Mechanismus sein, der zu chronischen und wiederkehrenden Infektionen beiträgt.[24]
Vorkommen
Sogenannte Problemkeime sind dabei vor allem der Methicillin-resistente Staphylococcus aureus (MRSA), Pseudomonas spec., Escherichia coli und Mycobacterium tuberculosis. Schätzungen des Centers for Disease Control and Prevention gehen für die USA von zwei Millionen im Krankenhaus erworbenen Infektionen für das Jahr 2004 aus, mit etwa 90.000 Todesfällen.
Bei Therapie ohne Erregersicherung sind gegen Penicillin und Makrolidantibiotika weniger empfindliche Pneumokokken und A-Streptokokken, weniger gegen Amoxicillin empfindlicher Haemophilus sowie gegenüber Trimethoprim bzw. Cotrimoxazol, Nitrofurantoin, Fosfomycin und Fluorchinolone resistente Escherichia coli zu beachten.[25]
Besonders anfällig sind Patienten mit Immunschwächen, wie Schwerkranke oder mit HIV infizierte Personen. Auch bei Transplantationen liegt eine Gefährdung vor, weil diese Patienten Immunsuppressiva einnehmen, um der Gefahr entgegenzuwirken, dass das Immunsystem des Körpers das Transplantat abstößt.
In den USA sind etwa 70 % der in Krankenhäusern erworbenen infektiösen Keime resistent gegen mindestens ein Antibiotikum. Patienten sind dabei oft mit Bakterienstämmen infiziert, die gegen mehrere Antibiotika resistent sind.
Im Jahr 2005 infizierten sich rund drei Millionen Europäer mit Keimen, die gegen bekannte Antibiotika resistent sind – 50.000 von ihnen starben daran.[26] Für andere Industrienationen gelten im Moment niedrigere Zahlen. In England und Wales verstarben 1992 51 Patienten an Infekten mit resistenten Mikroben, im Jahre 2002 waren es 800. In Schweden, Norwegen, den Niederlanden und Dänemark fallen die Resistenzquoten wesentlich besser aus, weil hier weniger großzügig verschrieben wird.
Problematisch ist die Situation auch in den Entwicklungsländern, in denen die Todesrate durch Infektionskrankheiten bei 55 % liegt (AIDS mit eingerechnet).[27] Es fehlt hier oftmals das Geld für moderne Antibiotika oder an Investitionen in Hygiene und bessere oder überhaupt sanitäre Anlagen, sodass sich z. B. antibiotikaresistente Typhuserreger[28] schnell ausbreiten.
Gesundheitspolitische Gegenmaßnahmen
WHO (World Health Organization)
Laut Global Report der WHO von April 2014 sind weltweit Maßnahmen notwendig, zu denen u. a. ein leistungsfähiges Netz von Laboren zählt, welches aufkommende Resistenzen rasch erkennen und gewonnene Informationen für ein rasches Gegensteuern sammeln und weitergeben kann. Nicht alle Länder sind dazu bislang in der Lage. Die WHO empfiehlt ferner relativ einfache Maßnahmen. Zum Beispiel sollen Ärzte nur noch dann Antibiotika verschreiben, wenn deren sicherer Einsatz als wirklich notwendig erachtet wird. Patienten sollen möglichst keine Breitband-Antibiotika erhalten, die gegen verschiedene Erreger eine gleichzeitige Wirkung entfalten können, da diese Medikamente auf viele Erreger nicht mehr ansprechen. Die Experten der WHO raten dazu, nach genauen Untersuchungen gezielte Wirkstoffe einzusetzen. Denn gerade wenn Antibiotika in großer Menge eingesetzt werden, nimmt die Wahrscheinlichkeit der Resistenzbildung von Krankheitserregern zu.
United Nations
Am Rande der UN-Vollversammlung in New York fand im September 2016 das „High Level Meeting on Antimicrobial Resistance“ zur globalen Bekämpfung von Antibiotikaresistenzen statt. Vertreter aus Politik, internationalen Organisationen und Industrie diskutierten unter der Führung von UN-Generalsekretär Ban Ki-moon über Handlungsansätze und Lösungswege, um multiresistente Keime in Krankenhäusern zu eliminieren sowie Antibiotikaresistenzen vorzubeugen.[29] Dabei wurde der Entwurf einer politischen Erklärung über Antibiotikaresistenz („Draft political declaration of the high-level meeting of the General Assembly on antimicrobial resistance“)[30] verabschiedet, die einen sektorenübergreifenden Ansatz fordert, der die Gesundheit von Mensch und Tier sowie eine intakte Umwelt berücksichtigt. Die Bekämpfung von Antibiotikaresistenzen soll regional, national und international unter einer länderübergreifenden Zusammenarbeit von Regierungs- und Nichtregierungsorganisationen (NGO) sowie der Industrie erfolgen.
Europäische Union
Laut dem Surveillance Atlas of Infectious Diseases, veröffentlicht (Stand 2020) vom Europäischen Zentrum für die Prävention und die Kontrolle von Krankheiten, ist die Antibiotikaresistenz in Griechenland mit 63,9 % problematisch hoch, gefolgt von Rumänien mit 29,5 % und Italien mit 26,8 %. In Deutschland ist sie sehr gering mit 0,4 %.[31] Die EU-Kommission sieht Antibiotikaresistenzen als Gefahr für die öffentliche Gesundheit in Europa und sorgt sich um den hohen Einsatz von Antibiotika in den EU-Mitgliedsstaaten. Sie will gegen die Ausbreitung multiresistenter Keime vorgehen.[32]
Seit 2006 sind so genannte Leistungsverstärker oder Mastbeschleuniger EU-weit verboten. Infektionen am Vieh dürfen weiterhin mit Antibiotika behandelt werden, was jedoch aus Tierschutzgründen auch nötig ist. Die Schlachtung darf jedoch erst nach einer gewissen Wartezeit erfolgen, in der das Tier die Medikamente abgebaut hat.
Am 25. Oktober 2018 hat das Europäische Parlament eine neue Verordnung verabschiedet, mit der der Einsatz von Antibiotika in der Nutztierhaltung eingeschränkt wird. Sie sieht vor, dass
- bestimmte Antibiotika (sogenannte Reserveantibiotika) nur noch für Menschen reserviert sind, also nicht mehr in der Tierhaltung verabreicht werden dürfen,
- eine präventive Einnahme von Antibiotika nur noch in Ausnahmefällen erlaubt ist, die ein Tierarzt begründen muss
- und keine Antibiotika mehr zur Mästung der Tiere eingesetzt werden dürfen. Das heißt, es dürfen auch keine mit Antibiotika angereicherten Futtermittel mehr importiert werden.
Die Verordnung muss noch vom Rat der Mitgliedstaaten vor der Veröffentlichung im Amtsblatt förmlich angenommen werden. Anschließend haben die EU-Staaten drei Jahre Zeit, um die neuen Vorschriften umzusetzen. Damit greift die Verordnung nicht vor Ende 2021.[33][34][35]
Meldeverpflichtung über Abgabe und Einsatz bei Tieren
Seit 2011 müssen pharmazeutische Unternehmen und Großhändler ihre jährlich an tierärztliche Hausapotheken abgegebene Antibiotikamengen regional aufgegliedert an ein Tierarzneimittelregister melden. Dadurch sollen mögliche Zusammenhänge zwischen dem Einsatz von Antibiotika und den Entwicklungstendenzen von Resistenzen erkannt werden.[36]
Im April 2014 trat die 16. Novelle des Arzneimittelgesetzes (AMG) in Kraft. Seitdem sind Halter von Mastrindern, -schweinen, -hähnchen und -puten, sofern die gesetzlich festgelegten Untergrenzen überschritten werden, nach § 58b AMG verpflichtet, Antibiotikaanwendungen an eine bundesweite Tierarzneimittel/Antibiotika-Datenbank (TAM) zu melden. Außerdem müssen Tierhalter bei hoher Therapiehäufigkeit mit ihrem Tierarzt gemeinsam ein auf die jeweiligen betrieblichen Erfordernisse angepasstes Konzept für eine Reduktion der verabreichten Antibiotikamengen entwickeln.[37]
Deutsche Antibiotika-Resistenzstrategie (DART)
Im Mai 2015 wurde die Deutsche Antibiotika-Resistenzstrategie 2020 beschlossen. Ziele sind die Verhinderung der Verbreitung und Entstehung von Resistenzen sowie die Förderung von Forschung und Entwicklung zum Thema.[38][39]
Im Oktober 2015 wurde auf dem G7-Gesundheitsministertreffen eine Erklärung zur Bekämpfung von Antibiotikaresistenzen verabschiedet.[40]
Niederlande
In den Niederlanden setzen die Behörden nicht auf Sanktionen. Vorbildliche Landwirte sollen dort künftig eine Prämie erhalten.[17]
In den letzten fünf Jahren ist es laut niederländischer Tiermedizin-Behörde gelungen, den Antibiotikaeinsatz im Lande zu halbieren.[17]
Strategie Antibiotikaresistenzen Schweiz (StAR)
Am 18. November 2015 hat der Bundesrat die nationale Strategie gegen Antibiotikaresistenzen (StAR) verabschiedet.[41]
Vorsorge
Siehe auch
Literatur
- David G. White (Hrsg.): Frontiers in Antimicrobial Resistance: A Tribute to Stuart B. Levy. American Society for Microbiology, Washington (DC) 2005, ISBN 978-1-55581-329-1.
- R. C. Mahajan (Hrsg.): Multi-Drug Resistance in Emerging and Re-Emerging Diseases. Indian National Science Academy/ Narosa Publication House, New Delhi 2001, ISBN 978-0-8493-0983-0.
- OECD: Stemming the Superbug Tide: Just A Few Dollars More. In: OECD Health Policy Studies. ISSN 2074-319X, OECD Publishing, Paris 2018, doi:10.1787/9789264307599-en.
Rundfunkberichte
- Dagmar Röhrlich: Der Kampf gegen multiresistente Keime, Deutschlandfunk – Hintergrund vom 7. Juli 2017
Weblinks
- Daschner: Infos zum Thema Antibiotika-Resistenz. gesundzuhause.de
- Schnelle Diagnostik bakterieller Infektionserreger (PDF) Robert Koch-Institut Bulletin
- Maßnahmen beim Auftreten multiresistenter Erreger (MRE) (Memento vom 17. August 2010 im Internet Archive)
- Initiative „Zündstoff Antibiotika-Resistenz“
- The European Antimicrobial Resistance Surveillance System
- BURDEN of Resistance and Disease in European Nations – Die Bestimmung der finanziellen Bürde von Antibiotikaresistenz in Europa
- SARI – Surveillance der Antibiotika-Anwendung und der bakteriellen Resistenzen auf Intensivstationen
- Antibiotic Resistance in Bacteria: Origins and Emergence (Memento vom 13. Oktober 2008 im Internet Archive)
- Antimicrobial resistance: global report on surveillance 2014
- Faktenblatt Antibiotika-Resistenzen der ABDA (PDF) Stand: 7. November 2016; abgerufen am 24. März 2017.
- Antibiotikaresistenzen – Informationen vom Bundesamt für Gesundheit
Einzelnachweise
- Vanessa M. D’Costa, Katherine M. McGrann, Donald W. Hughes, Gerard D. Wright: Sampling the antibiotic resistome. In: Science. Band 311, Nr. 5759, 20. Januar 2006, S. 374–377. PMID 16424339, doi:10.1126/science.1120800.
- Christopher JL Murray, Kevin Shunji Ikuta, Fablina Sharara, Lucien Swetschinski, Gisela Robles Aguilar: Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. In: The Lancet. Band 399, Nr. 10325, 12. Februar 2022, ISSN 0140-6736, S. 629–655, doi:10.1016/S0140-67362102724-0, PMID 35065702 (thelancet.com [abgerufen am 14. Februar 2022]).
- Multiresistente Keime. WHO-Umfrage enthüllt gewaltige Wissenslücken . In: Spiegel-Online, 16. November 2015. Abgerufen am 24. September 2016.
- Could ants be the solution to antibiotic crisis?. In: The Guardian, 24. September 2016; abgerufen am 24. September 2016.
- Kirandeep Bhullar, Nicholas Waglechner, Andrew Pawlowski, Kalinka Koteva, Eric D. Banks, Michael D. Johnston, Hazel A. Barton, Gerard D. Wright: Antibiotic Resistance is prevalent in an isolated cave microbiome. In: PLoS ONE. Band 7, Nr. 4, 11. April 2012, doi:10.1371/journal.pone.0034953.
- Millionen Jahre isoliert: Uralt-Bakterien sind resistent gegen Antibiotika. In: Spiegel Online. 12. April 2012.
- Patrice Courvalin: Transfer of antibiotic resistance genes between gram-positive and gram-negative bacteria. In: Antimicrobial Agents and Chemotherapy. Band 38, Nr. 7, Juli 1994, S. 1447–1451. PMID 7979269, doi:10.1128/AAC.38.7.1447.
- Aime M. Moore, Sanket Patel, Kevin J. Forsberg et al.: Pediatric Fecal Microbiota Harbor Diverse and Novel Antibiotic Resistance Genes. In: PLoS ONE. Band 8, 2013, S. e78822, doi:10.1371/journal.pone.0078822.
- Gerd Herold: Innere Medizin 2012. Eine vorlesungsorientierte Darstellung. Unter Berücksichtigung des Gegenstandskataloges für die Ärztliche Prüfung. Mit ICD 10-Schlüssel im Text und Stichwortverzeichnis. Herold, Köln 2012, ISBN 978-3-9814660-1-0.
- Martin J Llewelyn, Jennifer M Fitzpatrick, Elizabeth Darwin, SarahTonkin-Crine, Cliff Gorton: The antibiotic course has had its day. In: BMJ/ British Medical Association. 26. Juli 2017, ISSN 0959-8138, S. j3418, doi:10.1136/bmj.j3418 (bmj.com [abgerufen am 7. Dezember 2019]).
- WHO | Does stopping a course of antibiotics early lead to antibiotic resistance? Abgerufen am 7. Dezember 2019.
- R. Pena-Miller, D. Laehnemann, G. Jansen, A. Fuentes-Hernandez, P. Rosenstiel et al.: When the most potent combination of antibiotics selects for the greatest bacterial load: the smile-frown transition. In: PLoS Biology. Band 11, Nr. 4, 2013, S. e1001540. doi:10.1371/journal.pbio.1001540.
- Fleischatlas 2021 - Daten und Fakten über Tiere als Nahrungsmittel Berlin 2021, ISBN 978-3-86928-224-4, dort S. 31
- Humans May Lose Battle With Bacteria, Medicinal Chemist’s Research Shows. In: ScienceDaily. 24. April 2008.
- Henrik C. Wegener: Antibiotics in animal feed and their role in resistance development. In: Current Opinion in Microbiology. Band 6, Nr. 5, Oktober 2003, S. 439–445. PMID 14572534, doi:10.1016/j.mib.2003.09.009
- Holger Heuer, Kornelia Smalla: Manure and sulfadiazine synergistically increased bacterial antibiotic resistance in soil over at least two months. In: Environmental Microbiology. Bd. 9, Nr. 3, 2007, S. 657–666. PMID 17298366, doi:10.1111/j.1462-2920.2006.01185.x.
- Deutschlandfunk: Umwelt und Verbraucher. 19. November 2013: deutschlandfunk.de: Neuer Aktionsplan vorgestellt (23. November 2013).
- Killer Keime aus dem Tierstall. Film von Frank Bowinkelmann und Valentin Thurn, 52 Minuten für arte/NDR, Erstausstrahlung: 9. Januar 2014, Der Beitrag auf YouTube (1. Februar 2014)
- Zweite Datenerhebung zur Antibiotikaabgabe in der Tiermedizin, Gesamtmenge 2012 (Memento vom 28. Januar 2015 im Internet Archive), Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL), abgerufen am 28. Januar 2015
- ARD: Tagesthemen vom 19. Januar 2015
- Eintrag zu Antibiotika-Resistenzbestimmung im Flexikon, einem Wiki der Firma DocCheck, abgerufen am 6. Dezember 2013.
- Tom Coenye, Elke Peeters, Hans J. Nelis: Biofilm formation by Propionibacterium acnes is associated with increased resistance to antimicrobial agents and increased production of putative virulence factors. In: Research in Microbiology. Band 158, Nr. 4, 21. Februar 2007, S. 386–392. PMID 17399956.
- Ryan T. Cirz, Jodie K. Chin, David R. Andes, Valérie de Crécy-Lagard, William A. Craig, Floyd E. Romesberg: Inhibition of mutation and combating the evolution of antibiotic resistance. In: PLoS Biology. Band 3, Nr. 6, 10. Mai 2005, doi:10.1371/journal.pbio.0030176.
- Christian Garzoni et al.: A global view of Staphylococcus aureus whole genome expression upon internalization in human epithelial cells. In: BMC Genomics. Bd. 8, 14. Juni 2007, doi:10.1186/1471-2164-8-171
- U. Schwabe, D. Paffrath: Arzneiverordnungs-Report 2014 Aktuelle Daten, Kosten, Trends und Kommentare. Springer, Berlin / Heidelberg 2014, ISBN 978-3-662-43487-1, S. 352.
- Wolfgang Stieler: Mediziner warnen vor „Post-Antibiotika-Zeitalter“. In: heise online. 30. März 2007.
- UC Atlas of Global Inequality: Cause of Death (Memento vom 18. Juni 2014 im Internet Archive). Website der University of California, Santa Cruz.
- Marieke Degen: Resistenz ungehindert auf dem Vormarsch. Deutschlandfunk, Forschung aktuell, 16. Januar 2014.
- United Nations high-level meeting on antimicrobial resistance – Antimicrobial resistance summit to shape the international agenda. WHO, 21. September 2016.
- Draft political declaration of the high-level meeting of the General Assembly on antimicrobial resistance. (PDF) United Nations, 21. September 2016
- https://atlas.ecdc.europa.eu/public/index.aspx
- Antimicrobial Resistance. Website der Europäischen Kommission.
- Plenum – Oktober II 2018 – Tierarzneimittel-Paket. (PDF) In: Auf einen Blick. Europäisches Parlament, 2018, abgerufen am 19. November 2018.
- EU beschränkt Einsatz von Antibiotika bei Nutztieren. In: BR24. 16. November 2018 (br.de [abgerufen am 19. November 2018]).
- Bekämpfung der Ausbreitung der Antibiotikaresistenz von Tieren auf Menschen | Aktuelles | Europäisches Parlament. 25. Oktober 2018 (europa.eu [abgerufen am 19. November 2018]).
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL): Tierarzneimittel-Abgabemengen-Register, abgerufen am 27. Februar 2020.
- Die Bundesregierung: Weniger Antibiotika in der Tiermast, 19. Juni 2019. Abgerufen am 27. Februar 2020.
- DART 2020 – Deutsche Antibiotika-Resistenzstrategie, Website des Bundesgesundheitsministeriums (BMG) zum Thema; abgerufen am 27. Februar 2020.
- Broschüre des Bundesgesundheitsministeriums: DART 2020 – Antibiotika-Resistenzen bekämpfen zum Wohl von Mensch und Tier, (PDF; 315 kB) bundesgesundheitsministerium.de, 13. Mai 2015; abgerufen am 27. Februar 2020.
- Antibiotika-Resistenzen. (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Archiviert vom Original am 29. Oktober 2015; abgerufen am 28. Oktober 2015.
- Die Umsetzung der Strategie Antibiotikaresistenzen läuft auf Hochtouren. 18. November 2016, abgerufen am 24. Mai 2020.